2019年4月16日
理化学研究所
株式会社伏見製薬所
日本ウォーターズ株式会社
国立がん研究センター
均一な構造の抗体-薬物複合体
-糖鎖を利用した薬物連結により効果的な合成方法を実現-
理化学研究所(理研)開拓研究本部伊藤細胞制御化学研究室の眞鍋史乃専任研究員と山口芳樹客員研究員、株式会社伏見製薬所の伏見豊社長、日本ウォーターズ株式会社の廣瀬賢治マネージャー、国立がん研究センターの松村保広分野長らの共同研究グループ※は、抗体の糖鎖構造を改変しつつ糖鎖部分に薬物を結合させた均一な構造の「抗体-薬物複合体(ADC)」を作製する手法を開発しました。
本研究成果は、薬物動態、安全性、再現性に優れたADCの製造に貢献すると期待できます。
抗体医薬[1]の一種であるADCは、抗体の特異性により効果的に薬物をがん組織に運び、酵素依存的または徐々に薬物を放出するため、副作用の少ない医薬品として期待されています。一方、現在使用されているADCは、抗体に結合する薬物の数や位置が異なる複数の化学種から構成されており、薬物動態や再現性などの観点から、均一な構造のADCの合成法が求められていました。
今回、共同研究グループは、糖鎖加水分解酵素とその改変体を組み合わせることにより、均一な構造のADCを作製できる手法を開発しました。詳しい解析に基づく反応条件の最適化により、糖鎖の付加の過程で起こる副反応を抑えることが可能となりました。また、合成したADCは、抗原が高発現しているがん細胞には毒性を示す一方、そうではない細胞には毒性を示さず、抗原依存的に殺細胞効果を示すことが明らかになりました。
本研究は、米国化学会の科学雑誌『Bioconjugate Chem』のオンライン版(4月2日付け)に掲載されました。
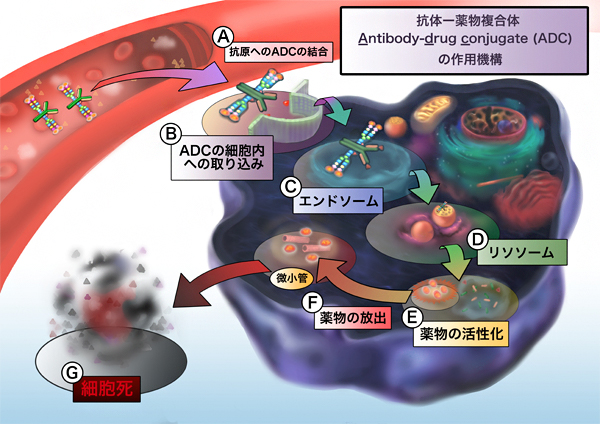
図 抗体-薬物複合体の作用機序
※共同研究グループ
理化学研究所
開拓研究本部 伊藤細胞制御化学研究室
専任研究員 眞鍋 史乃(まなべ しの)
客員研究員 山口 芳樹(やまぐち よしき)
(グローバル研究クラスタ 糖鎖構造生物学研究チーム チームリーダー(研究当時)/ 現:東北医科薬科大学教授)
グローバル研究クラスタ 糖鎖構造生物学研究チーム(研究当時)
人材派遣 松本 加奈(まつも とかな)
株式会社 伏見製薬所
社長 伏見 豊(ふしみ ゆたか)
日本ウォーターズ株式会社
ビジネスディベロップメント マネージャー 廣瀬 賢治(ひろせ けんじ)
テクノロジーセンター スーパーバイザー 川瀬 泰司(かわせ たいじ)
国立がん研究センター 先端医療開発センター 新薬開発分野
分野長 松村 保広(まつむら やすひろ)
背景
次世代抗体医薬として、「抗体-薬物複合体(antibody-drug conjugate: ADC)」の研究開発が盛んに行われています。ADCは、がん細胞に高発現している抗原に対して高い親和性を持つ抗体に殺細胞効果のある低分子薬物を結合させたもので、この抗原に対する高い親和性によりがん組織へ運ばれたADCの薬物は、がん組織に到達した後、徐々に放出されるように化学修飾されています。
そのため、薬物は抗体に結合している間は毒性を示さず、放出されたときにのみ毒性を示しますので、正常組織を壊しにくく、副作用を低減させる効果もあります。
現在、乳がん治療に用いられるトラスツズマブ エムタンシンをはじめとして、4種類のADCが承認されており、世界中で60種類以上のADCが開発中です。現在使用されているADCでは、抗体と薬物を結合するのに抗体のリシン残基のアミノ基、あるいはシステイン残基のスルフヒドリル基を介して結合する手法が使われています。しかし、抗体には同一アミノ酸残基が複数存在するため、これらの方法では位置選択的な反応ができず、結合薬物の数と位置が異なる多種類のADCが生成されてしまいます。このように、薬物の結合位置や数が異なるADCは、薬物の放出速度や安定性などが異なるため、薬効や合成面での再現性が問題となります。また、健康医療戦略推進法のレギュラトリーサイエンス[2]の観点からも、均一な構造のADCの作製法の開発が望まれていました。
研究手法と成果
共同研究グループは、抗体のFc領域[3]に存在する1対のアスパラギン残基、Asn297に結合したN-結合型糖鎖[4]に着目しました。糖鎖構造が抗体医薬の機能に影響を及ぼすことや、宿主由来の非ヒト型糖鎖が免疫原性(抗原の免疫反応を引き起こす性質)を持つことが知られています。現在使用されている抗体医薬では、糖鎖構造は不均一です。
そこで、まず糖鎖加水分解酵素(ENGase)を用いて、抗体から還元末端のN-アセチルグルコサミン(GlcNAc)のみを残して、糖鎖の不均一性部分を切断しました。次に、鶏卵から単離したヒト型糖鎖のシアル酸カルボキシル基に、生体直交性反応[5]が可能なアジド基(N3-)を結合しました。このアジド基が結合された糖鎖を、改変ENGase(加水分解能は抑える一方で糖鎖転移能は保持)を用いて、前述の抗体のN-アセチルグルコサミンに付加しました。この付加物について詳細な分析を行い、反応条件を最適化することで副反応を抑えることを確認しました。続いて、強い細胞毒性を持つ薬物のMMAE[6]を、細胞内ペプチド結合加水分解酵素であるカテプシンBの切断により放出できるように化学修飾した後、生体直交性反応により糖鎖部分に結合させました(図1)。
次に、合成したADCは、超高性能液体クロマトグラフィー(UPLC)[7]と四重極飛行時間型質量分析(Q-TOF/MS)[8]を組み合わせたインタクト質量分析[9]、ペプチドマッピング[10]などで詳細に特性解析を行いました。その結果、糖鎖部位のみに四つの薬物が結合している均一構造を持つことが証明されました(図2)。また、合成したADCは、抗原であるHER2[11]が高く発現している細胞では活性を示す一方、HER2発現が低い細胞では活性を示しませんでした。
今後の期待
本手法では、糖鎖部分に薬物を結合させており、抗体の可変領域には薬物が結合しないので、抗体の抗原への親和性を損なうことがありません。さらに、ADC製造過程では、免疫原性を持つ糖鎖部分も除去できることから抗体医薬やADC製造のコストを低減させることも期待できます。今後、さまざまな抗体に応用し、汎用性を広げていきたいと考えています。
原論文情報
- Shino Manabe, Yoshiki Yamaguchi, Kana Matsumoto, Hirobumi Fuchigami, Taiji Kawase, Kenji Hirose, Ai Mitani, Wataru Sumiyoshi, Takashi Kinoshita, Junpei Abe, Masahiro Yasunaga, Yasuhiro Matsumura, and Yukishige Ito, "Characterization of antibody products obtained through enzymatic and non-enzymatic glycosylation reactions with a glycan oxazoline and preparation of homogeneous antibody-drug conjugate via Fc N-glycan", Bioconjugate Chemistry, 10.1021/acs.bioconjchem.9b00132
発表者
理化学研究所
主任研究員研究室 伊藤細胞制御化学研究室
専任研究員 眞鍋 史乃(まなべ しの)
客員研究員 山口 芳樹(やまぐち よしき)
(グローバル研究クラスタ 糖鎖構造生物学研究チーム チームリーダー(研究当時) / 現:東北医科薬科大学 教授)
株式会社 伏見製薬所
社長 伏見 豊(ふしみ ゆたか)
日本ウォーターズ株式会社
ビジネスディベロップメント マネージャー 廣瀬 賢治(ひろせ けんじ)
国立がん研究センター 先端医療開発センター新薬開発分野
分野長 松村 保広(まつむら やすひろ)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
国立がん研究センター 企画戦略局 広報企画室(柏キャンパス)
Tel: 04-7133-1111(代表) / Fax: 04-7130-0195
E-mail:ncc-admin[at]ncc.go.jp
株式会社 伏見製薬所 港町工場 開発課
Tel: 0877-22-6283 / Fax: 0877-22-6280
E-mail:dozaki[at]fushimi.co.jp
日本ウォーターズ株式会社 品川本社 フィールドマーケティング
Tel: 03-3471-7191 / Fax: 03-3471-7118
E-mail:kenji_hirose[at]waters.com
※上記の[at]は@に置き換えてください。
産業利用に関するお問い合わせ
補足説明
- 1.抗体医薬
抗体は、抗原に対して非常に強く結合するタンパク質である。疾患と関連した抗原に特異的に結合する抗体は治療効果を示す。抗体医薬は、がんやリウマチなどの治療に用いられるが、副作用の少ない効果的な治療薬として注目されており、病気と関連する抗原の探索も行われている。 - 2.レギュラトリーサイエンス
医療分野の研究開発の成果の実用化に際し、その品質、有効性、安全性を科学的知見に基づき適正かつ迅速に予測、評価、判断することに関する科学(健康医療戦略推進法より)。 - 3.Fc領域
抗体をタンパク質分解酵素のパパインで消化すると三つの断片に分かれる。N末端側のニつの断片をFab領域、C末端側の断片をFc領域という。 - 4.N-結合型糖鎖
50%以上のタンパク質には、翻訳後修飾として、各種の糖ユニットがグリコシド結合によってつながった糖鎖が結合している。タンパク質の翻訳後修飾には、大きく分けてアスパラギンの側鎖アミド結合を介してタンパク質主鎖と糖鎖が結合する N-結合型糖鎖とセリン/スレオニンの側鎖水酸基を介してタンパク質主鎖と糖鎖が結合している O-結合型糖鎖、マンノースとトリプトファンが炭素-炭素結合で結合している C-結合型糖鎖に分類される。 N-結合型糖鎖は、さらにその構造によりコンプレックス型、高マンノース型、ハイブリッド型に分類される。抗体はFc領域に、1対のコンプレックス型の N-結合型糖鎖を持つ。 - 5.生体直交性反応
生細胞あるいは生物個体において、特定の生体分子を選択的に化学修飾できる反応。最も有名なものは、銅イオン存在下でのアルキンとアジド基の間でのHuisgen反応だが、近年さまざまな反応が開発されている。 - 6.MMAE
海洋性軟体動物から誘導されたチューブリン重合を阻害する強力な抗有糸分裂薬で、その強力な毒性のために単独投与はできない。MMAEはmonomethyl auristatin Eの略。 - 7.超高性能液体クロマトグラフィー(UPLC)
カラムクロマトグラフィーの一種であり、従来から広く使用されている高速液体クロマトグラフィー(HPLC)よりも数倍以上の高速、高分離な分析が可能なことから超高性能液体クロマトグラフィーと呼ばれる。カラム充填剤に極めて小さい粒子(2μm以下)を用い、超高圧(15,000psi以上)にも耐えられる液体クロマトグラフを使用することで、超高性能を可能としている。 - 8.四重極飛行時間型質量分析(Q-TOF/MS)
四重極(quadrupole)質量分析計と飛行時間(time-of-flight)型質量分析計を直列に配置した質量分析計。四重極質量分析計は、4本の柱状電極(四重極)に直流電圧と交流電圧を印加して四重極電場を発生させることで、イオンを m/z値に応じて分離する方式で、イオン選択ができることからマスフィルターともいわれる。飛行時間型質量分析計は、ある一定のエネルギーで加速したイオンを真空のフィールドフリーで飛行させ、検出器まで到達する時間の違いによってイオンを m/z値に応じて分離する方式で、低分子から高分子まで高い精度の質量情報が得られる。両者の間に衝突誘起解離のための領域を持つQ-TOF型質量分析計では、衝突励起によって起こるイオンのフラグメンテーションから化合物構造情報を得られる。 - 9.インタクト質量分析
タンパク質を酵素などで消化せずにそのままの状態で行う質量分析。タンパク質の構造変化や不均一性など全体的な情報が迅速に得られる分析手法である。 - 10.ペプチドマッピング
抗体などの治療用タンパク質の特性解析、確認試験に用いられる分析手法の一つ。目的タンパク質を化学的またはプロテアーゼなどで酵素的に分解した、分子量の小さいペプチド断片を逆相クロマトグラフィーにより分離し、UVや質量分析により解析する手法。一次配列の確認、翻訳後修飾やアミノ酸変異を検出できる。 - 11.HER2
細胞表面に存在する受容体型チロシンキナーゼで、正常細胞にも存在し、細胞増殖、分化などに関与している。がん細胞では、HER2遺伝子に増幅や変異がおこり、乳がん、胃がんなどで高発現する。トラスツズマブは、HER2を標的としたモノクローナル抗体であり、抗体医薬として使用されている。
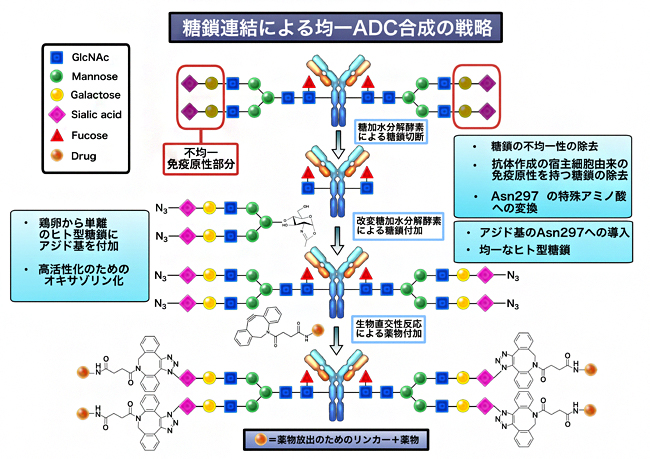
図1 糖鎖連結均一抗体-薬物複合体作製戦略
- 1.抗体のFc領域N-結合型糖鎖の構造を糖加水分解酵素(ENGase)により、還元末端のN-アセチルグルコサミンのみを残して、糖鎖の不均一性部分を切断する。
- 2.鶏卵から単離したヒト型糖鎖にアジド基(N3-)を付加する。
- 3.抗体に改変ENGaseを用いて、糖鎖を結合させる。
- 4.強い細胞毒性を持つ薬物のMMAEを化学修飾した後、生体直交性反応により糖鎖部分に結合させる。
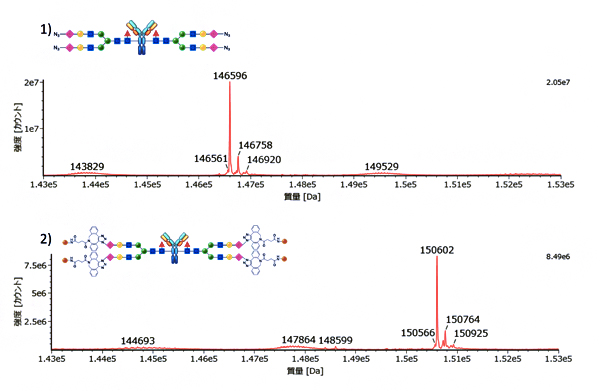
図2 生成物のインタクト質量分析
- 1.アジド基を持つ糖鎖を付加した抗体(図1の3)の質量分析スペクトル。
- 2.最終生成物の抗体薬物複合体の質量分析スペクトル。
