理化学研究所(理研)生命機能科学研究センター集積バイオデバイス研究チームの田中陽チームリーダー、太田亘俊研究員、北海道大学の与那嶺雄介助教、東京大学大学院の小関泰之准教授、九州大学の星野友准教授らの共同研究グループ※は、ガラス製マイクロ流体チップ[1]に「ダム構造」を持たせることで、泳ぐ微生物の単離と培養をマイクロ流路中で行い、複数の細胞の代謝物を一細胞ごとに経時測定することに成功しました。
本研究成果は、動きが多く継続的な観察の難しい微生物の追跡を可能とし、特定の代謝を行う微生物細胞の選別に応用できるため、バイオ燃料や栄養源の高効率作製や医薬品などの有用物質を産生する微生物のスクリーニングに貢献すると期待できます。
同種の細胞集団の中から、有用物質を多く産生する株を単離するためには、一つ一つの細胞を捕捉し、生かしたままで、その代謝物を分析しますが、特に動きの速い微生物の場合は、測定中に細胞を見失わないようにする必要があります。
今回、共同研究グループは、厚さ0.9mmのガラス製マイクロ流体チップを作製し、チップ中のマイクロ流路をダムのような構造によってせき止め、細胞培養液を常に流すことで、速く泳ぐ微生物であるユーグレナ[2]を一つずつダムの縁に留めて培養することに成功しました。さらに、非侵襲的に代謝物を計測できるラマン分光法[3]と組み合わせて、バイオ燃料成分の原料であるパラミロン[4]がユーグレナ細胞内で産生される様子を経時測定しました。
本研究は、国際科学雑誌『Analytical Chemistry』オンライン版(7月8日付け:日本時間7月9日)に掲載されます。
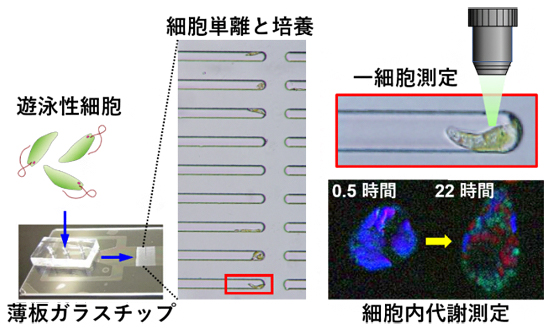
図 ガラス製マイクロ流体チップ内での泳ぐ細胞の単離・培養・代謝測定
※共同研究グループ
理化学研究所 生命機能科学研究センター 集積バイオデバイス研究チーム
チームリーダー 田中 陽(たなか よう)
研究員 太田 亘俊(おおた のぶとし)
客員研究員 ヤシャイラ・ヤリクン(Yaxiaer Yalikun)
北海道大学 電子科学研究所 生体分子デバイス研究分野
助教 与那嶺 雄介(よなみね ゆうすけ)
東京大学大学院 工学系研究科
准教授 小関 泰之(おぜき やすゆき)
大学院生(研究当時) 浅井 卓也(あさい たくや)
九州大学 工学研究院 化学工学部門
准教授 星野 友(ほしの ゆう)
科学技術振興機構(JST)
プロジェクトマネージャー補佐(研究当時) 伊藤 卓朗(いとう たくろう)
※研究支援
本研究は、内閣府革新的研究開発推進プログラム(ImPACT)「セレンディピティの計画的創出による新価値創造(合田圭介プログラム・マネージャー)」による支援を受けて行われました。
背景
同種の細胞であっても、細胞ごとに個性が異なります。そのため、医薬品やバイオ燃料などの研究開発においては、例えば「油脂産生量が多い」などの特徴的な代謝を行う細胞が、目的に応じて選別されます。これまでに、一細胞ごとの測定を可能とするさまざまな測定法が開発されましたが、ラマン分光法のような非侵襲的に細胞を測定できる手法は、時間経過による一細胞内の代謝物変化を追跡する上で重要です。
一方、泳ぐ能力を持つ細胞は短時間のうちに素早く移動するため、代謝物変化など複数回の測定を要する場合は、測定中に細胞を見失わないようにする必要があります。しかし、細胞追跡を簡便化するために、泳ぐ細胞を狭い空間に閉じ込めると、新鮮な細胞培養液の供給が妨げられ、代謝に異変が生じます。そのため従来、泳ぐ細胞の一細胞測定を数時間にわたって行うことは困難でした。
そこで田中チームリーダーらは、薄板ガラスを組み込んだマイクロ流体チップを用いることで、多数の泳ぐ細胞の単離と培養を両立し、一細胞代謝の経時観察をラマン分光法に基づいて行う研究を進めてきました。今回の研究では、速く泳ぐ能力を持つユーグレナを対象としました。ユーグレナは、光合成により細胞内でパラミロンと呼ばれる、数百~数千個のブドウ糖が結合したバイオ燃料の原料を合成します。パラミロンを多く産生するユーグレナ細胞を選別するには、一細胞ごとのパラミロン代謝測定が必要となります。
研究手法と成果
共同研究グループは、泳ぐ細胞の単離と細胞培養液の灌流を両立できる「ダム構造」を持ったガラス製マイクロ流体チップを作製するために、まずガラス基板に対してフッ化水素によるエッチング[5]を行い、厚さ0.7mmのガラス基板表面に126本の細胞単離用の流路(図1上、青線が流路の輪郭とダムに相当)を形成しました。そして、その上に培養液交換用の隙間を1マイクロメートル(μm、1μmは1,000分の1mm)確保しつつ、厚さ0.2mmのガラス基板を貼り合わせました(図1下、ベージュ色の基板)。 このガラスチップにユーグレナを含む懸濁液を導入した後(図1上(1))、細胞培養液が流れる方向を調整することで(図1上(2))、微細流路へのユーグレナ単離と測定に供さない過剰なユーグレナの除去を行いました(図1上(3))。ユーグレナを単離する際の流量を毎分5マイクロリットル(μL、1μLは1000分の1mL)にすると、ユーグレナは細胞培養液の流れに沿って微細流路の終端(ダムの手前)まで運ばれました。この際、ユーグレナは1流路に二つ以上入らず、単離できる数はガラスチップ1枚当たり概ね25~35個でした。単離後は、毎分1μLの流量で細胞培養液を供給し、ユーグレナを培養しました(図2)。
次に、単離したユーグレナが正常な代謝活動を行っているか、共鳴ラマン分光法[6]で確認しました。重水[7]を含む培養液を与えてユーグレナを培養した結果、カロテノイド[8]成分に重水素が取り込まれたことから、ストレスを与えずに培養できることが分かりました(図3左上)。一方、固定処理[9]によって代謝活動を停止させたユーグレナには、重水素は取り込まれませんでした(図3右上)。また、カロテノイドの波形ピーク遷移を培養時間でプロットしたところ、ピーク遷移の度合いは一細胞ごとに異なることが示されました(図3下)。
続いて、単離したユーグレナに対しパラミロンを生産する条件で培養し、誘導ラマン散乱[10]顕微鏡で追跡しました。培養液中に、安定同位体の13CでラベルしたCO2源を添加して培養した結果、13Cを含むパラミロンの形成が観察され、元々存在していた12Cから成るパラミロンとは、明確に区別して検出できることが示されました(図4)。
今後の期待
本研究では、ガラスマイクロ流体チップ中にダム構造を持たせ、泳ぐ細胞の単離と培養を両立し、経時的な観察を可能としたことで、ユーグレナのパラミロン産生を一細胞レベルで確認することに成功しました。今回の測定方法は、ユーグレナ以外の泳ぐ細胞にも応用可能なため、これまで一細胞測定が困難であった動きの速い生物種の測定への応用を通じて、有用な生物由来化合物の発見や利用につながると期待できます。
原論文情報
- Nobutoshi Ota, Yusuke Yonamine, Takuya Asai, Yaxiaer Yalikun, Takuro Ito, Yasuyuki Ozeki, Yu Hoshino and Yo Tanaka, "Isolating single Euglena gracilis cells by glass microfluidic for Raman analysis of paramylon biogenesis", Analytical Chemistry, 10.1021/acs.analchem.9b01007
発表者
理化学研究所
生命機能科学研究センター
集積バイオデバイス研究チーム
チームリーダー 田中 陽(たなか よう)
研究員 太田 亘俊(おおた のぶとし)
北海道大学 電子科学研究所 生体分子デバイス研究分野
助教 与那嶺 雄介(よなみね ゆうすけ)
東京大学大学院 工学系研究科
准教授 小関 泰之(おぜき やすゆき)
九州大学 工学研究院 化学工学部門
准教授 星野 友(ほしの ゆう)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
北海道大学 総務企画部広報課広報・渉外担当
Tel: 011-706-2610 / Fax: 011-706-2092
E-mail:kouhou[at]jimu.hokudai.ac.jp
東京大学 大学院工学系研究科 広報室
Tel: 03-5841-6295 / Fax: 03-581-0529
E-mail:kouhou[at]pr.t.u-tokyo.ac.jp
九州大学 広報室
Tel: 092-802-2130 / Fax: 092-802-2139
E-mail:koho[at]jimu.kyushu-u.ac.jp
※上記の[at]は@に置き換えてください。
産業利用に関するお問い合わせ
補足説明
- 1.マイクロ流体チップ
半導体製造技術を用いて、微細な流路を樹脂やガラスなどの基盤に形成することで、液体もしくは液体中を流れる微粒子などの分離、濃縮、反応、解析といった操作をマイクロスケールで行うための小型集積装置。 - 2.ユーグレナ
別名、ミドリムシ。光合成を行う単細胞生物で、鞭毛を使って移動できる。ストレス条件下で、バイオ燃料にも利用可能な油脂成分を蓄積する。 - 3.ラマン分光法
分子にレーザー光などの狭帯域光を照射すると、分子振動の周波数だけ光の周波数が変化した散乱光が発生する。散乱光の振動数を分光測定することで、分子構造を推定できる。 - 4.パラミロン
グルコース(ブドウ糖)がβ-1,3結合した、ミドリムシにおける貯蔵多糖類。ミドリムシの細胞内で蓄積すると、粒状の構造体として見られる。また、嫌気条件下では、エネルギー獲得のためパラミロンをもとに油脂が生産される。 - 5.エッチング
フッ化水素を使用することで、ガラスを溶かして微細な溝などをガラスに彫る技術。 - 6.共鳴ラマン分光法
測定対象の分子に対して、電子吸収帯が一致した励起波長を用いると、ラマン散乱光が著しく増強する(共鳴ラマン散乱)。この現象を利用することで、測定対象を選択的に検出できる。 - 7.重水
通常の水は、質量数1の水素原子と質量数16の酸素原子で構成される水分子が大多数を占める。対して重水には、質量数2の水素原子(重水素)など、質量数の大きい同位体原子を含む水分子が多数含まれる。重水と通常の水は、密度などの物理的性質が異なるが、化学的性質は似ている。 - 8.カロテノイド
微生物、植物、動物に見られる天然色素の一群で、トマトやニンジンなどでは赤、橙、黄などの色を呈する。 - 9.固定処理
生物試料の生化学反応を停止し、試料の劣化や変化を防ぐ化学処理。 - 10.誘導ラマン散乱
2種類(励起光とストークス光)の光パルスを分子に照射し、分子振動に由来する光パルスの強度の変化(SRS効果)を検出する手法。通常のラマン散乱に比べて高い感度で高速に生体分子を識別し、数秒程度の短い時間内に分子イメージングを行うことができる。
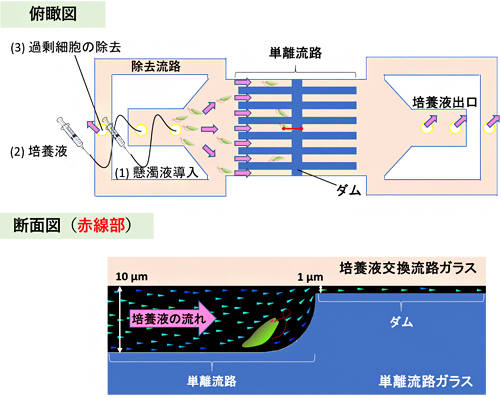
図1 ガラス製マイクロ流体チップのデザイン
- 上:ガラス製マイクロ流体チップのデザインを俯瞰した図。青色部分は、単離流路ガラス基板のうち、高さ0.7mmを維持している部分を示す。実際には126本の流路を彫り込んだ。(1)の位置でユーグレナを含む懸濁液をシリンジで導入し、培養液は(2)から注入する。右端が培養液の出口となり、測定に供さない過剰なユーグレナは、左端の(3)の位置で除去される。
- 下:上図中に赤線で示した部分の断面図。ユーグレナは深さ10μmの単離流路まで入ることができ、深さ1μmのダム部には培養液だけ入ることができる。

図2 ガラス製マイクロ流体チップの写真
- 左上:ガラス製マイクロ流体チップの俯瞰写真。
- 右:ダム構造に面した細胞単離用微細流路の拡大写真。
- 左下:微細流路に単離されたユーグレナの写真。
スケールバーは20μmを表す。
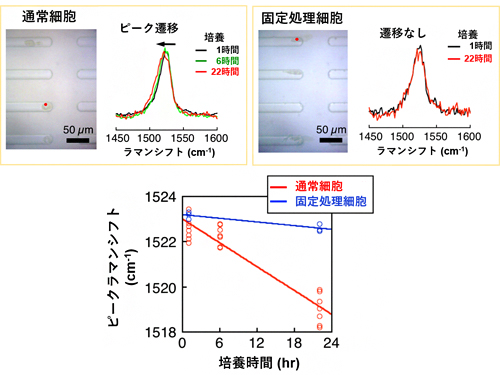
図3 共鳴ラマン分光法による単離したユーグレナの代謝活動の確認
- 左上: 単離したユーグレナと、その共鳴ラマンスペクトル。重水素を取り込みスペクトルが遷移したことから、ストレスを与えずに培養できることが分かった。
- 右上: 固定処理したユーグレナと、その共鳴ラマンスペクトル。代謝活動が停止しているため、重水素は取り込まれなかった。
- 下: ピーク遷移を培養時間でプロットしたグラフ。ピーク遷移の度合いは、細胞ごとに個体差が見られた。
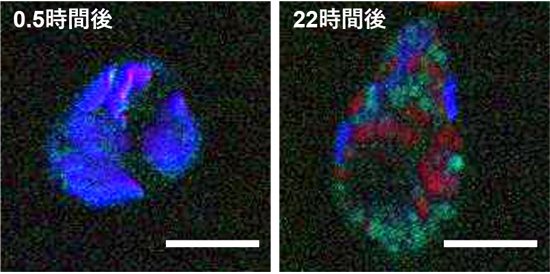
図4 誘導ラマン散乱顕微鏡によるユーグレナ細胞内のパラミロン観察
13Cを含む培養液で0.5時間(左図)および22時間(右図)培養した、ユーグレナ細胞の誘導ラマン散乱顕微鏡画像。赤が13Cを含むパラミロン、緑が12Cを含むパラミロン、青が葉緑体を示している。13Cを含むパラミロン顆粒が形成している様子が観察された。スケールバーは10μmを表す。
