理化学研究所(理研)生命医科学研究センター免疫転写制御研究チームのセオ・ウセオク研究員(研究当時)、谷内一郎チームリーダーらの国際共同研究チームは、細胞の遊走を制御する分泌タンパク質「ケモカイン[1]」の一種である「CCL5」の発現抑制機構を解明し、CCL5の発現量が免疫細胞の機能を調整し、がん免疫応答に大きく影響することを発見しました。
本研究成果は、CCL5の活性抑制による新たながんの免疫療法の開発に貢献すると期待できます。
CCL5は炎症部位へ免疫細胞が遊走する過程を制御することで、免疫反応を調整しています。近年、CCL5ががん細胞に対する免疫反応にも関与することが報告されていますが、CCL5の発現がどのように調節されているかは全く不明でした。
今回、国際共同研究チームは、RUNX転写因子[2]がCCL5遺伝子の発現を抑制することを見いだしました。その分子機構を詳しく調べて、CCL5遺伝子の発現を正に制御する二つのエンハンサー[3]を同定しました。また、ゲノム編集技術[4]により、この二つのエンハンサーを欠損するマウスを作製して解析した結果、エンハンサー欠損マウスでは、CCL5の発現量の低下により、ナチュラルキラー細胞(NK細胞)[5]の機能が亢進し、がん細胞の排除が促進されることを発見しました。これらの結果は、CCL5が免疫細胞の機能状態を制御することで、がん免疫応答を調整するという新たな知見を示しています。
本研究は、オンライン科学雑誌『Nature Communications』(3月26日付)に掲載されます。
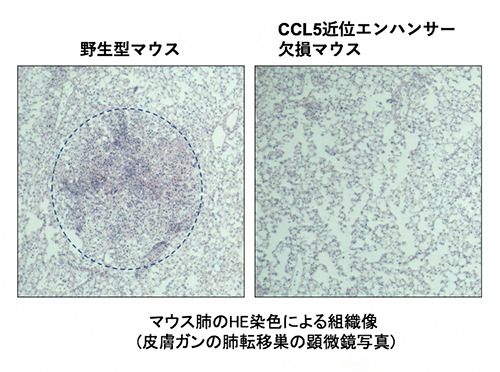
CCL5近位エンハンサー欠損マウスは野生型マウスと比較してがん転移巣の形成が抑制された
背景
「ケモカイン」は、細胞の遊走(細胞の走化性[Chemotaxis; ケモタキシス[6]])を促進させる分泌タンパク質であり、病原微生物の感染部位へ免疫細胞を呼び込み、免疫反応を促進させる作用を持ちます。ケモカインには多くの種類があり、「CCL5」はCCケモカインと呼ばれるケモカインファミリーの一つで、その受容体であるCCR5を発現している細胞に作用します。例えば、炎症が起こる際にCCL5は、活性化されたキラーT細胞[7]やナチュラルキラー細胞(NK細胞)などの免疫細胞から産生され、受容体CCR5を発現している他の免疫細胞を炎症局所へ誘導します。
最新の研究で、ケモカインはがん細胞に対する免疫応答にも重要な役割を果たしていることが明らかになり、がん免疫応答におけるCCL5の機能も注目されています。CCL5の発現量は、CCL5遺伝子の発現調節により制御されていますが、CCL5遺伝子の発現がどのように制御されているかについては分かっておらず、特に、CCL5遺伝子の発現を抑える機構があるかどうかは不明でした。
長年にわたり「RUNX」と呼ばれる転写因子の機能解明を行ってきた谷内一郎チームリーダーらは、これまでにRUNXが免疫細胞からのインターロイキン-4(IL-4)[8]の産生を抑制し、アレルギー応答を抑制していることを報告しています注1)。今回、国際共同研究チームは、RUNXにより産生が抑制される分泌タンパク質の探索を試みました。
- 注1)Yoshinori Naoe, et.al. Repression of interleukin-4 in T helper type 1 cells by Runx/Cbfβ binding to the Il4 silencer.J Exp Med. 2007 Aug 6; 204(8): 1749-1755.
研究手法と成果
RUNX転写因子は、標的となる遺伝子の周辺に存在する制御ゲノム領域[3]にある特異的なDNA配列を認識し、ゲノムDNAに結合することで、標的遺伝子の発現を誘導または抑制する機能を持っています。国際共同研究チームはまず、遺伝子改変によりRUNX転写因子の機能を欠損させたマウスを作製しました。このマウスからキラーT細胞を取り出して培養し、刺激した後に培養液中の分泌タンパク質の量を調べたところ、野生型のマウスのキラーT細胞に比べてRUNX欠損キラーT細胞は、CCケモカインファミリー、特にCCL5を過剰に発現していることを発見しました(図1)。この結果は、CCL5の発現がRUNXによって抑制されていることを示しています。
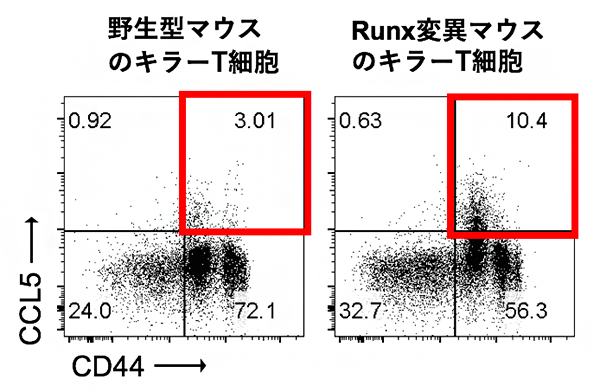
図1 キラーT細胞の培養後のCCL5の発現解析
野生型マウスのキラーT細胞に比べて、RUNX欠損キラーT細胞ではCCL5の発現が亢進している。これにより、CCL5の発現がRUNXによって抑制されていることが分かった。
次に、RUNX転写因子がどのようしてCCL5の発現を抑制するかを調べるため、抗RUNX抗体を用いたクロマチン免疫沈降法[9]を用いて、CCL5遺伝子の周りでRUNX転写因子が結合しているゲノム領域を探索しました。その結果、CCL5遺伝子の上流5kb(キロベース=1,000塩基対)の位置にRUNX結合領域が同定され、この領域を「CCL5近位エンハンサー」と名付けました。
CCL5近位エンハンサーの機能を調べるため、ゲノム編集技術を用いてCCL5近位エンハンサーを欠損するマウスを作製しました。CCL5は感染や炎症時に活性化された免疫細胞から分泌されますが、感染・炎症が生じていない定常状態でも、粘膜などの末梢組織に定住している組織定住型メモリーT細胞[10]から少量産生されます。この定常状態でのCCL5の発現は、末梢組織に滞在している免疫細胞の維持に重要な働きをすることが知られています。驚いたことに、CCL5近位エンハンサー欠損マウスでは、定常状態でのCCL5の発現が消失しましたが、活性化したキラーT細胞からのCCL5の発現に変化は見られませんでした。この結果は、活性化したキラーT細胞でのCCL5遺伝子の発現を誘導する役割を持つエンハンサーが、他にも存在する可能性を示しています。
そこで、enChIPと呼ばれるCRISPR/Cas9[4]技術を使用した最新の研究手法を活用し、CCL5遺伝子と相互作用するゲノム領域を網羅的に探索しました。その結果、CCL5遺伝子から1.35Mb(メガベース=100万塩基対)という極めて離れた位置に存在するもう一つのエンハンサー領域を同定することに成功し、その領域を「CCL5遠位エンハンサー」と名付けました。RUNX転写因子はCCL5遠位エンハンサーにも結合しており、CCL5遠位エンハンサーを欠損したマウスでは、活性化したキラーT細胞でCCL5遺伝子の発現が消失しました。
これらの結果から、CCL5遺伝子の発現は少なくとも近位エンハンサー、遠位エンハンサーという二つのエンハンサーによって制御され、RUNX転写因子は両方のエンハンサーに拮抗的に働き、CCL5遺伝子の発現を抑制していることが明らかになりました(図2)。この成果は、CCL5遺伝子のエンハンサーを初めて同定したものであり、さらにCCL5遺伝子の発現を能動的に抑制する仕組みがあることを初めて明らかにした画期的なものといえます。
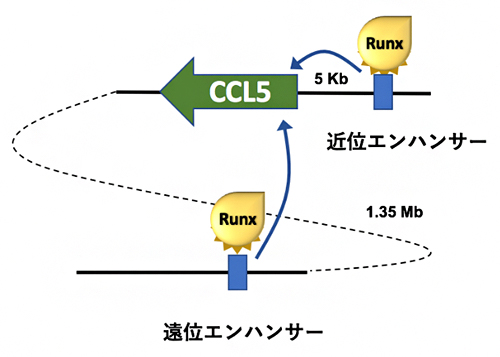
図2 CCL5遺伝子の発現を調節する二つのエンハンサー
CCL5遺伝子の5kb上流に近位エンハンサーが、1.35Mb離れた位置に遠位エンハンサーが存在し、ともにRUNX転写因子によりその機能が抑制されている。
近年の研究成果から、がん免疫応答において組織定住型の免疫細胞の重要性が明らかになってきています。また、CCL5は組織定住型の免疫細胞を維持するために重要であることが分かっています。そこで、今回作製したCCL5の二つのエンハンサーを欠損するマウスと皮膚がん細胞の肺への転移モデルマウスを用いて、がん免疫応答を調べました。その結果、CCL5近位エンハンサー欠損マウスでは、がん細胞の肺転移で見られるがん転移巣の形成が抑制されること、つまりがん細胞が効率良く排除されていることが分かりました(図3)。
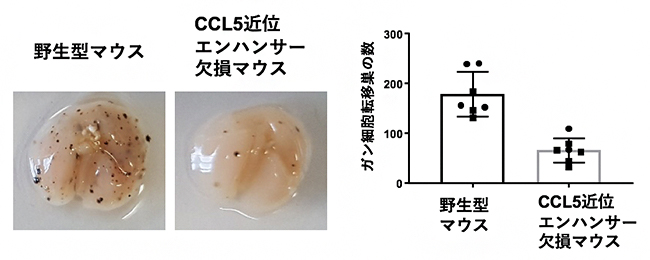
図3 皮膚がん細胞の肺への転移モデルマウスを用いたがん免疫の解析結果
右はマウスの肺の写真、黒い点は皮膚ガン細胞の肺転移巣を示している。CCL5近位エンハンサー欠損マウスでは、野生型マウスと比較してがん転移によるがん転移巣の形成が抑制されており、がん細胞を排除するがん免疫応答が増強されていることが分かる。
この皮膚がん細胞の肺転移に対するがん免疫応答では、NK細胞が重要な役割を果たすことが知られています。そこで、RNA-seq[11]という研究手法を使って、NK細胞の機能を解析しました。その結果、近位エンハンサー欠損による肺でのCCL5の発現量の低下により、肺に定住しているNK細胞は、がん細胞を攻撃する機能に関わる遺伝子を多く発現していることが分りました(図4)。この結果から、CCL5は細胞の遊走を誘導する古典的な機能以外に、定常時に組織に定住している免疫細胞の機能を調整し、がん細胞に対する免疫応答を調節するという新たな機能を持つことが明らかになりました。RUNX転写因子はCCL5のエンハンサーに拮抗的に作用し、CCL5が過剰に発現しないように見張ることで、がん免疫応答を増強していると考えられます。
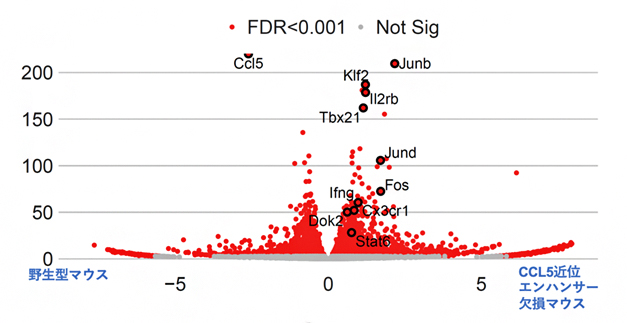
図4 マウス肺に定住するナチュラルキラー細胞のRNA-seq結果
各点は遺伝子を示す。赤点を黒で囲んだ点は、野生型とCCL5近位ンハンサー欠損細胞で、発現量が異なる遺伝子である。CCL5近位エンハンサーを欠損するマウスでは、がん細胞を攻撃する機能に関わる遺伝子がより高く発現している。横軸は各遺伝子の発現量の差を表し、縦軸は発現量の差の有意差の程度を示す。
今後の期待
今回の研究により、CCL5は免疫細胞の機能調節に重要な分子であることが明らかになりました。特に、CCL5の発現低下によりがん免疫応答が増強されることから、CCL5やその受容体であるCCR5を阻害することで、効果的ながん免疫療法が期待され、新たながん免疫療法の開発に応用される可能性が考えられます。
補足説明
- 1.ケモカイン
ケモカイン(走化性因子)は低分子の分泌タンパク質であり、標的細胞の細胞膜上のケモカイン受容体と結合することによって、細胞移動を促進する。 - 2.転写因子
遺伝子の発現は、ゲノムDNA上の制御領域の機能によって調節される。転写因子はその制御領域内の特異的なDNA配列に結合することで標的遺伝子の発現を調節するタンパク質である。 - 3.エンハンサー、制御ゲノム領域
遺伝子の発現を調節するゲノム領域は制御ゲノム領域と呼ばれ、遺伝子の上流や下流に位置する。遺伝子の発現を高める機能を持つ制御性ゲノム領域は、エンハンサーと称される。制御ゲノム領域にはほかに、遺伝子発現に必須なプロモーター、転写を抑制するサイレンサーなどがある。 - 4.ゲノム編集技術、CRISPR-Cas9
CRISPR-Cas9を用いたゲノム編集技術は、CRISPR-gRNA(DNAの標的部位に結合するgRNAとCas9(DNAを切る酵素)を組み合わせて、標的DNA配列を切断する方法である。切断されたDNA部位が修復される過程において生じる細胞内のDNA修復機構を利用することで、短時間で遺伝子改変マウスの作製が可能である。 - 5.ナチュラルキラー細胞(NK細胞)
リンパ球の一種であるが、T細胞とは異なり、抗原(病原体の目印)がなくても腫瘍やウイルス感染細胞を除去できる。細胞傷害作用を生来の機能として持っているため、自然免疫の主要因子として働く細胞である。 - 6.ケモタキシス
細胞がケモカインの濃度勾配に従い遊走する現象。免疫システムにおいては、血管内皮上の接着分子に接着し、血管内皮下の組織に移動することを指す。 - 7.キラーT細胞
T細胞はその機能によってさまざまな種類に分類されるリンパ球の一種である。特に、病原体に感染した細胞やがん細胞によって活性化され、その細胞を直接殺す機能を持つT細胞をキラーT細胞という。その表面にCD8タンパク質を発現していることから、CD8+T細胞とも呼ばれる。 - 8.インターロイキン-4(IL-4)
サイトカインの一種であり、2型免疫応答を惹起する作用があり、過剰に発現すると気管支喘息などのアレルギー疾患の発症に関与する。 - 9.クロマチン免疫沈降法
抗体を用いて、特定のタンパク質が結合しているゲノム上のDNA領域を同定する研究手法。目的のタンパク質が結合したゲノムDNAを、タンパク質特異的な抗体によって免疫沈降することで、タンパク質が結合したDNAを回収し、次世代シーケンサーを用いてDNA配列を解読することにより、特定のタンパク質が結合しているゲノム配列を同定できる。 - 10.組織定住型メモリーT細胞
一度罹患した感染症の再感染時の発症を予防する免疫の仕組みでは、病原体を記憶して長期に生存するメモリーT細胞が重要である。メモリーT細胞がどのようにして長期生存できるのか詳しいことについてはよく解っていない。近年の研究から非免疫組織に定住して存在するメモリーT細胞の存在が明らかになり、組織定住型メモリーT細胞と呼ばれている。 - 11.RNA-seq
大量の配列データが得られる次世代シーケンサーを利用して、細胞内に含まれるmRNAを網羅的に解析する方法である。
国際共同研究チーム
理化学研究所 生命医科学研究センター
免疫転写制御研究チーム
研究員(研究当時) セオ・ウセオク(Wooseok Seo)
チームリーダー 谷内 一郎(たにうち いちろう)
上級研究員(研究当時) 香城 諭(こうじょう さとし)
研修生(研究当時) Arinze Okeke
免疫細胞治療研究チーム
チームリーダー 藤井 眞一郎(ふじい しんいちろう)
上級研究員 清水 佳奈子(しみず かなこ)
カリフォルニア大学 サンフランシスコ校 Biomedical Sciences
教授 Terumi Kohwi-Shigematsu
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「Runx-mediated regulation of chemokine CCL5 for lung diseases(研究代表者:Wooseok Seo)」「Regulatory mechanisms controlling CCL5 chemokine to maintain tissue homeostasis(研究代表者:Wooseok Seo)」、同基盤研究(S)「T細胞分化を制御する転写因子ネットワークの解明(研究代表者:谷内一郎)」による支援を受けて行われました。
原論文情報
- Wooseok Seo, Kanako Shimizu , Dr. Satoshi Kojo , Arinze Okeke , Dr. Terumi Kohwi-Shigematsu , Dr. Shin-ichiro Fujii , Dr. Ichiro Taniuchi, "Runx-mediated regulation of CCL5 via antagonizing two enhancers influences immune cell function and anti-tumor immunity", Nature Communications, 10.1038/s41467-020-15375-w
発表者
理化学研究所
生命医科学研究センター 免疫転写制御研究チーム
研究員(研究当時) セオ・ウセオク(Wooseok Seo)
チームリーダー 谷内 一郎(たにうち いちろう)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
