理化学研究所(理研)生命機能科学研究センター細胞構造生物学研究チームの樋口佳恵技師、木川隆則チームリーダー、大陽日酸株式会社メディカル事業本部SI事業部SIイノベーションセンター開発課の矢吹孝担当課長(理研生命機能科学研究センター客員研究員)らの共同研究チームは、従来の無細胞タンパク質合成系[1]を改良し、「難発現タンパク質[2]」を低温で効率良く発現する技術基盤の開発に成功しました。
本研究成果は、難発現タンパク質に関する基礎研究はもとより、それらを活用した分子診断法や医薬品などの開発研究にも貢献すると期待できます。
細胞や細胞由来の因子を用いて特定のタンパク質を合成する手法は、生命科学の研究開発で広く用いられています。生きた細胞を用いるタンパク質発現法に対して、細胞由来の因子を用いる無細胞タンパク質合成系は、試験管内で簡便にタンパク質を合成できる点で優れています。一方、無細胞タンパク質合成系はタンパク質の凝集・変性を防ぐための低温反応条件では発現量が低く、これらの条件を要する難発現タンパク質への応用が課題でした。
今回、共同研究チームは、メッセンジャーRNA(mRNA)の構造をほぐす作用を持つ低温ショックタンパク質(CSP)[3]に着目し、CSPが目的タンパク質の低温(特に16~23℃)での発現量を著しく増加させることを見いだしました。この発見により、無細胞タンパク質合成系にCSPを添加することで、難発現タンパク質を効率良く発現する方法を開発しました。
本研究は、科学雑誌『Biotechnology and Bioengineering』のオンライン版(3月12日付)に掲載されました。また、理研および大陽日酸株式会社は「タンパク質の製造方法及び無細胞タンパク質合成系キット」として特許を出願中です。
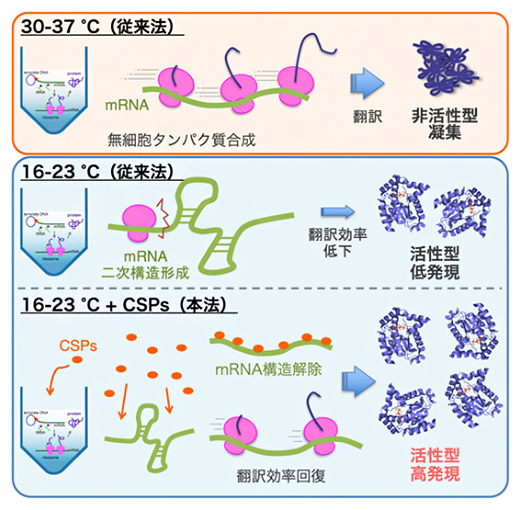
無細胞タンパク質合成における温度の影響と低温ショックタンパク質(CSP)の効果
背景
タンパク質を研究するためには、実験材料としてのタンパク質を得なければなりません。かつては、生体組織や細胞から天然のタンパク質を抽出・精製するのがほぼ唯一の手法でした。現在では、組換えDNA技術[4]による生きた細胞での発現系、あるいは細胞由来の因子を用いた無細胞タンパク質合成系が、生命科学分野の研究開発に欠かせない手法となっています。しかし、医薬品開発で研究対象とされる真核生物由来のタンパク質には凝集・変性しやすいために発現しにくいものが多く、これら「難発現タンパク質」はこれまでその機能解析もままなりませんでした。難発現タンパク質に対しては、低温で発現させることが有効です。
生きた大腸菌を用いるタンパク質発現系では、低温移行時に発現誘導される低温ショックタンパク質(CSP)遺伝子群の一つであるcspA遺伝子のプロモーター[5]と5'非翻訳領域[6]を利用したタンパク質発現系が用いられます。これらの系は、専用の発現コンストラクト[7]を必要とするなど、手間がかかりました。
一方、大腸菌抽出液を用いた無細胞タンパク質合成系は、一般的な発現実験で用いられるT7プロモーター[5]を、低温での発現にもそのまま用いることができます。このことから無細胞タンパク質合成系は簡便で自由度が高く、多くの試料の処理や自動化にも適します。そのため、基礎研究だけでなく、分子診断や医薬品標的の発見など応用研究にも利用されています。しかし、発現量が低いという問題がありました。
cspA遺伝子の産物であるCspAタンパク質は、RNAに結合してその二次構造の形成や解消を促進するRNAシャペロン[8]としての機能を持つと考えられています。そこで共同研究チームは、大腸菌由来の無細胞タンパク質合成系にCspAタンパク質を加えることで、低温でも有効な発現量が得られるのではないかと考えました。
研究手法と成果
共同研究チームはまず、通常30~37℃で反応させる無細胞タンパク質合成系と同じ構成の反応系に対して、CspAタンパク質添加の効果を調べました。発現させるタンパク質をGFPタンパク質[9]として、その発現量を蛍光強度から測定したところ、4~30℃の広い温度範囲において、GFPタンパク質の発現量は添加したCspA濃度に依存して増加することが分かりました(図1上)。その効果は、8~23℃でより著しく、特にCspAを十分量添加したときの20~23℃での発現量は、通常の(CspA 非添加)構成での30℃における発現量とほぼ同じでした(図1)。
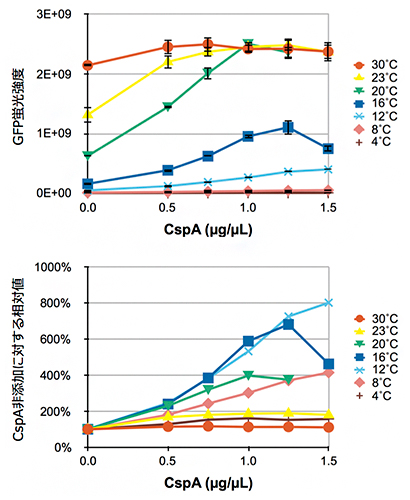
図1 各反応温度におけるCspAタンパク質添加濃度とGFPタンパク質発現量の関係
- 上:GFPタンパク質発現用の無細胞タンパク質合成反応液に、5種類の濃度のCspAタンパク質を添加し、さまざまな温度で一晩反応後、GFP蛍光強度を測定した。CspAタンパク質を添加しない場合と比べて、GFPタンパク質の発現量は添加したCspA濃度に依存して増加した。縦軸は相対蛍光単位を示す。
- 下:CspAタンパク質非添加に対するGFPタンパク質の発現量の変化。30℃ではCspAを添加してもほとんど変わらないが、23℃以下の反応でCspAを添加すると、非添加の1.5倍(23℃)から8倍(12℃)の発現量に達した。
次に、CspA以外のCSPが同様の効果を持つか調べるために、大腸菌から8種類、大腸菌以外の細菌から2種類と、シロイヌナズナおよびヒトのCSP類縁タンパク質を1種類ずつ(合計12種類)について、23℃でのGFPタンパク質発現量への影響を調べました。すると、細菌由来CSPの多くは、CspAと同様に低温でのGFPタンパク質の発現量を増加させましたが、一部は逆に発現量を低下させたり、シロイヌナズナおよびヒトのCSP類縁タンパク質は発現量にほとんど影響を与えないことが分かりました(図2)。
また、発現増加作用を持つCSPは互いに相補的な効果を示し、例えば、CspAを1μg/μL添加した場合と、他の5種類のCSPを0.2μg/μLずつ添加して合計1μg/μLとした場合の発現量はほぼ同じでした。CSPやその類縁タンパク質は、低温ショックドメイン(CSD)[3]と呼ばれる配列を持ちます。興味深いことに、立体構造上の共通性が高いと予測されるCSDを持つCSPは発現増加作用を持ち、共通性が低いCSDを持つものは効果がないか、発現量を低下させる作用を持っていました。
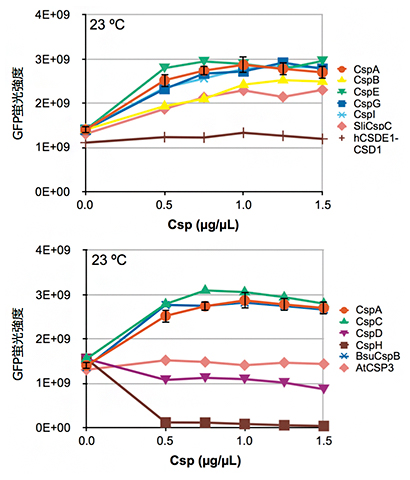
図2 23℃におけるCSP添加濃度とGFPタンパク質発現量
GFPタンパク質発現用の無細胞タンパク質合成反応液にCSPを添加し、23℃で一晩反応後、GFP蛍光強度を測定した。hCSDE1-CSD1(ヒト由来)やAtCSP3(シロイヌナズナ由来)を添加してもGFPタンパク質の発現量ほとんど変わらないが、CspA CspB, CspC, CspE, CspG, CspI(以上大腸菌由来), SliCspC, BsuCspB(以上非大腸菌細菌由来)を添加すると増加し、CspDやCspH(以上大腸菌由来)については減少したことが分かる。
さらに、凝集・変性しやすいタンパク質への効果を確認するため、難発現タンパク質であるヒト由来のアデニル酸キナーゼ1(hAK1)[10]の無細胞タンパク質合成系にCspAを添加しました。hAK1を通常の反応系で合成させると、30℃では凝集したタンパク質沈殿物の割合が多く、20℃では凝集が抑制されるものの可溶性タンパク質の合成量は多くありませんでした。しかしCspAを添加すると、20℃での可溶性タンパク質の合成量が増加し、酵素活性のあるhAK1の収量増加に寄与することが分かりました(図3)。
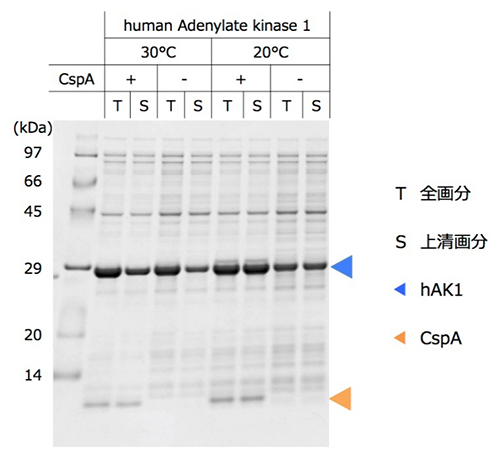
図3 ヒト由来難発現タンパク質の発現量と可溶性に対するCspA添加の効果
反応後の無細胞タンパク質合成液を上清画分と全画分に分け、それぞれをSDS-ポリアクリルアミドゲル電気泳動することでタンパク質を大きさごとに分離し、ヒト由来タンパク質のアデニル酸キナーゼ1(hAK1)のバンドを定量的に可視化した。hAK1は、CspA非添加での30℃合成反応では可溶性が低く沈殿したが、20℃合成反応では可溶性が高くなった。CspAを添加して20℃で合成反応させることで、高い可溶性を維持しながら発現量は増加し、タンパク質収量が増加した。
CspAタンパク質は、低温において形成されやすいメッセンジャーRNA(mRNA)の二次構造を解きほぐすRNAシャペロン活性を持つ注)といわれています。今回調べた大腸菌由来CSPとRNAの相互作用を調べたところ、程度に差はあるものの、いずれもmRNAとの結合能とRNAシャペロン活性を持っていることが分かりました。したがって、CSPによってmRNAの構造がほぐされ、翻訳が進むようになることにより、低温でも高い発現量を実現している可能性があります。
- 注1)Yan Zhang, David H. Burkhardt, Silvi Rouskin, Gene-Wei Li, Jonathan S. Weissman, and Carol A. Gross (2018), A Stress Response that Monitors and Regulates mRNA Structure Is Central to Cold Shock Adaptation. Mol. Cell, 70: 274-286
今後の期待
今回開発した技術は、より多くのタンパク質を解析できるため、タンパク質の機能や作用機構の解明につながり、基礎研究の加速はもとより、応用研究にも役立つと期待できます。また、合成可能なタンパク質の種類が多い、安定して使いやすい商品価値の高いタンパク質合成キット開発につながると考えられます。
さらに、本技術はタンパク質合成をより身近にする可能性を秘めています。室温やそれ以下の温度でのオンデマンドなタンパク質合成反応が可能となることから、生化学向け研究機材の整わない環境、例えば学校教育、屋外フィールド、砂漠、密林、山奥といった未開地など、従来とは異なる分野・現場においてタンパク質合成の新しい用途が開けることも期待できます。
補足説明
- 1.無細胞タンパク質合成系
大腸菌などの生きた細胞を使用せず、代わりに大腸菌などの各種細胞内に存在する酵素や基質などを利用してタンパク質を合成する方法。転写(DNAからmRNA合成する段階)と翻訳(mRNAからタンパク質を合成する段階)を同時進行する方法と、翻訳のみを行う方法がある。 - 2.難発現タンパク質
細胞が自ら合成するタンパク質は、発現量や立体構造が適切に制御され、正しく機能するようになっている。一方、ヒトやマウスのタンパク質を大腸菌で発現させるなど、異種タンパク質を細胞系や無細胞系で発現させた場合は、本来は可溶性であるタンパク質が凝縮したり、正しい立体構造をとれず機能しないタンパク質がしばしば出現したりしてしまう。このようなタンパク質は生産が困難であることから、難発現タンパク質と呼ぶ。 - 3.低温ショックタンパク質(CSP)、低温ショックドメイン(CSD)
大腸菌が低温環境に適応するときに最も著しく発現される遺伝子cspAが作るタンパク質CspAとその類縁体を低温ショックタンパク質と呼ぶ。より広く、CSPと相同な配列領域を低温ショックドメインと呼び、ヒトを含む高等生物までよく保存されている。CSPはcold shock protein、CSDはcold shock domainの略。 - 4.組換えDNA技術
目的とする遺伝子を細胞に導入し、発現させる技術。 - 5.プロモーター、T7プロモーター
プロモーターは、転写の開始に関与する遺伝子の上流領域。T7プロモーターは、バクテリオファージT7由来のプロモーターで、生きた大腸菌を用いる発現系に広く使用されている。 - 6.5'非翻訳領域
mRNAの翻訳領域の上流にあり、タンパク質には翻訳されない領域。タンパク質発現を調節する部位を含む。翻訳領域の下流にある領域は、3'非翻訳領域と呼ぶ。 - 7.発現コンストラクト
目的タンパク質のアミノ酸配列をコードする遺伝子のほか、さまざまな遺伝子やプロモーターを、遺伝子工学的手法を使って組み合わせたDNA鎖。大腸菌を使って増やすことができるプラスミド(環状DNA)や、PCRによって増幅させた直鎖状DNAがある。 - 8.シャペロン
生体分子が正しい折り畳みをして機能を獲得するのを助けるタンパク質の総称。RNAシャペロンは、RNAの二次構造の形成や解消を促進する。 - 9.GFPタンパク質
オワンクラゲが持つ緑色蛍光タンパク質で、1960年代に下村脩により発見・分離精製された。GFPはgreen fluorescent proteinの略。 - 10.アデニル酸キナーゼ1(hAK1)
生体内でAMP(アデノシン一リン酸)をリン酸化してADP(アデノシン二リン酸)を生成する酵素。hAK1はHomo sapiens adenylate kinase isoenzyme 1の略。
共同研究チーム
理化学研究所 生命機能科学研究センター 細胞構造生物学研究チーム
技師 樋口 佳恵(ひぐち かえ)
テクニカルスタッフ 伊東 優拡(いとう まさひろ)
チームリーダー 木川 隆則(きがわ たかのり)
大陽日酸株式会社 メディカル事業本部 SI事業部 SIイノベーションセンター 開発課
担当課長 矢吹 孝(やぶき たかし)
(理研 生命機能科学研究センター 細胞構造生物学研究チーム 客員研究員)
原論文情報
- Kae Higuchi, Takashi Yabuki, Masahiro Ito, and Takanori Kigawa, "Cold shock proteins improve E. coli cell-free synthesis in terms of soluble yields of aggregation-prone proteins", Biotechnology and Bioengineering, 10.1002/bit.27326
発表者
理化学研究所
生命機能科学研究センター 細胞構造生物学研究チーム
技師 樋口 佳恵(ひぐち かえ)
チームリーダー 木川 隆則(きがわ たかのり)
大陽日酸株式会社 メディカル事業本部 SI事業部 SIイノベーションセンター 開発課
担当課長 矢吹 孝(やぶき たかし)
 木川 隆則
木川 隆則
 矢吹 孝
矢吹 孝
お問い合わせ先
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
Tel: 078-306-3095 / Fax: 078-306-3090
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
大陽日酸株式会社 管理本部 広報・IR部
Tel: 03-5788-8015 / Fax: 03-6866-0203
Email:kamataa.qda [at] tn-sanso.co.jp ※[at]は@に置き換えてください。
