理化学研究所(理研)バイオリソース研究センター遺伝工学基盤技術室の井上貴美子専任研究員、小倉淳郎室長(開拓研究本部小倉発生遺伝工学研究室主任研究員)らの共同研究チームは、体細胞クローンマウス[1]における胎盤形態異常が「マイクロRNA(miRNA)[2]」の発現変化によって引き起こされることを明らかにしました。
本研究成果は、タンパク質をコードしないmiRNAと呼ばれる小さなRNAが妊娠期間の胎盤形成に大きな影響を持つことを示しており、妊娠中の胎児と胎盤の成長を正常化する医療技術の改善や、妊娠中の胎盤異常を示すマーカー遺伝子などの開発に貢献すると期待できます。
体細胞クローン技術は、除核した卵子に体細胞の核を移植することで個体を再生する生殖工学技術です。この技術により作出されたマウスは一見正常に見えますが、出生前、母体内で胎盤が大型化するなどの異常が必ず生じ、胎児の成長を妨げていると考えられてきました。しかし、1990年代後半に体細胞クローン動物が誕生して以来、胎盤異常が起こる原因は謎でした。今回、共同研究チームは、体細胞クローンマウスの胎盤の異常が、本来は父親ゲノムのみから発現しているmiRNAが、「ゲノム刷り込み[3]」の喪失により両親のゲノムから過剰に発現することによって引き起こされていることを明らかにしました。
本研究は、オンライン科学雑誌『Nature Communications』(5月1日付)に掲載されます。
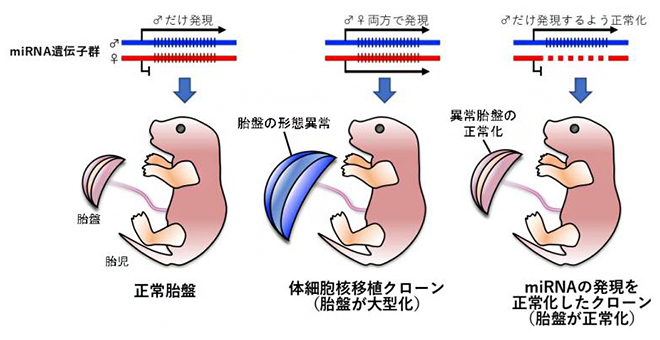
体細胞核移植クローンの胎盤異常は、miRNAの発現を正常化することで改善する
背景
胎盤は妊娠中の哺乳動物特有の器官であり、母体と胎児を結ぶことで栄養や酸素を胎児に供給する重要な役割を持っています。胎盤の異常は胎児の体重低下などを引き起こし、将来的な疾患につながる恐れがあります。
体細胞クローン技術(SCNT)は、除核した卵子に体細胞の核を導入し、得られた胚を母体子宮内に移植することで個体を作出できる生殖工学技術であり、1990年代後半に初めて哺乳動物での成功が報告されました注1)。SCNTは、無数に得られる体細胞から個体を再生できるため、発表当初から大きな期待が寄せられましたが、出生率が非常に低いため(通常、移植胚数に対し5%以下)、実用化への大きな壁となっていました。
しかし、20年以上にわたる研究者の絶え間ない努力により、出生率は20%程度まで大きく上昇し、胎児側の異常は少しずつ明らかとなってきました。出生まで正常に発生したクローン動物の多くはその後、正常に成長し繁殖能力も持っています。その一方で、出生前、母体内の胎盤には形態的な異常と大型化(過形成)が必ず見られ、胎児の成長を妨げている可能性が指摘されていました。この問題は20年来一向に改善されず、その原因は謎に包まれていました。
正常胎盤では、「ゲノム刷り込み[3]」により、父親由来のゲノムからのみ発現している遺伝子が複数存在します。これらは「胎盤特異的刷り込み遺伝子[3]」と呼ばれ、SCNT胎盤においては、胎盤特異的な刷り込みが失われるために、母親・父親由来の両ゲノムから発現することがこれまでの研究で明らかになっています。共同研究チームは、これらのゲノム刷り込み遺伝子に着目して研究を行いました。
- 注1)Wilmut, I., Schnieke, A., McWhir, J. & Kind, A. Viable offspring derived from fetal and adult mammalian cells. Nature 385, (1997).
研究手法と成果
共同研究チームはまず、胎盤特異的刷り込み遺伝子のうち、既にSCNT胎盤で発現上昇が報告されている三つの遺伝子(Sfmbt2、Gab1、Slc38a4)について、母親ゲノムの遺伝子をノックアウトした遺伝子欠損マウスの細胞を利用して、正常な父親由来の遺伝子発現を回復したSCNT個体を作出しました。しかし予想に反して、SCNT胎盤の形態は全く改善しませんでした。このことから、SCNT個体における胎盤形成の異常は、胎盤特異的刷り込み遺伝子の発現異常によるものではないことが示されました。
そこで、タンパク質をコードしない短いRNAであるマイクロRNA(miRNA)について、SCNT胎盤を用いて大規模発現解析を行いました。miRNAは、相補的な配列を持つ標的遺伝子と結合することで、標的遺伝子の発現を抑制することが知られています。
その結果、SCNT胎盤ではSfmbt2遺伝子内のmiRNAクラスターであるSfmbt2 miRNAクラスターの遺伝子発現が促進され、同じく大規模な刷り込み遺伝子ドメインであるDlk1-Dio3領域に存在するMirg miRNAクラスターの遺伝子発現が抑制されていることが明らかとなりました。
このうち、Mirg miRNAクラスターは、誕生後の胎児の代謝や社会性行動に影響することが明らかにされており、胎盤機能には関与しないと予想されることから、Sfmbt2 miRNAクラスターに焦点を当てて研究を行うことにしました。Sfmbt2 miRNAクラスターには、72個のmiRNA遺伝子が存在すると予測されています。ゲノム編集技術[4]により、母親ゲノムのSfmbt2 miRNAクラスターのみを欠損させたノックアウトマウス(miRNA KO)を用いてSCNT個体を作出したところ、胎盤重量が有意に低い産仔が得られました。胎盤組織の細胞構成は大幅に改善しており、遺伝子発現も正常胎盤に近づいていることが明らかになりました(図1)。さらに、SCNT個体の出生率も2倍程度まで上昇したことから、野生型のSCNTでは胎盤異常が出生率低下の一因となっていることも明らかになりました。
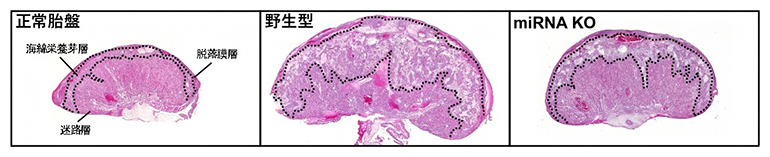
図1 miRNA ノックアウト(KO)による体細胞クローン技術(SCNT)胎盤形態の改善
正常胎盤(左)に比べて、野生型のSCNT(中央)は胎盤の大型化、特に海綿栄養芽層の増大が著しい。miRNA KOの体細胞をSCNTに利用することによって(右)、miRNAの発現が正常化し、胎盤形態が改善された。
miRNAの標的遺伝子の候補となる15種類を選定し、miRNA KOのSCNT胎盤における遺伝子発現を解析したところ、これらの標的遺伝子の発現が正常化していることが明らかになりました。さらに、これらの標的遺伝子をTriple target CRISPR法[5]によりノックアウトして胎盤形態を観察したところ、9遺伝子中、7遺伝子でその形態に異常が見られました。したがって、Sfmbt2 miRNAクラスターの遺伝子群は、これらの遺伝子の発現を制御することで、正常な胎盤形成を支えていると考えられます。
今後の期待
本研究により、タンパク質をコードしない小さなRNAであるmiRNAの正確な遺伝子発現制御が、胎盤形成で大きな役割を果たすことが明らかになりました。ヒトを含む霊長類でも胎盤で発現しているmiRNAクラスターの存在が報告されており、同じように重要な役割を持っていると予想されます。本成果は、ヒトの妊娠中の胎盤異常の原因解明やマーカー遺伝子の開発などにつながると期待できます。
また、20年以上にわたり未解明だった体細胞核移植クローンの胎盤形態異常の原因が初めて明らかになりました。本成果は今後、他動物種における胎盤異常の原因究明や、より質の高いクローン個体の作出に役立つと期待できます。
補足説明
- 1.体細胞クローンマウス
体細胞クローン技術(Somatic cell nuclear transfer; SCNT)とは、個体の体細胞核を除核卵子に移植し、得られた胚を母体へ子宮移植することによって個体を再生する技術のこと。本技術により誕生したマウスを体細胞クローンマウスと呼ぶ。 - 2.マイクロRNA(miRNA)
細胞内に存在する長さ21~23塩基程度の1本鎖RNA。数百~数千の塩基の一次転写産物から段階的に切り出されて作られる。タンパク質へは翻訳されず、標的となるmRNAの分解、翻訳抑制を通して、遺伝子機能の抑制に働く。 - 3.ゲノム刷り込み、刷り込み遺伝子
ゲノム刷り込みは、母親・父親由来の対立遺伝子発現に違いをもたらす発現制御システム。雌雄ゲノム上に異なる修飾が入ることで、発現する対立遺伝子が決定されている。このシステムにより制御されている遺伝子を(ゲノム)刷り込み遺伝子と呼ぶ。 - 4.ゲノム編集技術
特定の塩基配列上でDNAを切断する酵素(ヌクレアーゼ)を用いて、ゲノム上の目的の配列に変異を生じさせる技術の総称。 - 5.Triple target CRISPR法
小さなRNAをガイドとして利用することで、ゲノム中の特定のDNA配列に二本鎖切断を引き起こすCRISPR技術の応用版。一つの遺伝子の配列の中に3カ所ガイドRNAを同時に用意し、それらを一緒に受精卵に注入することで、生まれた個体はほぼ100%の確率で父親・母親の遺伝子座両方をノックアウトできる。
共同研究チーム
理化学研究所 バイオリソース研究センター 遺伝工学基盤技術室
専任研究員 井上 貴美子(いのうえ きみこ)
専任技師 越後貫 成美(おごぬき なるみ)
特別研究員(研究当時) 上村 悟氏(かみむら さとし)
訪問研究員(研究当時) 井上 弘貴(いのうえ ひろき)
専任研究員 的場 章悟(まとば しょうご)
テクニカルスタッフⅡ 廣瀬 美智子(ひろせ みちこ)
特別研究員(研究当時) 三浦 健人(みうら けんと)
訪問研究員 羽田 政司(はだ まさし)
テクニカルスタッフⅡ 長谷川 歩未(はせがわ あゆみ)
研修生 渡邉 奈穂美(わたなべ なおみ)
研究パートタイマーⅡ 百々 由希子(どど ゆきこ)
専任技師 持田 慶司(もちだ けいじ)
室長 小倉 淳郎(おぐら あつお)
(開拓研究本部 小倉発生遺伝工学研究室 主任研究員)
京都大学大学院 医学研究科
特定准教授 本多 新(ほんだ あらた)
研究支援
本研究は、内藤記念科学振興財団助成金「刷り込み遺伝子近傍に存在するマイクロRNAと妊娠期胎盤過形成との関連性の解明(研究代表者:井上貴美子)」、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「大規模な刷り込み型マイクロRNAクラスターの胎盤形成における役割の解明(研究代表者:井上貴美子)」、同新学術領域研究(研究領域提案型)「核移植技術を用いた生殖サイクルのエピジェネティクス変化の解析(研究代表者:小倉淳郎)」、「マウス核移植技術の開発による正常クローン胚・胎盤の構築(研究代表者:小倉淳郎)」による支援を受けて行われました。
原論文情報
- Kimiko Inoue, Narumi Ogonuki, Satoshi Kamimura, Hiroki Inoue, Shogo Matoba, Michiko Hirose, Arata Honda, Kento Miura, Masashi Hada, Ayumi Hasegawa, Naomi Watanabe, Yukiko Dodo, Keiji Mochida, Atsuo Ogura, "Loss of H3K27me3 imprinting in the Sfmbt2 miRNA cluster causes enlargement of cloned mouse placentas", Nature Communications, 10.1038/s41467-020-16044-8
発表者
理化学研究所
バイオリソース研究センター 遺伝工学基盤技術室
専任研究員 井上 貴美子(いのうえ きみこ)
室長 小倉 淳郎(おぐら あつお)
(開拓研究本部 小倉発生遺伝工学研究室 主任研究員)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
