理化学研究所(理研)脳神経科学研究センターシステム分子行動学研究チームの吉原良浩チームリーダー、成清公弥研究員(研究当時)、水口留美子研究員(研究当時)、安島綾子研究員らの研究チームは、神経回路遺伝学的手法[1]を用いて、機能未知であった脳領域「前障(ぜんしょう)」が、大脳皮質の「徐波[2]」活動を制御することを発見しました。
本研究成果は、意識レベルや睡眠の調節を担う神経メカニズムの理解につながると期待できます。
前障は、哺乳類の大脳皮質の深部に存在する薄いシート状の脳領域です。この前障はほとんど全ての大脳皮質領野と双方向に神経連絡していることから、その役割として多感覚の統合、注意の割り当て、意識の調節などの仮説が提唱されてきましたが、その実体は未解明のままでした。
今回、研究チームは、前障の神経細胞を選択的に可視化あるいは活動操作できるトランスジェニックマウス[3]を作製し、神経解剖学・電気生理学[4]・光遺伝学[5]の技術を駆使して、前障の機能の解明に取り組みました。その結果、前障が睡眠中や休息中の大脳皮質で見られる徐波活動の制御に関わっていることを初めて明らかにしました。
本研究は、科学雑誌『Nature Neuroscience』オンライン版(5月11日付:日本時間5月12日)に掲載されます。
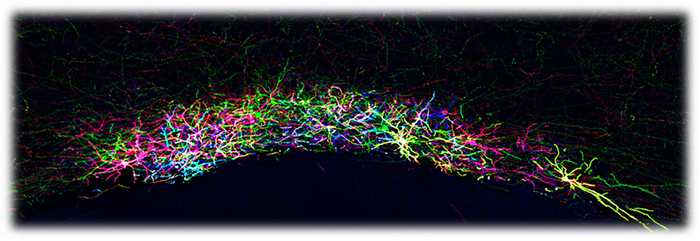
マウスの前障神経細胞のBrainbow染色像
背景
私たちヒトを含む全ての哺乳類の大脳皮質の深部には、「前障(ぜんしょう、英語名:Claustrum)」と呼ばれる薄いシート状の脳領域があります(図1)。前障はほとんど全ての大脳皮質領野と神経連絡しており、双方向性に情報をやり取りしています。このことから、大脳皮質全体が関わる高次の情報処理過程を前障がつかさどるのではないかと考えられ、これまでその機能について、多感覚情報の統合、注意の割り当て、脳の同期的活動の制御など、多くの仮説が提唱されてきました。
また、DNA二重らせん構造の発見者であるフランシス・クリックは、晩年、脳科学について思考を巡らせ、彼の生涯最期の論文で「前障が意識の神経基盤であり、脳というオーケストラにおける指揮者の役割を果たす」という大胆な仮説を提唱しました。しかし、今日に至るまで前障の機能の実体は謎に包まれたままでした。
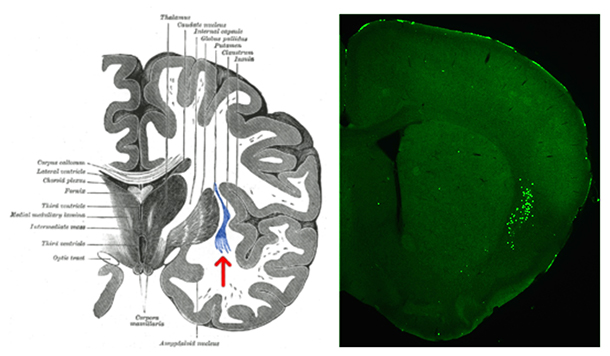
図1 ヒトおよびマウスの前障
- (左)ヒト脳の前額断面の模式図。大脳皮質の内側の青いシート状の構造(赤矢印)が前障(Wikipediaより改変引用)。
- (右)Cla-Creマウス脳の前額断面におけるCreタンパク質の発現。前障の神経細胞特異的にDNA組換え酵素Creを発現するトランスジェニックマウス系統(Cla-Creマウス)の樹立に成功した。緑色の点がCreタンパク質を発現する前障神経細胞。
研究手法と成果
前障神経細胞特異的Cre発現マウス(Cla-Creマウス)系統の樹立
マウスの前障はヒトの前障と同様に、前後方向・背腹方向に長く、薄いシート状の構造をしており、従来の古典的な方法では前障の神経細胞だけを選択的に操作して実験することが困難でした。そこで、遺伝学的手法を用いて、前障の興奮性神経細胞[6]の約35%にだけDNA組換え酵素Cre[7]を発現するトランスジェニックマウスを作製し、「Cla-Creマウス」と名付けました(図1右)。このマウスを用いることにより、Creが発現する神経細胞だけを選択的に可視化あるいは活動操作することが可能となりました。
前障神経細胞の神経連絡:ウイルスベクターを駆使した神経解剖学的解析
まず、前障神経細胞が脳のどの領域と連絡しているか、その軸索投射様式を調べるために、Cre依存的アデノ随伴ウイルスベクター[8]を用いて、前障神経細胞に赤色蛍光タンパク質[9]を発現させて可視化しました(図2赤色)。その結果、これまでの前障についての解剖学的研究報告と同様に、Cla-CreマウスにおけるCre発現前障神経細胞の軸索も、幅広い大脳皮質領域に投射していること(出力)を確認できました。なかでも、前頭皮質・島皮質・嗅内野など高次脳機能をつかさどる大脳皮質領野への投射が著しいことが分かりました。一方で、大脳皮質以外の脳領域への軸索投射は、扁桃体基底外側核を除いて全く見られませんでした。
次に、Cre発現前障神経細胞がどのような脳領域から神経投射を受けているかを、改変型狂犬病ウイルスベクターを用いたCre依存的逆行性トランスシナプス標識法[10]により可視化しました(図2緑色)。すると、前障に情報を入力する神経細胞(シナプス前神経細胞)が存在する脳領域の多くは、前障神経細胞の軸索が投射する出力領域と重複しており、前障が幅広い大脳皮質領域と「双方向性」に接続していることが確認できました。ただし、前障へ入力する神経細胞は、前障からの投射(出力)が存在しない皮質以外の脳領域からも見られ、視床の一部の神経核や、無名質のアセチルコリン作動性神経細胞、縫線核のセロトニン作動性神経細胞からの入力が確認できました。
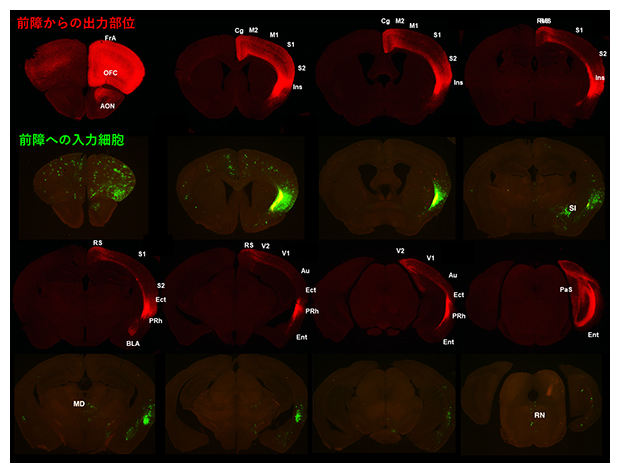
図2 前障からの出力部位(赤)と前障への入力細胞(緑)
Cla-Creマウスの脳の冠状切片。片側の前障神経細胞に赤色蛍光タンパク質を発現させて、軸索の投射領域を可視化したもの(赤:1、3段目)。片側の前障神経細胞のシナプス前神経細胞に緑色蛍光タンパク質を発現させて、前障への入力細胞を可視化したもの(緑:2、4段目)。
前障神経細胞は、大脳皮質の抑制性介在神経細胞[6]を選択的に発火させる:スライス光遺伝学/電気生理学的解析
前障神経細胞が、大脳皮質の神経細胞にどのような作用を及ぼしているのかを調べるために、光遺伝学と脳のスライス標本でのホールセルパッチクランプ記録法[11]を用いました(図3左)。まず、アデノ随伴ウイルスベクターを用いて、前障神経細胞に光刺激により神経興奮を誘発できるイオンチャネルのチャネルロドプシン2[12]を発現させました。次に、前障神経細胞からの入力が特に密である島皮質や前頭皮質を含む脳スライス標本を作製し、皮質の神経細胞の活動をホールセルパッチクランプ法により記録しながら、前障神経細胞の軸索を光で刺激しました。
大脳皮質の神経細胞は、大多数を占める興奮性神経細胞と、少数の抑制性介在神経細胞の大きく2種類から成ります。この2種類の神経細胞を電気生理学的に同定し、前障神経細胞を刺激したときの細胞の応答を見ました(図3右)。その結果、前障神経細胞の光遺伝学的刺激により、興奮性神経細胞ではほとんどでスパイク発火[13](活動電位)が見られませんでしたが、抑制性介在神経細胞では半数近くにおいてスパイク発火が観察されました。この結果から、前障神経細胞は、大脳皮質の抑制性介在神経細胞を選択的に活動させることが分かりました。
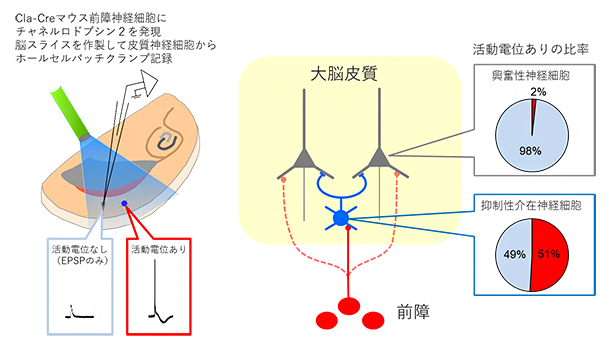
図3 前障神経細胞の刺激と大脳皮質の興奮性・抑制性介在神経細胞の活動
- (左)大脳皮質の興奮性神経細胞と抑制性介在神経細胞の活動を、ホールセルパッチクランプ記録法を用いて記録し、前障神経細胞の軸索を光刺激で活性化したときの応答を観察した。興奮性神経細胞ではEPSP(Excitatory Post-synaptic Potential:興奮性シナプス後電位)が誘起されたが、活動電位は観察されなかった。一方、抑制性介在神経細胞においては、EPSPに続いて活動電位が観察された。
- (右)前障と大脳皮質の神経回路の模式図。前障は、ほぼ全ての大脳皮質の神経細胞に投射している。前障神経細胞の光刺激によって、抑制性介在神経細胞の約半数で活動電位が発生したが(円グラフ赤色部分)、興奮性神経細胞からは活動電位はほとんど観察されなかった。
前障神経細胞の活動は脳の「徐波」活動と相関する:in vivo(生体内)電気生理学的解析
前障神経細胞がどのような生理的状況において活動しているのかを調べるために、活動中のマウス脳の神経活動を記録しました(図4)。脳スライスでの実験結果より、前障の活動は大脳皮質の活動と関係していると推測されたことから、大脳皮質の脳波[14]を記録しながら、前障神経細胞のスパイク発火を記録しました。
前障の機能に関わるこれまでの仮説の多くが、注意や意識など覚醒中の活動に関わるものであったため、当初は覚醒中の活動を予想していましたが、結果は予想に反して、マウスの覚醒度が高いときには前障神経細胞の活動は低く、逆にマウスが休息したり、眠ったりしているときに活動が高まっていました。脳波との関係を詳細に解析すると、前障神経細胞は脳波に徐波が現れる徐波睡眠[15]時に頻繁に活動することが分かりました。
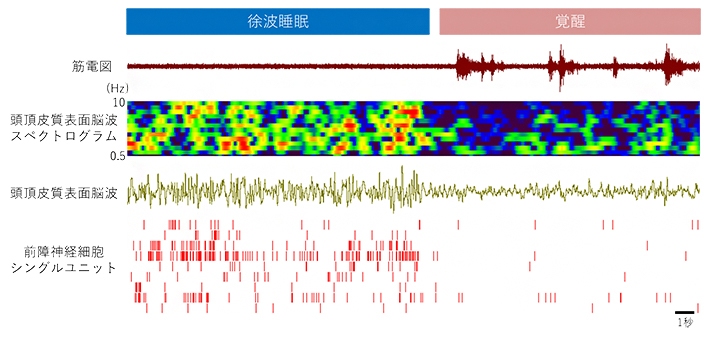
図4 前障神経細胞のスパイク発火と大脳皮質脳波
マウスが徐波睡眠から覚醒に移行するときの前障神経細胞の活動。筋電図はマウスの体動を示している。スペクトログラムは、脳波を周波数成分ごとのパワーで表したもの。シングルユニットは、それぞれ単一の前障神経細胞のスパイク発火を示す。この例のように、前障の多くの神経細胞は脳波に徐波が見られるときに活動が高い傾向にあった。
前障神経細胞の刺激は、大脳皮質神経細胞の活動を一斉に抑制する:光遺伝学/in vivo電気生理学的解析
前障神経細胞の活動と大脳皮質の徐波活動に因果関係があるのかを調べるために、今度は前頭皮質の神経細胞の活動と脳波を記録しながら、チャネルロドプシン2を発現させた前障神経細胞を光刺激により活性化させました(図5)。前障神経細胞をわずか5ミリ秒刺激したところ、その直後に前頭皮質の神経細胞の活動が一斉に止まり、その後100?150ミリ秒もの間静止状態が継続することが分かりました。またこのとき、脳波では大きな徐波を伴っていました。この結果から、前障神経細胞の活動が大脳皮質の徐波を引き起こすことが示されました。
また、前述の脳スライス実験から、前障神経細胞は皮質の抑制性介在神経細胞を選択的に活動させることが分かっています。このことから、前障神経細胞の活動が大脳皮質の抑制性介在神経細胞の活動を引き起こし、その結果大脳皮質の神経細胞の活動を一斉に抑制していると考えられました。
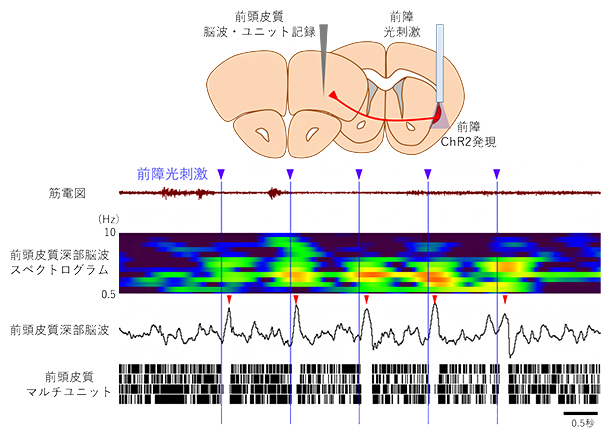
図5 前障神経細胞の刺激と大脳皮質神経細胞のスパイク発火の関係
前頭皮質から脳波とスパイク発火を記録しながら、前障神経細胞を光刺激したときの応答。マルチユニットは、前頭皮質神経細胞の活動(スパイク発火)を示しており、各行それぞれ異なる電極からの記録で、それぞれ複数の神経細胞のスパイク発火活動を含む。光刺激直後に、前頭皮質神経細胞の発火が一斉に停止し、脳波には徐波様の波(赤矢尻)が生じている。
前障神経細胞の遺伝学的除去は、大脳皮質の徐波活動を減弱させる:遺伝学・in vivo電気生理学的解析
最後に、自然に発生する大脳皮質の徐波に前障が必要かどうかを確かめるために、ウイルスベクターを用いてCre発現前障神経細胞選択的にジフテリア毒素[16]を発現させ、前障神経細胞を除去したマウスにおける大脳皮質の脳波を記録しました(図6)。その結果、前障神経細胞を除去したマウスでも、一日の覚醒・睡眠リズムは前障を除去していないマウスと同様でしたが、徐波睡眠中の脳波を見ると、前頭皮質の徐波が弱まっていることが分かりました。徐波の形を比べてみると、波のサイズが減少していることが分かりました。徐波のサイズは、一斉に同期して静止する神経細胞が多いほど大きくなることが知られているため、この結果は前障神経細胞の除去により、大脳皮質の神経細胞の同期した静止状態が生じにくくなったと考えられます。
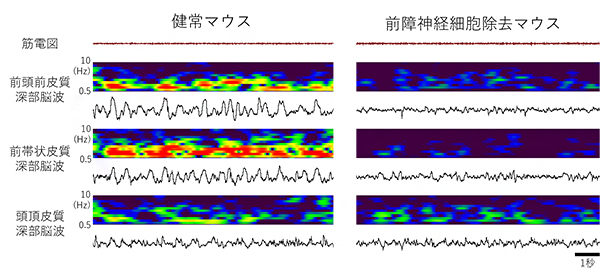
図6 健常マウスと前障神経細胞除去マウスの前頭皮質における徐波活動
健常マウスと前障神経細胞除去マウスの徐波睡眠中の脳波の例。脳波は前頭前皮質、前部帯状皮質、頭頂皮質から記録。前障神経細胞除去マウスでは、前頭皮質領域(上段と中段)で徐波睡眠中の徐波が小さくなっている。
以上の結果から、前障神経細胞は睡眠時に大脳皮質の抑制性介在神経細胞の活動を誘発することにより、大脳皮質の多数の神経細胞の同期した静止状態を生み出し、睡眠時の大脳皮質の徐波活動を制御していると考えらえます(図7)。
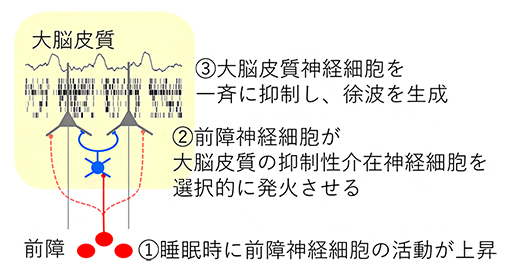
図7 前障による大脳皮質徐波の制御
前障神経細胞は睡眠時に大脳皮質の抑制性介在神経細胞の活動を誘発することにより、大脳皮質の多数の神経細胞の同期した静止状態を生み出し、睡眠時の大脳皮質の徐波活動を制御している。
今後の期待
本研究によって、前障が睡眠中や休息中の脳の活動である徐波の制御に関わることが明らかとなりました。本研究は、徐波活動の生成メカニズムに、これまで知られていなかった新しい神経基盤を示すとともに、謎の多い前障の機能解明に睡眠という新たな視点を与えるものです。また睡眠中の徐波活動には、その直前の覚醒中に学習した記憶を長期的に固定化[17]する機能があることが近年明らかになってきていることから、記憶形成においても前障が重要な役割をしていることが予想されます。
本研究の成果は、前障の機能、睡眠中の徐波生成、記憶の固定化、さらには意識の調節のメカニズムの解明といった多岐にわたるテーマへの展開が期待できます。
補足説明
- 1.遺伝学的手法
外来性の遺伝子を導入したり、内在性の遺伝子を取り除いたりといった遺伝子操作を伴う研究手法。 - 2.徐波
睡眠中に大脳皮質脳波に頻繁に見られるゆっくりとした大きな波で、主に0.5~4Hzの周波数成分で構成される。徐波は、大脳皮質の多くの神経細胞が一斉に静止状態と活動状態を繰り返すことで生じている。 - 3.トランスジェニックマウス
遺伝子改変マウスの一種。人為的操作により外来遺伝子を染色体に導入したマウス。 - 4.電気生理学
生体の機能をその電気的活動を利用して研究する手法。脳の神経細胞(ニューロン)は、電気信号を使って情報の伝達を行っているため、神経科学における主要な研究手法となっている。 - 5.光遺伝学
光によって活性が変化するタンパク質を用いて、細胞の活動を操作する手法。各種の光依存的なタンパク質を神経細胞に発現させ、光を当てることで、神経細胞を任意のタイミングで発火させたり、逆に活動を抑制させたりできる。遺伝学的手法により、光依存的なタンパク質を特定の細胞タイプに発現させることができ、また光照射により制御できることから、細胞タイプ特異的かつ時間精度の高い細胞活動の制御が可能。 - 6.興奮性神経細胞、抑制性介在神経細胞
興奮性神経細胞は、興奮性の神経伝達物質(グルタミン酸)を放出し、シナプスでつながる次の神経細胞を興奮させる機能を持つ神経細胞。大脳皮質の神経細胞の大多数を占める。抑制性介在神経細胞は、抑制性の神経伝達物質(GABA)を放出し、近傍の神経細胞にだけ投射して、局所的な神経回路を抑制性に制御する。多様な種類の抑制性介在神経細胞が知られており、パルブアルブミン陽性型、ソマトスタチン陽性型などが代表例。 - 7.DNA組換え酵素Cre
P1ファージに由来するDNA組換え酵素で、DNA上にloxPと呼ばれる配列をペアで入れておくと、その間のDNAを組み換えることができる。本研究では、この酵素を前障の細胞で発現するマウスを作製し、そのマウスにウイルスベクターでCre依存的に発現する遺伝子を導入することで、前障神経細胞選択的に目的の遺伝子産物を発現させている。 - 8.アデノ随伴ウイルスベクター
細胞に特定の遺伝子を導入するために用いる、アデノ随伴ウイルスを利用したベクター(運び屋)。目的の遺伝子を持たせたアデノ随伴ウイルスベクターを細胞に感染させることで、その遺伝子を発現させることができる。 - 9.蛍光タンパク質
クラゲやサンゴなどに由来する緑や赤色の蛍光を発するタンパク質。このタンパク質を特定の細胞に発現させて蛍光顕微鏡で観察すると、その細胞の形態を可視化できる。 - 10.逆行性トランスシナプス標識法
狂犬病ウイルスが神経細胞のシナプスを遡って逆行生に感染していくという特性を用いた、神経回路可視化法。特定の条件下でしか感染しないように改変された狂犬病ウイルスを用いて、目的の神経細胞とそれに入力する一つ前の神経細胞(シナプス前神経細胞)にだけ蛍光タンパク質を発現させて、神経回路を可視化することができる。 - 11.ホールセルパッチクランプ記録法
ガラス電極を細胞膜に密着させ、内部を陰圧にすることでガラス電極内部の細胞膜を破って穴を開け、電極内と細胞内がつながる状態を作り、細胞の電気活動を記録する方法。細胞の内部に電流を流したり、細胞外を刺激したときの細胞の電気応答を記録することができ、細胞の特性を調べることができる。 - 12.チャネルロドプシン2
藻の一種のクラミドモナス由来の青色光で開く陽イオンチャネル(膜貫通タンパク質)。神経細胞に発現させて光を当てることで、神経細胞を脱分極させて興奮させることができる。 - 13.スパイク発火
神経細胞が情報を伝えるために用いる1ミリ秒ほどのスパイク(棘)状の膜電位変化。活動電位、スパイク、インパルスなどとも呼ばれ、その発生を発火という。 - 14.脳波
脳から生じる電気的活動を、脳表面や脳深部、頭皮上においた電極で記録したもの。脳波は、神経細胞の集合的な活動を反映していると考えられる。 - 15.徐波睡眠
睡眠中の脳波は一定ではなく、睡眠は脳波パターンに応じていくつかの種類に区別される。徐波睡眠は、脳波に徐波が頻繁に見られるときの睡眠を指し、一般的な睡眠の大部分に相当する。 - 16.ジフテリア毒素
もともとはジフテリア菌が出す毒素で、この遺伝子の一部(Aサブユニット)を特定の細胞に導入して毒素を発現させると、その細胞だけを死滅させて除去できる。 - 17.記憶の固定化
記憶には、学習直後の数時間程度しか維持できない短期記憶と数日以上維持できる長期記憶がある。短期記憶は、記憶の固定化を経て、長期記憶になると考えられている。また、この記憶の固定化には睡眠時の徐波活動が重要であると考えられている。
研究チーム
理化学研究所 脳神経科学研究センター
システム分子行動学研究チーム
チームリーダー 吉原 良浩(よしはら よしひろ)
研究員(研究当時) 成清 公弥(なりきよ きみや)
研究員(研究当時) 水口 留美子(みずぐち るみこ)
研究員 安島 綾子(あじま あやこ)
テクニカルスタッフⅠ(研究当時) 塩﨑 桃子(しおざき ももこ)
客員主管研究員 森 憲作(もり けんさく)
学習・記憶神経回路研究チーム
チームリーダー ジョシュア・ジョハンセン(Joshua P. Johansen)
研究員(研究当時) 濱中 裕喜(はまなか ひろき)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域研究「多様性から明らかにする記憶ダイナミズムの共通原理(領域代表者:齊藤実)」および同新学術領域研究「脳情報動態を規定する多領野連関と並列処理(領域代表者:尾藤晴彦)」、上原記念生命科学財団特定研究助成金「脳?末梢連関による生体恒常性の維持とその破綻(委員長:成宮周)」による支援を受けて行われました。
原論文情報
- Kimiya Narikiyo, Rumiko Mizuguchi, Ayako Ajima, Momoko Shiozaki, Hiroki Hamanaka, Joshua P. Johansen, Kensaku Mori, Yoshihiro Yoshihara, "The claustrum coordinates cortical slow-wave activity", Nature Neuroscience, 10.1038/s41593-020-0625-7
発表者
理化学研究所
脳神経科学研究センター システム分子行動学研究チーム
チームリーダー 吉原 良浩(よしはら よしひろ)
研究員(研究当時) 成清 公弥(なりきよ きみや)
研究員(研究当時) 水口 留美子(みずぐち るみこ)
研究員 安島 綾子(あじま あやこ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
