理化学研究所(理研)脳神経科学研究センター意思決定回路動態研究チームの中條暖奈研究員、岡本仁チームリーダーらの国際共同研究グループは、ゼブラフィッシュ[1]の同種間での闘争行動を調べ、空腹状態にあるゼブラフィッシュが降参・敗北しにくくなる神経メカニズムを発見しました。
本研究成果は、勝負において「ハングリー精神」が動物の行動をどのように制御するのか、その手がかりをつかむ糸口になると期待できます。
動物は食料などを取り合って同種間で闘争し、勝者が優先的に食料を得ることができます。空腹状態にある動物は、食料を得るために闘い続けるモチベーションが上昇していると考えられますが、これまで空腹が動物の社会的闘争行動に与える影響については明らかになっていませんでした。
今回、国際共同研究グループは、ゼブラフィッシュを絶食させると闘争において容易には降参しなくなり、結果として負けにくくなることを発見しました。また、絶食させた魚では、勝者としての振る舞いに関連する「手綱核-脚間核神経経路[2]」の興奮が伝わりやすくなること、さらに、神経活動の変化を起こすメカニズムとして、脳内の神経ペプチドがグルタミン酸受容体の遺伝子発現の調節機構(スプライシング[3])に影響を与えることを見いだしました。
本研究は、オンライン科学雑誌『Cell Reports』(6月23日付:日本時間6月24日)に掲載されます。
背景
多くの動物は食料や縄張り、パートナーといった資源を巡って、同種間で闘争します。闘いの勝者は、敗者に比べて優先的にそれらの資源を得られることから、闘争の勝敗は動物の生存にとって重要です。そのため、生存に必要な資源が十分でない状態は闘争行動に影響を与えると予想されます。
例えば空腹状態にある動物は、生存のためのエネルギーが枯渇しつつある状態にあり、食料を得ることに対するモチベーションが上昇していると考えられます。これまで、絶食させた動物では攻撃行動が増えるなど、空腹がさまざまな行動変化を起こすことが報告されていますが、空腹が動物の闘争行動に与える影響については明らかになっていませんでした。
研究手法と成果
国際共同研究グループは、空腹が闘争に与える影響を調べるために、インド原産の小型魚類であるゼブラフィッシュを用いました。2匹の雄のゼブラフィッシュを同じ水槽に入れるとほとんどのペアが闘争行動を示し、互いに攻撃した後、一方が降参し、勝者と敗者が決定します。ゼブラフィッシュは、これら一連の闘争行動が明瞭で観察が容易であることから、動物が社会的闘争行動によって勝者と敗者に分かれる仕組みを調べるためのモデルとして用いられています(図1A)。
まず、6日間絶食させた魚と餌を与えた魚をペアにして闘わせたところ、絶食させた魚の勝率が高くなることを発見しました(図1B)。また、闘争が始まってから勝敗が決定するまでの時間(闘争継続時間)を調べた結果、絶食させた魚同士を闘わせた場合は、餌を与えた魚同士、また絶食させた魚と餌を与えた魚とを闘わせた場合に比べて、闘争継続時間が長くなることが分かりました(図1C)。この結果は、絶食させた魚同士を闘わせた場合では、どちらの魚も勝負を諦めず、相手に対して降参しにくくなることを示唆しています。
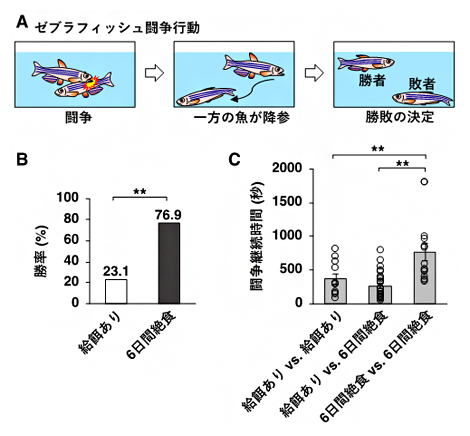
図1 絶食による闘争行動の変化
- (A)ゼブラフィッシュ闘争行動の概要。オスのゼブラフィッシュのペアを同じ水槽に入れると闘争を始め、お互いの体に噛みつき攻撃行動を行う。攻撃行動の途中、どちらか一方の個体が突然攻撃をやめて、相手から逃げるような行動を取る。この行動は降参を表し、逃げ出した方の個体が敗者となる。勝者は水槽の中を自由に泳ぎまわり、敗者は水槽の底でじっとしている。
- (B)6日間絶食させた魚と餌を与えた魚を闘争させたときの、それぞれのグループの勝率を示した。絶食させた魚の方が高い勝率を示した。
- (C)闘争継続時間(闘争を始めてから、一方が降参するまでの時間)。6日間絶食させた魚同士を闘わせた場合が最も闘争継続時間が長かった。
次に、絶食させた魚が勝負を諦めにくくなる神経メカニズムについて調べるために、闘争の勝敗を制御することが知られている注1)脳内の「手綱核-脚間核経路」に着目しました。勝者では手綱核から脚間核に伝わった神経興奮は背側被蓋野に出力されるのに対し、敗者では手綱核から脚間核に伝わった神経興奮は正中縫線核に出力されるというように、勝者と敗者では興奮伝播パターンが異なります注1)。つまり、勝者として振る舞うための手綱核-脚間核経路と敗者として振る舞うための手綱核-脚間核経路の二つが存在します(図2A)。今回、餌を与えた魚と絶食させた魚の興奮伝播パターンを調べた結果、絶食させた魚では、実際の闘争を行う前から、餌を与えた魚よりも勝者として振る舞うための手綱核-脚間核経路の興奮伝播が増強されていることが分かりました(図2B)。
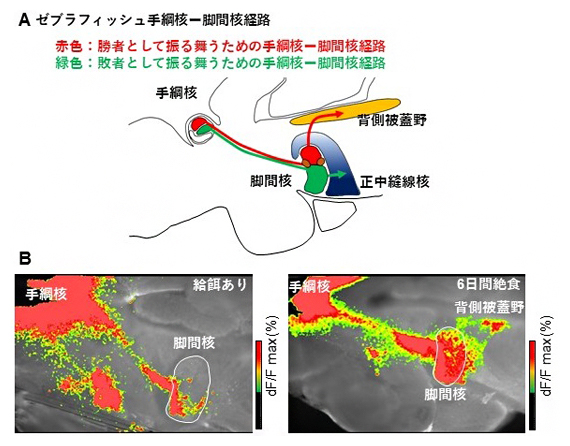
図2 絶食による手綱核-脚間核経路の活動変化
- (A)ゼブラフィッシュ手綱核-脚間核経路の模式図を示した。ゼブラフィッシュ脳を正中線上で切断した図。上が背側、下が腹側、左が鼻側、右が尾側。手綱核、脚間核、さらに下流の背側被蓋野、正中縫線核を示した。赤色で示した経路が勝者として振る舞うための経路で、手綱核から脚間核に伝わった神経興奮は背側被蓋野に伝わる。緑色で示した経路が敗者として振る舞うための経路で、手綱核から脚間核に伝わった神経興奮は正中縫線核に伝わる。
- (B)通常の給餌ありの魚(左)と絶食させた魚(右)における闘争行動前の手綱核-脚間核経路の興奮伝播パターン。手綱核を刺激したときに見られる下流の神経の興奮をイメージングしている。絶食させた魚では、Aで示した赤色の勝者として振る舞うための手綱核-脚間核経路において、より強い神経の興奮が見られることが分かる。
- 注1)2016年4月1日プレスリリース「動物の争いでいつ降参するかを決める神経回路」
さらに、勝者として振る舞うための手綱核-脚間核経路の興奮伝播が、絶食によって増強される仕組みを分子レベルで調べました。神経ペプチドのオレキシンは空腹によって発現量が増加し、食欲を増進させることが知られています。このオレキシンが、手綱核と脚間核の神経細胞同士の結合部分(シナプス)において、神経細胞同士の連絡を媒介する神経伝達物質の一つであるグルタミン酸の受容体の遺伝子発現を制御していることを突き止めました。
遺伝子のDNAから転写によりメッセンジャーRNA(mRNA)[3]が作られる際、スプライシングと呼ばれる遺伝子発現の調節機構によってタンパク質のアミノ酸配列をコードするエクソン[3]部分のみが残り、互いに結合されます。スプライシングのされ方の違いによって、同一の遺伝子から一部の塩基配列が異なるmRNAが作られることがあり、これらのmRNAを「スプライシングバリアント」と呼びます。それぞれのスプライシングバリアントはタンパク質に翻訳され、アミノ酸配列が一部異なるタンパク質が合成されます。
スプライシングバリアントが見られる遺伝子の例として、グルタミン酸受容体の遺伝子が挙げられます。グルタミン酸受容体では、アミノ酸配列の差異により、グルタミン酸の結合によって神経細胞の興奮が誘発されている時間に、数十ミリ秒の違いが生じることが知られています。空腹によって脳内でオレキシン濃度が上昇すると、グルタミン酸受容体のスプライシングに影響し、特定のスプライシングバリアントの割合が上昇することが分かりました(図3)。
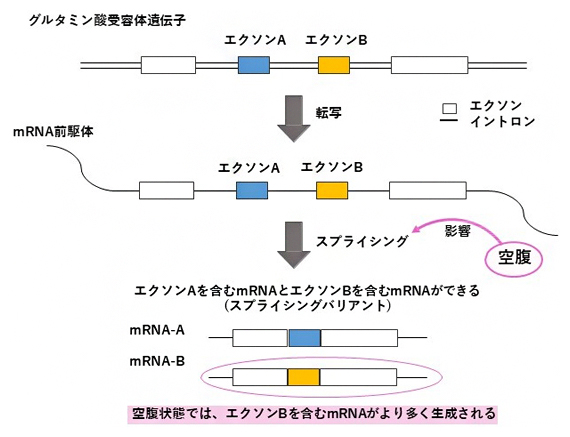
図3 絶食した魚におけるスプラシングバリアントの変化
空腹がグルタミン酸受容体の遺伝子の発現に与える影響について示す。グルタミン酸受容体の遺伝子から転写されたmRNAの前駆体には、タンパク質のアミノ酸配列をコードするエクソンAとエクソンBの両方が含まれる。エクソンAとエクソンBは、スプライシングの過程でどちらか一方がmRNAに含まれる。空腹はこのスプライシングの過程に影響し、エクソンBが含まれるmRNAの割合が増加する。
そこで、脚間核のグルタミン酸受容体の活動様式を調べたところ、空腹の魚ではグルタミン酸受容体が長い間興奮するようになり、勝者として振る舞うための手綱核-脚間核経路の神経興奮が増強されることが分かりました(図4)。以上の結果から、絶食させた魚では、闘争で勝者として振る舞う神経回路の興奮が増強することによって、相手に対して降参せず勝負を諦めにくい状態になると考えられます。
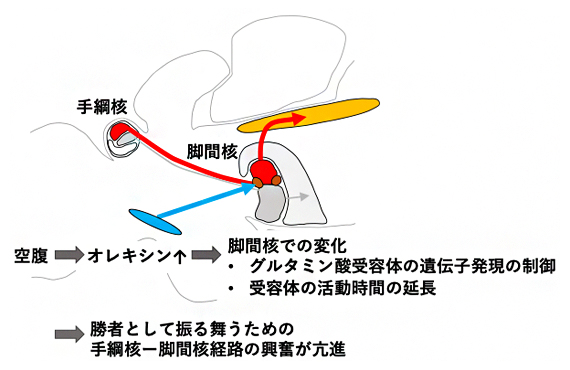
図4 本研究で明らかになったメカニズムの概要
絶食させたゼブラフィッシュが、闘争で勝負を諦めにくくなる神経メカニズムの概要を示した。空腹状態において、神経ペプチドのオレキシンの活動が亢進する。すると、オレキシンは勝者として振る舞うための経路の一部である脚間核に作用し、神経活動の受け手となるグルタミン酸受容体の遺伝子発現を制御して、スプライシングバリアントの発現量を変化させる。その結果、グルタミン酸受容体の活動時間が長くなる。これらの変化が引き起こされた結果、勝者として振る舞うための手綱核-脚間核経路の活動が亢進する。
今後の期待
本研究では、社会的上下関係を巡る闘争における粘り強さ(諦めにくさ)を制御する脳内神経回路の特性が、空腹という動物の内的状態により変化する仕組みを分子レベルで明らかにしました。
手綱核-脚間核神経経路は、魚から哺乳類まで全ての脊椎動物の脳に備わっており、ヒトを含めた哺乳類でも、この神経経路が空腹時での社会的闘争行動の変化に関与していると考えられます。さらなる研究によって、進化的に保存された「ハングリー精神」の神経メカニズムの全容が明らかになると期待できます。
補足説明
- 1.ゼブラフィッシュ
インド原産の淡水性熱帯魚で、飼育が比較的容易で多産のため、実験動物として利用されている。魚類とヒトは同じ脊椎動物であり、脳の基本構造や機能に相同性が見られることから、脳神経科学のモデル動物としても注目されている。 - 2.手綱核-脚間核経路
間脳にある手綱核から中脳にある脚間核へと情報を伝える回路で、大脳辺縁系と密接なつながりがある。この回路は、さまざまな認知機能をつかさどる前能からの情報を受け取り、ドーパミンやセロトニンといった、意欲や気分と関わる神経伝達物質を放出する領域を制御することが知られている。 - 3.スプライシング、メッセンジャーRNA(mRNA)、エクソン
ゲノムはA、T、G、Cという塩基がつながったDNAで成り立っている。そのなかで、それぞれのタンパク質合成の情報を担っている部分は、遺伝子と呼ばれる。遺伝子の中で、タンパク質アミノ酸配列の情報を直接コードしている塩基配列は「エクソン」と呼ばれ、その間のタンパク質に翻訳されない配列は「イントロン」と呼ばれる。遺伝子がコードするタンパク質の合成に直接関わる「メッセンジャーRNA(mRNA)」は、遺伝子のエクソン部分の配列のみを拾ってつなげることによって作られる。このように、タンパク質を合成するために、必要なエクソンだけをつなげてmRNAを作る過程を「スプライシング」と呼ぶ。
国際共同研究グループ
理化学研究所 脳神経科学研究センター 意思決定回路動態研究チーム
チームリーダー 岡本 仁(おかもと ひとし)
研究員 中條 暖奈(なかじょう はるな)
研究員 木下 雅恵(きのした まさえ)
研究員(研究当時) 周 銘翊(しゅう みんい)
東京大学 大学院総合文化研究科
教授 坪井 貴司(つぼい たかし)
京都大学大学院 情報学研究科
特定准教授(研究当時) 島崎 秀昭(しまざき ひであき)
Bar-Ilan University, the Faculty of Life Sciences and the Multidisciplinary Brain Research Center
教授 リオ・アッペルバウム(Lior Appelbaum)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(S)「社会的闘争を制御する神経回路機構(研究代表者:岡本仁)」、理研ジュニア・リサーチ・アソシエイト(JRA)プログラム、花王株式会社による支援を受けて行われました。
原論文情報
- Haruna Nakajo, Ming-Yi Chou, Masae Kinoshita, Lior Appelbaum, Hideaki Shimazaki, Takashi Tsuboi, Hitoshi Okamoto, "Hunger potentiates the habenular winner pathway for social conflict by orexin-promoted biased alternative splicing of the AMPA receptor gene.", Cell Reports, j.celrep.2020.107790
発表者
理化学研究所
脳神経科学研究センター 意思決定回路動態研究チーム
研究員 中條 暖奈(なかじょう はるな)
チームリーダー 岡本 仁(おかもと ひとし)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
