理化学研究所(理研)環境資源科学研究センター(CSRS)バイオ高分子研究チームの緑川景子特別研究員、土屋康佑客員研究員、児玉豊客員研究員、沼田圭司チームリーダーらの研究チームは、植物細胞に適した、標的分子の細胞内移行プロセスを可視化できる新しいラマンプローブ[1]を開発しました。
本研究成果は、様々な物質が植物細胞内にどのように取り込まれるのか、そのメカニズムを知る新たな糸口になると期待できます。
今回、研究チームは、高いラマン強度[2]を持つジフェニルアセチレン[3]と生体適合性の高い高分子担体[4]を組み合わせることによって、検出感度が良く、細胞膜透過性の高い実用的なラマンプローブを開発しました。さらに、このプローブと組み合わせる高分子担体の種類に応じて(もしくは依存して)、細胞内への取り込み経路が異なることを見いだしました。開発したプローブは細胞毒性が低く、細胞内へ送達したい物質(標的分子)を結合することで、さまざまな標的分子の細胞内移行プロセスを可視化できます。
本研究は、科学雑誌『RSC Chemical Biology』(8月20日付)にオンライン掲載されます。
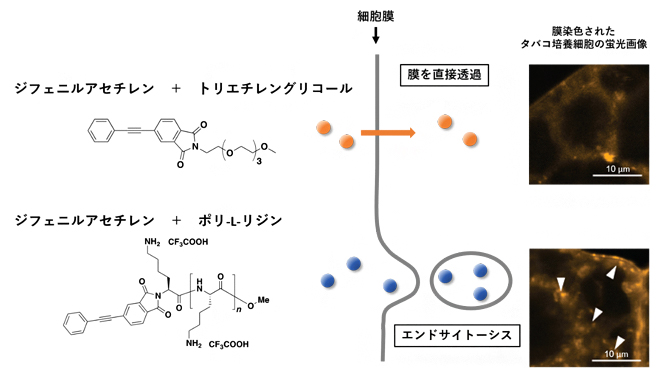
開発したプローブの異なる取り込み経路
背景
植物細胞は、人間にとって有用な多くの二次代謝産物[5]を合成します。近年の遺伝子工学技術は、これらの代謝産物の生産性向上に大きく貢献してきました。その技術の一つに、高分子担体との複合体を用いた方法があります注1)。この方法で、さまざまな生理活性分子を細胞内へ輸送することが可能となり、遺伝子組換え[6]による物質生産効率の向上が期待できます。
生理活性物質をより効率良く細胞内へ輸送するためには、さまざまな物質が細胞内に取り込まれる経路を明らかにする必要があります。しかし、そのためのツールとして現在汎用されている蛍光プローブ[7]では、生体内での非特異的な相互作用や予期せぬ化学反応を避けるために、各標的分子や標的細胞に応じて、プローブを設計する必要がありました。そこで研究チームは、より広範な標的分子に適用できるラマンプローブに着目しました。
- 注1)Yoshizumi, T., Oikawa, K., Chuah, J.-A., Kodama, Y. & Numata, K. Selective gene delivery for integrating exogenous DNA into plastid and mitochondrial genomes using peptide-DNA complexes. Biomacromolecules 19, 1582-1591 (2018).
Chuah, J.-A. & Numata, K. Stimulus-responsive peptide for effective delivery and release of DNA in plants. Biomacromolecules 19, 1154-1163 (2018).
研究手法と成果
ラマンプローブは、ラマン顕微鏡[8]を使用することで、プローブが持つ特定の化学構造に起因する振動を直接検出することができます。また、ラマンプローブは生体内で反応性の低い官能基を持つことから、さまざまな標的分子に共通して使用することができます。特に、三重結合を持つアルキン基やジフェニルアセチレン部位は、ラマンスペクトルのサイレント領域[9]に特定の高いピークを生成するため、標的分子を修飾する分子プローブとして最適な候補です。
しかし、これらの構造を含むプローブは、いずれも疎水性で植物細胞への浸透性が低く、細胞毒性を持つという課題がありました。そこで研究チームは、強力なラマン強度を持つジフェニルアセチレンに、親水性かつ生体適合性の高い高分子担体を付加することで植物細胞への浸透性を高め、これらの課題を克服しました。
まず、3種類の高分子担体、ポリ-L-リジン、トリエチレングリコール、ポリエチレングリコールに、それぞれジフェニルアセチレンと組み合わせたプローブを合成しました(図1A)。合成したプローブをタバコ培養細胞に取り込ませたところ、ポリ-L-リジンを含むプローブ(プローブ1)、またはトリエチレングリコールを含むプローブ(プローブ2)のシグナルが、細胞質内で検出されました(図1B,C)。
モデル植物であるシロイヌナズナを用いた解析でも、葉の細胞や根の細胞において、同様の結果が得られました。さらに、これらのプローブは細胞毒性が非常に低いことも確認できました。
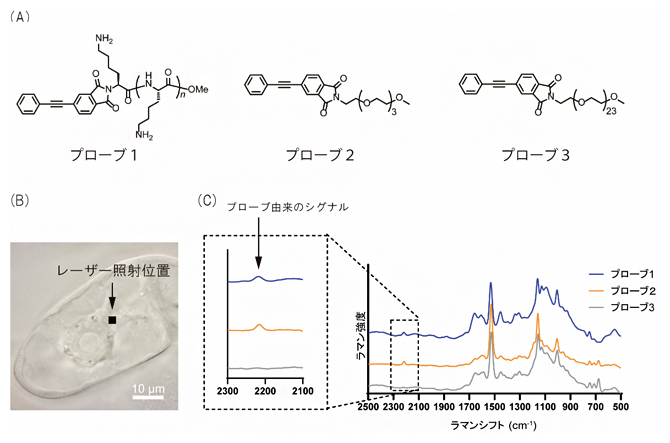
図1 合成したラマンプローブとプローブを取り込ませたタバコ培養細胞のラマンスペクトル
- (A)合成した3種類のラマンプローブの化学構造。高分子担体として、プローブ1はポリ-L-リジン、プローブ2はトリエチレングリコール、プローブ3はポリエチレングリコールをそれぞれジフェニルアセチレンに付加した。
- (B)プローブを処理したタバコ培養細胞の顕微鏡画像。細胞質にレーザーを照射した。
- (C)レーザー照射位置のラマンスペクトル。プローブ1または2を処理した培養細胞では、1800~2800cm-1のサイレント領域に、プローブ由来のシグナルが検出された。
続いて、プローブの細胞内取り込みメカニズムをさらに詳しく調べるため、タバコ培養細胞の細胞膜を蛍光色素FM4-64で染色し、共焦点レーザー走査型顕微鏡[10]で観察しました。すると、プローブ1を処理した細胞では、細胞質で特徴的な小胞構造[11]が見られ(図2)、この構造は、細胞内への物質取り込みの際に生じるエンドサイトーシス[12]に起因すると考えられました。一方、プローブ2やプローブ3を処理した細胞では、このような構造は観察されなかったことから、これらのプローブが異なる取り込み経路を持つことが示されました。
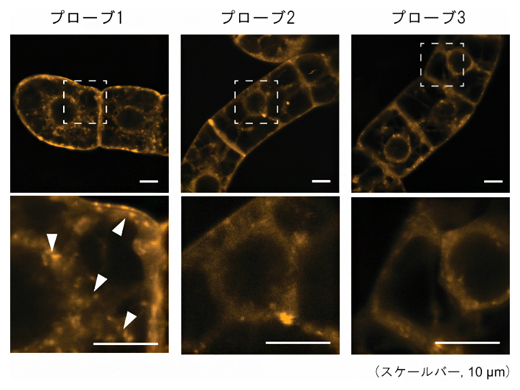
図2 細胞膜を蛍光色素FM4-64で染色したタバコ培養細胞の蛍光画像
それぞれのラマンプローブを処理したタバコ培養細胞をFM4-64で染色した。下段は、上段の破線部分を拡大した画像。プローブ1を処理した細胞で、特徴的な小胞構造が観察された(白矢頭)。スケールバーは、全て10マイクロメートル(μm、1μmは1,000分の1mm)を示す。
次に、プローブ1がエンドサイトーシスによって取り込まれているかどうかを調べるため、エンドサイトーシス阻害実験を行いました(図3)。その結果、エンドサイトーシスが阻害される低温条件下や阻害剤存在下では、プローブ1の取り込みが抑制されることが明らかとなりました。一方、プローブ2は、エンドサイトーシスを阻害しても細胞内へ取り込まれていました。これは、プローブ2が細胞膜を透過して直接細胞内へ取り込まれていることを示しています。
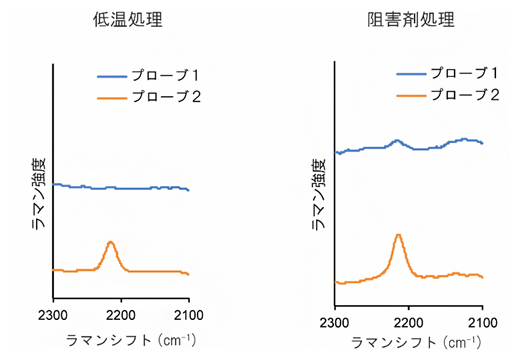
図3 エンドサイトーシスを阻害したタバコ培養細胞のラマンスペクトル
タバコ培養細胞を低温(左)または阻害剤(右)処理することによって、エンドサイトーシスを阻害した。プローブ2を処理した細胞では、プローブ由来のシグナルが検出されたが、プローブ1の取り込みは抑制された。
以上のことから、本研究では、強いラマンシグナルと親水性高分子担体からなる新しい化合物が、高感度ラマンプローブとして機能することが示されました。同時に、これらのラマンプローブは、付加する高分子担体の種類に応じてて異なる細胞内取り込み経路を示すことが分かりました。
今後の期待
本研究では、ジフェニルアセチレンと特定の高分子担体を組み合わせることで、植物細胞に適した、高いラマン感度と膜透過性、および低い細胞毒性を示す実用的なラマンプローブの開発に成功しました。また、プローブに含まれるジフェニルアセチレン部位に、反応性の官能基を付与することで、細胞内へ送達したい物質を結合することができます。植物細胞でこのようなラマンプローブを使用することで、細胞内への物質輸送プロセスに関する新たな知見が得られると期待できます。
補足説明
- 1.ラマンプローブ
観察したい対象の分子を、ラマン分光法によって識別するための分子。 - 2.ラマン強度
ラマン分光法によって得られるラマンスペクトルで示される散乱強度。 - 3.ジフェニルアセチレン
化学式C6H5C≡CC6H5で表されるアルキンの一種。アセチレンの両端にフェニル基がそれぞれ結合している。 - 4.高分子担体
物質を輸送するための高分子成分。 - 5.二次代謝産物
植物の生存にとって必須な細胞の増殖や成長、発生に関与する一次代謝産物に対し、それ以外の代謝産物。医薬品や香料、化粧品など広く活用されている。 - 6.遺伝子組換え
ある生物に別の生物由来の遺伝子を挿入したり、もともと持っていた遺伝子の機能を抑制したりすることを可能にする技術。 - 7.蛍光プローブ
標的とする生体分子との化学反応によって、蛍光特性が変化する機能性分子。 - 8.ラマン顕微鏡
物質に光が入射されたとき、散乱された光の中に入射された光の波長と異なる波長の光、すなわちラマン散乱光が含まれる。ラマン顕微鏡は試料にレーザーを照射することで、わずかに発生するラマン散乱光を検出し、分子構造や化学組成など、さまざまな物性を測定できる。 - 9.サイレント領域
タンパク質や脂質など、生体内の分子によるラマン散乱がほとんど観察されない波数域(1800~2800cm-1)。 - 10.共焦点レーザー走査型顕微鏡
高解像度の蛍光画像を取得できる顕微鏡の一種。 - 11.小胞構造
細胞内にある、リン脂質膜に包まれた袋状の構造体。細胞内で物質を貯蔵したり、細胞内外に物質を輸送したりする機能を持つ。 - 12.エンドサイトーシス
細胞が外来物質を取り込む経路の一つ。細胞膜を内側に陥入させて小胞を形成することで、細胞内へ取り込む。
研究チーム
理化学研究所 環境資源科学研究センター バイオ高分子研究チーム
チームリーダー 沼田 圭司(ぬまた けいじ)
(京都大学大学院 工学系研究科 教授)
特別研究員 緑川 景子(みどりかわ けいこ)
客員研究員 土屋 康佑(つちや こうすけ)
(京都大学大学院 工学系研究科 特定准教授)
客員研究員 児玉 豊(こだま ゆたか)
(宇都宮大学 バイオサイエンス教育研究センター 准教授)
特別研究員 サイモン・サウ・イン・ロウ(Simon Sau Yin Law)
研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 総括実施型研究ERATO「沼田オルガネラ反応クラスタープロジェクト(研究総括:沼田圭司)」による支援を受けて行われました。
原論文情報
- Keiko Midorikawa, Kousuke Tsuchiya, Simon Sau Yin Law, Yu Miyagi, Takuya Asai, Takanori Iino, Yasuyuki Ozeki, Yutaka Kodama, and Keiji Numata, "Cellular internalization mechanism of novel Raman probes designed for plant cells", RSC Chemical Biology, 10.1039/d0cb00128g
発表者
理化学研究所
環境資源科学研究センター バイオ高分子研究チーム
特別研究員 緑川 景子(みどりかわ けいこ)
客員研究員 土屋 康佑(つちや こうすけ)
客員研究員 児玉 豊(こだま ゆたか)
チームリーダー 沼田 圭司(ぬまた けいじ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
