理化学研究所(理研)開拓研究本部田中生体機能合成化学研究室の田中克典主任研究員(東京工業大学 物質理工学院 応用化学系 教授)、ケンワード・ヴォン研究員(理研 バトンゾーン研究推進プログラム 糖鎖ターゲティング研究チーム 研究員)らの共同研究チームは、がん細胞などの標的組織で選択的に薬剤を放出できる遷移金属触媒[1]反応を開発しました。
本研究成果は、薬剤の薬効や物性(細胞膜透過性)を生体内反応で制御する「プロドラッグ[2]」の新たな手法として利用できると期待できます。
保護基[3]によって不活性状態にある薬剤を治療標的の組織上で脱保護(保護基を除去)し、活性化する生体直交型反応[4]は、薬剤の副作用の軽減につながるプロドラッグの新手法として注目を集めています。
今回、研究チームは、薬剤のアミノ基に導入できる保護基として「2-アルキニルベンズアミド基(Ayba基)」を開発しました。Ayba基は、遷移金属元素の金(Au)触媒との化学反応によって脱保護され、アミノ基を再生することが可能です。特に、この化学反応は生体内環境でも進行することから、プロドラッグを活性化する生体反応として使用できます。本研究では、Ayba基の構造や金属触媒の種類を調節することで、薬剤の活性を金属触媒反応によって自在に制御し、がん細胞を殺傷することに成功しました。
本研究は、科学雑誌『Chemical Science』のオンライン版(9月2日付:日本時間9月2日)に掲載されます。
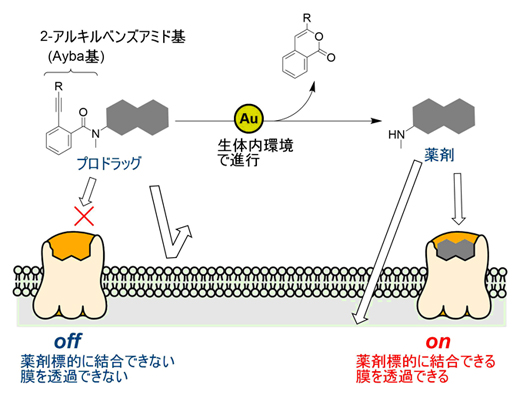
金触媒による生体直交型反応とプロドラッグへの応用
背景
さまざまな分子が混在する生体内環境で、特定の分子のみを選択的に活性化する化学反応は「生体直交型反応」と呼ばれ、薬剤分子の物性(細胞膜透過性)や薬効を生体内で変化させるツールとして用いられています。特に、薬剤に導入した保護基を脱保護(除去)する生体直交型反応は、既存の薬剤を生体内で活性化する「プロドラッグ」の新手法として注目を集めています(図1A)。生体直交型反応によって、治療標的となる細胞で選択的に薬剤を活性化することができれば、薬剤の副作用の軽減につながります。
近年、遷移金属触媒を用いた生体直交型反応によって、薬剤に導入した保護基を除去し、プロドラッグに用いる研究が始まっています。例えばこれまでに、鉄(Fe)やルテニウム(Ru)、パラジウム(Pd)などの触媒を用いて、生体内で保護基を除去する研究が行われてきました(図1B)。
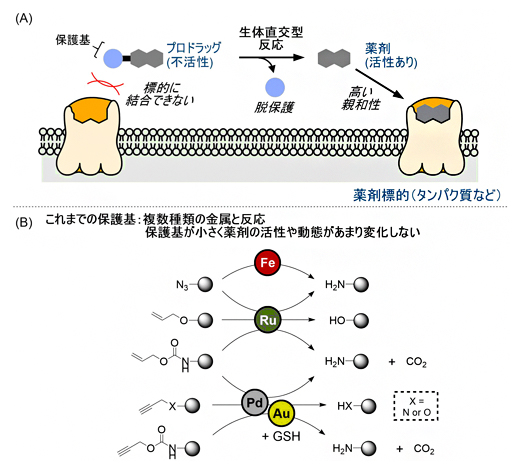
図1 遷移金属触媒を用いた脱保護反応とプロドラッグへの応用
- (A)今回開発した、脱保護反応のプロドラッグへの応用。薬剤に保護基を導入したプロドラッグでは、標的タンパク質への親和性や物性(細胞膜透過性)が変化し薬効を示さないが、脱保護反応を行うことで本来の薬剤活性が復活する。
- (B)これまでの手法であった、遷移金属触媒による生体直交型の脱保護反応。
遷移金属触媒による生体直交型反応で、特定の金属と選択的に反応する保護基を開発できれば、さまざまな生体直交型反応をそれぞれ選択的に実施できるようになり、プロドラッグの応用性が広がります。しかし、これまでに開発されてきた保護基は複数種類の金属触媒と反応してしまうため、選択的に薬剤を活性化させることはできませんでした。
また、プロドラッグに用いる保護基は、それを導入することで薬剤を著しく不活性化し、さらに活性に必要な物性や体内動態を大きく変化させる必要があります。しかし、これまでに開発されてきた保護基は、金属触媒反応を効率的に進行させるために、必然的に分子サイズが小さい反応性置換基が用いられており、これらを多種多様の薬剤に導入しても、活性や物性や体内動態を自在に変化させることは困難でした。
そこで研究チームは、特定の金属とのみ反応し、かつ薬剤の活性や物性、体内動態を大きく変化させられる保護基の開発を目指しました。
研究手法と成果
研究チームは、金(Au)触媒によって選択的に除去できる保護基として「2-アルキニルベンズアミド基(Ayba基)」をデザインしました。Ayba基に含まれるアルキン(炭素間三重結合を持つ官能基)は生体外で金触媒によって選択的に活性化されることから、生体直交型の化学反応でも選択的に脱保護されると予想しました(図2)。すなわち、Ayba基のアルキンが金触媒によって活性化され、アミド基の酸素による環化反応引き起こされ、さらに加水分解を起こすことで脱保護反応が進行すると考えました。
実際に、生体内と似た環境である緩衝液中や血清中において、Ayba基に対して金触媒を採用させたところ、脱保護反応が室温で良好に進行することが分かりました。一方で、パラジウムやルテニウム触媒を用いた条件では、脱保護反応は全く進行しなかったことから、Ayba基が金触媒によって選択的に除去できる保護基であることが分かりました。
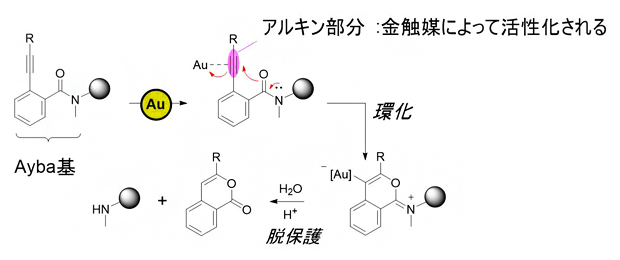
図2 金触媒によるAyba基の脱保護反応機構
金触媒に対して高い親和性を持つアルキン部分が効率的に活性化され、アミド基の酸素による求核攻撃によって環化反応が起こった後、加水分解を起こすことで脱保護反応が進行する。
そこで、Ayba基の金触媒による脱保護反応が、他の金属触媒反応による脱保護反応と区別して選択的に行えるかどうかを検討しました(図3A)。エンドキシフェン抗がん剤のアミノ基にAyba基を導入したプロドラッグ1と、ドキソルビシン抗がん剤のアミノ基に対して、ルテニウム触媒で脱保護できるAlloc基を導入したプロドラッグ2を水溶液中で混合しました。この水溶液に金触媒を加えたところ、予想通りにAyba基が選択的に脱保護され、エンドキシフェンのみを活性化することができました(図3B)。
一方、この水溶液にルテニウム触媒を加えたところ、Ayba基に影響を与えることなく、今度はAlloc基が脱保護され、ドキソルビシンのみを活性化できました。同様に、パラジウムで除去できるProc基を導入したドキソルビシンのプロドラッグ3とプロドラッグ1を混合した場合でも、Ayba基は金触媒で、Proc基はパラジウム触媒でのみ選択的に脱保護を行うことができました(図3C)。この実験により、Ayba基、Alloc基、そしてProc基に対してそれぞれ異なる遷移金属触媒反応を施すことにより、選択的に薬剤を活性化することが可能となりました。
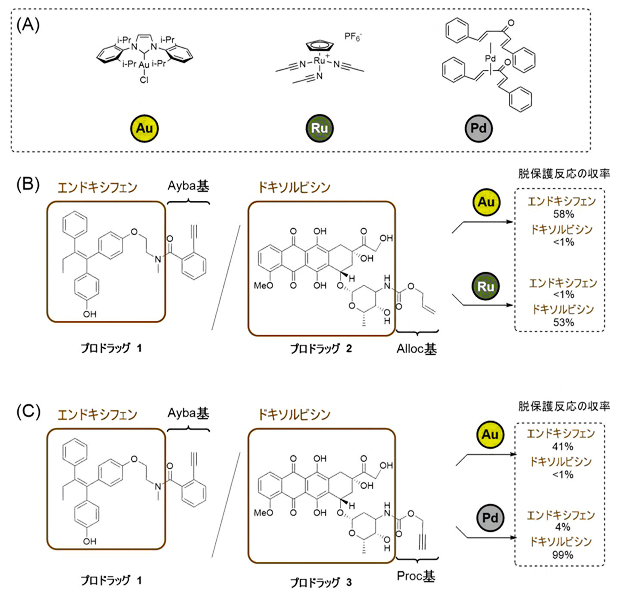
図3 脱保護反応の金属触媒選択性
- (A) Ayba基、Alloc基、Proc基の脱保護反応に用いた3種類の遷移金属触媒。
- (B) (C) 脱保護反応における金属触媒選択性の比較。金触媒を加えた条件ではAyba基を導入したエンドキシフェンのみが脱保護された一方で、Alloc基やProc基を除去する反応条件ではAyba基は除去されなかった。
さらに、Ayba基のアルキン官能基にさまざまな置換基を導入した場合にでも、金触媒による脱保護反応が効率的に進行することを見いだしました。このことは、さまざまな置換基を持つAyba保護基を導入することによって、疾患部位上でプロドラッグから薬剤を効率的に活性化させることに加えて、脱保護の前後で物性を大きく変化させられることを示しています。
実際に、親水性のエチレングリコール部分を持ったAyba基を薬剤に導入してプロドラッグを調製し、金触媒によって薬剤の物性や薬効を変化させることを試みました。ドキソルビシン抗がん剤に対して、最も簡単な構造のAyba基、および親水性のエチレングリコール部分を持つAyba基を導入したプロドラッグ4と5を合成しました(図4A)。まず、ドキソルビシン、およびプロドラッグ4と5をHeLa細胞(ヒト子宮がん由来細胞)に作用させ、蛍光顕微鏡でドキソルビシン自身が持つ蛍光を観測したところ、ドキソルビシンや親水性部分を持たないプロドラッグ4は細胞内に取り込まれることが分かりました(図4B)。一方で、親水性部分を持つプロドラッグ5は細胞膜を透過できず、細胞内にほとんど取り込まれないことが分かりました(図4B)。このことから、プロドラッグの分子構造をAyba基の構造で調節することで、細胞内への移行性を制御することが可能となりました。
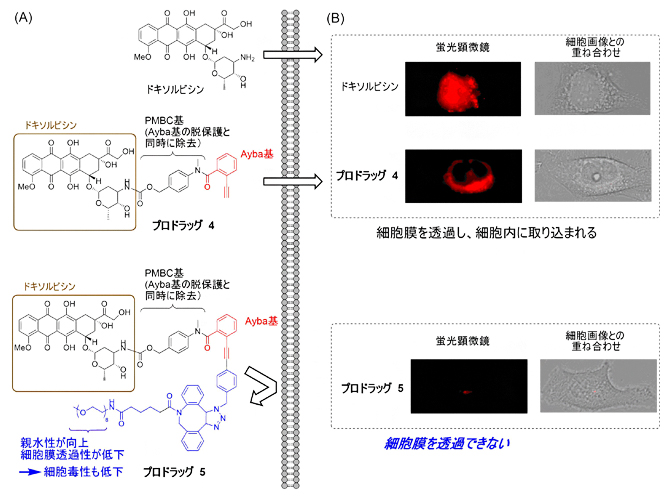
図4 Ayba基を持つプロドラッグの細胞膜透過性
- (A)ドキソルビシンにAyba基を導入したプロドラッグの構造と細胞膜透過性。
- (B)細胞に作用させたドキソルビシン由来の蛍光を蛍光顕微鏡で観察した様子。親水性のエチレングリコール部分を持つAyba基を導入したプロドラッグ5を作用させた条件では、細胞内に移行しにくい。
そこで、これらのプロドラッグについて、HeLa細胞、A549細胞(ヒト肺胞基底上皮腺がん細胞)、PC3細胞(ヒト前立腺がん細胞)に対する増殖阻害活性を調べたところ、親水性のAyba基を導入したプロドラッグ5の増殖阻害活性(50%効果濃度[5])は、簡単な構造のAyba基を持つプロドラッグ4に比べて大きく減少していることが分かりました(図5)。これは、プロドラッグ4が細胞内に移行できないために、増殖阻害活性を示すことができないという結果です。
さらに、これらのがん細胞に対して、プロドラッグ4と5に加え、金触媒Au-1を作用させたところ、プロドラッグ4では金触媒を加えても2?5倍程度しか活性が向上しないのに対し、プロドラッグ5では金触媒を加えることで180?450倍も向上することが分かりました(図5)。プロドラッグの効果を評価する場合に、脱保護した際に、薬剤の活性がどれくらい向上するかが最も重要な指標となります。さまざまな置換基の導入が可能なAyba基を開発することにより、薬剤の薬効と物性(細胞膜透過性)を制御する新しいプロドラッグの戦略を実現しました。
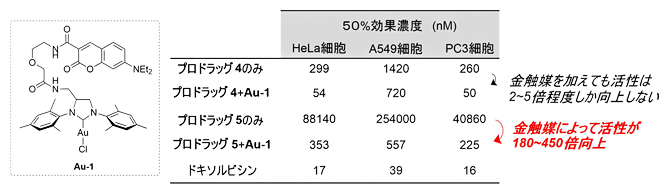
図5 Ayba基を持つプロドラッグの細胞増殖阻害試験
プロドラッグのみ、およびプロドラッグと金触媒を共存させた条件での細胞増殖阻害(50%効果濃度)。水性のAyba基を持つプロドラッグ5の細胞増殖阻害は、簡単な構造のAyba基を持つプロドラッグ4に比べて大きく減少した。また、プロドラッグ4では金触媒を加えても活性が2?5倍程度しか向上しないのに対し、プロドラッグ5では活性が180?450倍向上した。
今後の期待
従来のプロドラッグ法では、疾患細胞で過剰に発現している内在性の酵素を用いたり、抗体・酵素複合体を疾患に送り込んだりして実施されてきました。しかし、実際の患者の疾患で普遍的に発現する酵素は稀であり、一般性に大きな問題が残されていました。今回開発したAyba基は、生体内分子や分子官能基に影響を与えることなく、金触媒で選択的に脱保護することが可能であり、生体内でも薬剤の活性や膜透過性を自在に制御することが可能です。Ayba基はアミノ基を持つ薬剤であれば導入が可能であり、さまざまな薬剤のプロドラッグとして利用されることが期待できます。本手法に併せて、別途開発中の金触媒を疾患標的部位に選択的に届ける手法を組み合わせることで、薬剤の効果増強、副作用の低減を達成することを目指していく予定です。
補足説明
- 1.遷移金属触媒
周期表の第3族から第11族までに属する遷移金属元素により構成される触媒。これらの元素は特定の官能基に対して強い親和性を示すため、さまざまな有機化学反応を触媒することが知られている。 - 2.プロドラッグ
薬剤の標的部位での生体内反応を引き金として、薬効を持つ化合物へと変換されるようにデザインされた薬剤。この手法によって、薬剤の組織選択性の向上による副作用軽減、吸収性の向上、代謝安定性の向上が期待できる。 - 3.保護基
有機化合物の反応性の高い官能基に導入することで、不活性化できる官能基。化学反応を行う際に、特定の官能基における望まない反応を防ぐために導入され、特定の反応条件で除去することが可能である。また、薬剤の官能基に保護基を導入し、標的となるタンパク質との相互作用を制御する研究も行われており、生体内反応によって保護基を除去できれば、プロドラッグとして利用できる。 - 4.生体直交型反応
タンパク質や糖などさまざまな生体分子が混在し、水溶媒条件である生体内環境において、特定の基質に対して選択的に進行する有機化学反応。生体内分子の蛍光修飾や薬剤の活性化に応用する研究が進められている。 - 5.50%効果濃度
薬物の作用が最大値の50%となる濃度。薬理作用の強さを定量的に比較する場合に用いられ、この値が小さいほど薬理作用は強い。
共同研究チーム
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(東京工業大学 物質理工学院 応用化学系 教授)
研究員 ケンワード・ヴォン(Kenward Vong)
(理研 バトンゾーン研究推進プログラム 糖鎖ターゲティング研究チーム 研究員)
特別研究員 山本 智也(やまもと ともや)
特別研究員 チャン・ツンチェ(Chang Tsung-che)
研究支援
本研究は日本医療研究開発機構(AMED)先端的バイオ創薬等基盤技術開発事業「糖鎖付加人工金属酵素による生体内合成化学治療(研究代表者:田中克典)」による支援を受けて行われました。
原論文情報
- Kenward Vong, Tomoya Yamamoto, Tsung-che Chang, and Katsunori Tanaka, "Bioorthogonal release of anticancer drugs via gold-triggered 2-alkynylbenzamide cyclization", Chemical Science, 10.1039/d0sc04329j
発表者
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(東京工業大学 物質理工学院 応用化学系 教授)
研究員 ケンワード・ヴォン(Kenward Vong)
(理研 バトンゾーン研究推進プログラム 糖鎖ターゲティング研究チーム 研究員)
 左から田中克典主任研究員、チャン・ツンチェ特別研究員、山本智也特別研究員、ケンワード・ヴォン研究員
左から田中克典主任研究員、チャン・ツンチェ特別研究員、山本智也特別研究員、ケンワード・ヴォン研究員
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
東京工業大学 総務部 広報課
Tel: 03-5734-2975 / Fax: 03-5734-3661
Email: media [at] jim.titech.ac.jp
産業利用に関するお問い合わせ
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当
Email: sentan-bio [at] amed.go.jp
※上記の[at]は@に置き換えてください。
