理化学研究所(理研)生命機能科学研究センター集積バイオデバイス研究チームの田中陽チームリーダー、船野俊一研究員、合成生物学研究チームの上田泰己チームリーダー、戸根大輔研究員らの研究チームは、遺伝子を改変した動物の作製に必要な「ES細胞[1]」の細胞塊(コロニー[2])を簡便に単離するためのデバイスを開発しました。
本デバイスを利用すれば、高価な細胞塊分離装置がない生物系研究室においても簡単に素早くコロニーを分離できます。
遺伝子配列をゲノムの特定箇所に挿入する遺伝子ノックインを始めとする遺伝子改変マウスの作製には、ES細胞を利用する方法が広く用いられています。ここで用いるES細胞を準備するためには、遺伝子改変操作を行ったES細胞集団の中から、正しく遺伝子が改変されたES細胞コロニーを顕微鏡下で単離・回収する過程が必要となります。しかし、この過程は手作業で行う必要があり、熟練の技術を必要とする煩雑なものでした。
今回、研究チームは、コロニーを線状に並べて見つけやすく、また採取しやすくするための細い溝と、採取したコロニーを入れて培養するくぼみ(ウェル)を近接させたデバイスを新たに作製し、このデバイスを使用することでES細胞コロニーの単離・回収速度が熟練者の場合は1.5倍、初心者の場合は2.3倍程度向上することを実証しました。
本研究は、オンライン科学雑誌『BMC Research Notes』(10月5日付:日本時間10月5日)に掲載されます。
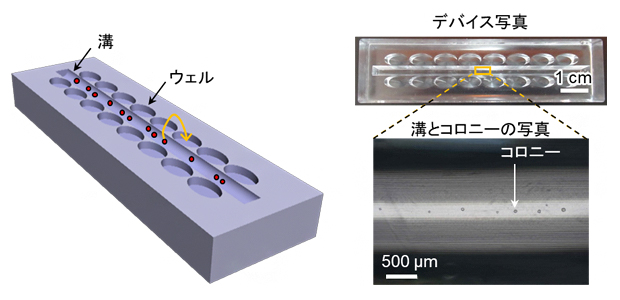
今回開発したデバイスのデザインと(左)実際の写真(右)
背景
遺伝子改変マウスの作製は、医学や生物学の分野において、遺伝子の働きや病気の機序の解明に不可欠です。近年、CRISPR/Cas9[3]などを用いた初期胚のゲノム編集技術[3]の発展により、遺伝子改変マウスの作製は簡便化されてきました。
一方で、数千塩基に及ぶ長さの遺伝子配列をゲノムの特定箇所に挿入するような遺伝子ノックインについては、初期胚ゲノム編集技術を利用しても十分な効率が達成されていません。そのため、作製されたマウス個体内で、遺伝子が正しくノックインされた細胞とそうでない細胞が混ざりあったモザイク状態となることから、詳しい解析のためにはマウス同士を掛け合わせ、全身が均一に遺伝子ノックインされた細胞からなるマウスを得る必要があります。この過程には、1年程度の時間と労力を要します。
これに対し、上田泰己チームリーダーらは掛け合わせを介することなく、全身が均質な細胞からなる遺伝子改変マウスを作製できる新たな技術を確立してきました。この方法では、遺伝子ノックインを含め任意の遺伝子改変を行ったマウスES細胞を準備すれば、そこから3カ月程度で詳しい解析に利用できる遺伝子改変マウスを得ることが可能となりました(ESマウス法)。
また、このESマウス法に必要な遺伝子改変ES細胞を調製する過程の効率化も目指してきました。なかでも、正しく遺伝子が改変されたES細胞を選別するために、1細胞由来のES細胞塊(コロニー)を顕微鏡下で単離・回収する過程は煩雑であり、熟練の技術が必要となります。これに対し、上田泰己チームリーダーらはセルソーター[4]を利用した操作の自動化により、この過程の効率化を実現しました注1)。しかし、この装置は非常に高価であり、どの研究室でも導入できるわけではありません。
そこで今回、研究チームは、ES細胞コロニーの単離を簡便化するデバイスをデザインしました。このデバイスでは、コロニーを見つけやすくするための溝とコロニーを単離・回収するためのくぼみ(ウェル)を近接させることで、顕微鏡下でのコロニー単離を効率化・簡便化させることを目指しました(図1)。
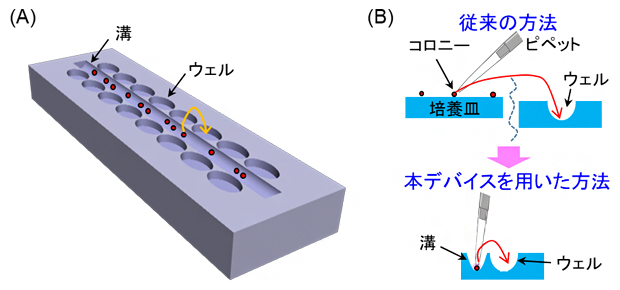
図1 本研究のコンセプト
- (A)デバイスのデザイン。溝中にコロニーを導入し、1個ずつ採取してウェルに入れる。
- (B)従来の方法とデバイスを用いた方法の比較。従来法では、コロニーの入った培養皿と単離・回収するウェルの場所が離れていた。本研究では、コロニーの入った溝とウェルを近接させることで、顕微鏡下での単離を効率化・簡便化させる。
- 注1)2017年11月17日プレスリリース「次世代型マウス遺伝学の実現」
研究手法と成果
研究チームはまず、サイズが50マイクロメートル(μm、1μmは1,000分の1mm)前後のES細胞コロニーを対象としたデバイスを作製しました。溝の幅は2mmとし、ウェルの大きさは長軸4mm、短軸2mmの楕円形、底は円錐状としました。溝の幅は、ピペットの先がぎりぎり入り、かつ細胞が線状に並ぶ太さ、ウェルのサイズや間隔は、今後の展開も考え、市販の96ウェルプレートや8連ピペットと適合するサイズや形状としました。製作法としては、アルミを切削加工して溝やウェルとは逆の凸型形状を持つ鋳型を作り、ここに液状ポリジメチルシキロサン(PDMS)[5]を流し込み、70℃で加熱硬化させ、鋳型から取り外すという手順で行いました。
また、表面処理についても検討しました。図2Aに示すように、表面処理なしのウェルにコロニーが入った液滴を滴下する場合、壁面に液滴をつけても下に落ちないため、ウェルの底に届くようにピペットを立てる必要があります。このとき、通常の顕微鏡を用いる場合はピペットがレンズとぶつかるため、いったん顕微鏡のステージからデバイスを外す必要があり、手間がかかります。一方、液滴の量を増やすと、溝から2個以上のコロニーを採取するおそれがある上、その後加える酵素の濃度が下がるため、酵素処理が阻害されてしまいます。
そこで、少ない量の液滴で壁面につけた場合でも底に落ちやすくするため、表面処理を施すことを考えました。処理法は、液をはじかせて落とす疎水処理と馴染ませて落とす親水処理の2種類があります。今回、疎水処理は、フッ素コーティング剤[6]、親水処理はウシ血清アルブミン(BSA)[7]を用いました。その結果を図2B-Dに示します。処理なし、もしくはフッ素コーティング剤処理の場合、液滴量を10マイクロリットル(μL、1μLは100万分の1リットル)まで増やしても底に落ちませんでした。一方、BSA処理の場合は、2μL以上で底に落ちることが確認されました。1個のコロニーを採取する際の液滴量も約2μLであることから、BSA処理で十分にコロニーが入った液滴をウェルの底に滴下できることが分かりました。また、BSA処理効果の持続時間を調べた結果を図2Eに示します。BSA処理後10分までは親水処理効果が十分持続することが分かりました。
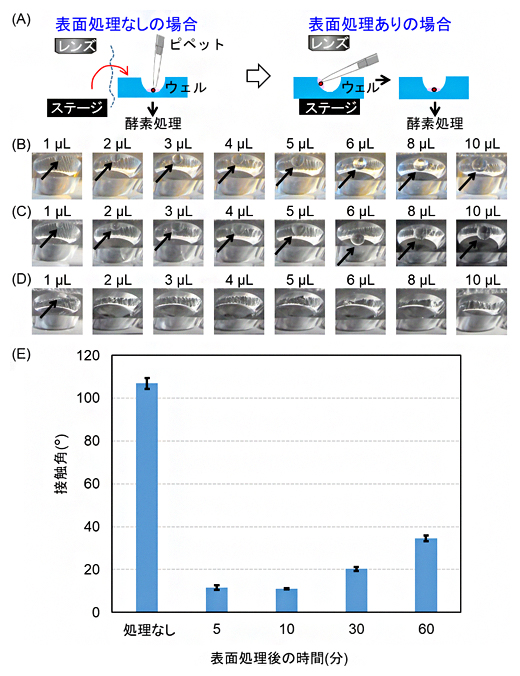
図2 表面処理による濡れ性向上の目的とその実証・評価
- (A) ウェル壁面の表面処理効果の説明イラスト。表面処理なしの場合は、ウェルの壁面に液滴をつけても下に落ちないため、ウェルの底に届くようにピペットを立てる必要がある。表面処理をすると、ウェル壁面に少ない量の液滴をつけても底に落ちやすくなる。
- (B-D) 3種類の表面処理条件における、ウェル壁面への液滴滴下後の液滴の挙動(壁面に残るか底に落ちるか)。矢印が液滴を表す。(B)処理なしのPDMS、(C)フッ素コーティング剤による疎水処理したウェル、(D)BSAによる親水処理したウェル。(B)(C)では、液適量を10μLにしても底に落ちなかったのに対し、(D)では2μLで底に落ちた。
- (E) BSA処理後の時間経過と接触角の関係。処理後10分は十分親水性が保たれた。なお接触角とは、固体表面と液体の濡れやすさ(濡れ性)における指標の一つで、数値が小さいほど濡れやすいことを示す。
次に、実際にこのデバイスを用いてどの程度の時間短縮効果があるか計測しました。従来法の場合は、培養皿を顕微鏡ステージ上に置いた状態からコロニーを探し、採取、容器の取り替え、ウェルへの滴下、確認までの一連の動作にかかる時間を測りました。デバイス使用の場合は、溝中のコロニーを探し、採取、隣のウェルへの滴下、確認するまでの一連の動作にかかる時間を測りました。被験者は経験5年以上の熟練者と経験1年以内の初心者で、従来法とデバイス使用それぞれ4回ずつ計測を行い、その平均操作時間を示したのが図3A、Bです。
その結果、コロニーの移し替え操作速度が熟練者の場合は1.5倍、初心者の場合は2.3倍程度向上することが分かりました。熟練者より初心者で効果が大きいのは、広い範囲からコロニーを見つけるという感覚や慣れなどの要素が削減され、機械的な操作のみで実験が行えるためと考えられます。
さらに、図3Cに示すように、本デバイスを使って採取したES細胞コロニーを利用して遺伝子改変マウス(黒色)が問題なく産出されることを確認しました。したがって、本デバイスを用いてもES細胞の多能性が阻害されることはないといえます。
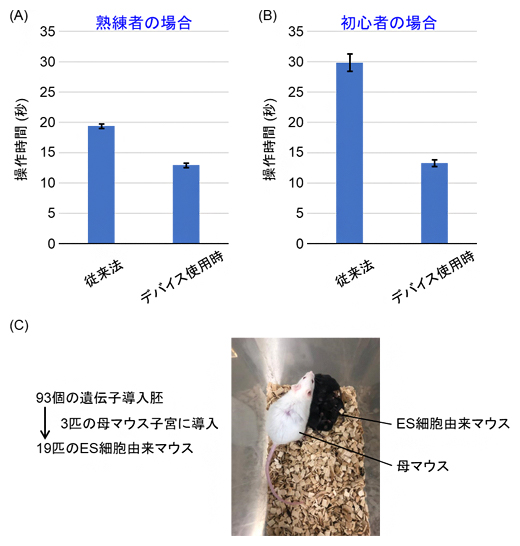
図3 デバイスの効果検証の実験結果
- (A)熟練者が操作した場合における、従来法とデバイス使用時の操作時間の違い(計測回数: 4回)。操作時間が従来法よりも約1.5倍短くなった。
- (B)初心者が操作した場合における、従来法とデバイス使用時の操作時間の違い(計測回数: 4回)。操作時間が従来法よりも約2.3倍短くなった。
- (C)本デバイスで扱ったES細胞コロニーを用いて遺伝子改変したマウス(毛が黒い小さいもの)と改変なしの母マウス(毛が白い大きいもの)の写真。本デバイスを使って採取したES細胞コロニーを利用して遺伝子改変マウス(黒色)が問題なく産出されることを確認した。
今後の期待
本研究では、遺伝子を改変した動物個体を作製するのに必要な操作の一部を簡便にし、ウェルの近傍に細胞操作用の溝を作るという、"痒いところに手が届く"を意識したデバイスを開発しました。
今回試作したデバイスは、ES細胞コロニーという50μm前後の比較的大きな生物試料を扱うのに特化したものですが、このサイズを自動で扱う装置はあまりありません。マイクロ流体デバイス[8]やセルソーターではコロニーがやや大きいために扱いにくく、またコロニーソーターというものもありますが、非常に高価です。今回、手作業で顕微鏡なしで扱えるものでもないという微妙なサイズにフォーカスしたことに意義があります。コロニー以外にも、卵細胞や胚などの比較的大きな試料を扱うのにも適しています。作業を単純化し、初心者でも使いやすいという意味で、研究自動化の一ステップとなるものです。
今後、大量生産を目指すにあたっては、容器の材質を、細胞培養などで最も一般的に用いられるポリスチレンに変えて試験していく必要があります。このような検討を行い、生物実験プラットフォームを最適化することで、生物学のさらなる加速化が期待できます。
補足説明
- 1.ES細胞
胚性幹細胞(embryonic stem cells)。動物の発生初期段階であり、将来胎児を形成する内部細胞塊から樹立された多能性幹細胞。ここでは、遺伝子を導入するための媒体として用いられる。 - 2.コロニー
細胞生物学にて細菌や培養細胞などが形成する単一細胞由来の細胞凝集塊。 - 3.CRISPR/Cas9、ゲノム編集技術
ゲノム編集技術は、特定のDNA配列を切断できる人工ヌクレアーゼによりゲノムDNAを切断して、ノックアウトやノックインなどの遺伝子改変を行う技術。CRISPR/Cas9は人工ヌクレアーゼの一つである。 - 4.セルソーター
細胞を小さい液滴の閉じ込め、染色した細胞の蛍光の大きさや波長などから、特定の細胞の分布を調べ、その細胞を分取する装置。 - 5.ポリジメチルシキロサン(PDMS)
高分子ゴム材料の一種。加工した鋳型にPDMSポリマーを流し込み加熱・硬化させることで鋳型の逆パターンとなる構造体を忠実に再現することが可能。PDMSはPolydimethylsiloxaneの略。 - 6.フッ素コーティング剤
強力に水や油をはじくフッ素系樹脂で、防水スプレーなどに利用される。 - 7.ウシ血清アルブミン(BSA)
ウシの血清から得られるタンパク質。生化学実験においてタンパク質の標準溶液に用いられ、他のタンパク質吸着のブロッキングなどにも用いられ、非常に親水性が高く、生体適合性が良い。BSAはBovine serum albuminの略。 - 8.マイクロ流体デバイス
数センチメートル角の基板上に幅・深さ1mm以下の流路を形成し、化学や生物実験のプロセスを集積化したもの。バイオ分野では細胞の操作や分析に用いられるが、扱える細胞のサイズに限界もある。
研究チーム
理化学研究所 生命機能科学研究センター
集積バイオデバイス研究チーム
チームリーダー 田中 陽(たなか よう)
研究員 船野 俊一(ふなの しゅんいち)
合成生物学研究チーム
チームリーダー 上田 泰己(うえだ ひろき)
研究員 戸根 大輔(とね だいすけ)
元上級研究員 鵜飼 英樹(うかい ひでき)
(現 東京大学 特任准教授)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「細胞の3次元パターニングによるオンチップ心臓創成(研究代表者:田中陽)」による支援を受けて行われました。
原論文情報
- Shun-ichi Funano, Daisuke Tone, Hideki Ukai, Hiroki R. Ueda & Yo Tanaka, "Rapid and easy-to-use ES cell manipulation device with a small groove near culturing wells", BMC Research Notes, 10.1186/s13104-020-05294-w
発表者
理化学研究所
生命機能科学研究センター 集積バイオデバイス研究チーム
チームリーダー 田中 陽(たなか よう)
研究員 船野 俊一(ふなの しゅんいち)
合成生物学研究チーム
チームリーダー 上田 泰己(うえだ ひろき)
研究員 戸根 大輔(とね だいすけ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
