理化学研究所(理研)生命機能科学研究センター網膜再生医療研究開発プロジェクトのアブラティ・モシャ研修生(臨床橋渡しプログラム[1]升本研究室研修生)、升本英利上級研究員(同研究リーダー)、集積バイオデバイス研究チームの田中陽チームリーダーらの共同研究グループは、ヒトiPS細胞[2]技術と微細加工によるマイクロデバイス[3]技術を用いて、高感度にヒト心臓の機能を評価する「ハートオンチップ[4]型マイクロデバイス」を開発しました。
本研究成果は、iPS細胞を用いた心臓の再生医療や創薬研究に貢献すると期待できます。
心臓病に対する再生医療や創薬研究においては、ヒトiPS細胞から人工的に作製された三次元的なヒト心臓組織の応用が期待されています。しかしこれまで、再現された人工心臓組織の機能を高感度に評価できる系は確立されていませんでした。
今回、共同研究グループは、ヒトiPS細胞から作製し、動的トレーニング培養[5]によって厚みを持たせた細胞シート状の三次元的なマイクロ心臓組織と、微細加工技術を用いたマイクロ流路による流体的な心臓機能の評価系を組み合わせることで「ハートオンチップ型マイクロデバイス」を開発し、これまでにない高感度な人工心臓の機能評価系を確立しました。
本研究は、科学雑誌『Scientific Reports』オンライン版(11月5日付)に掲載されます。
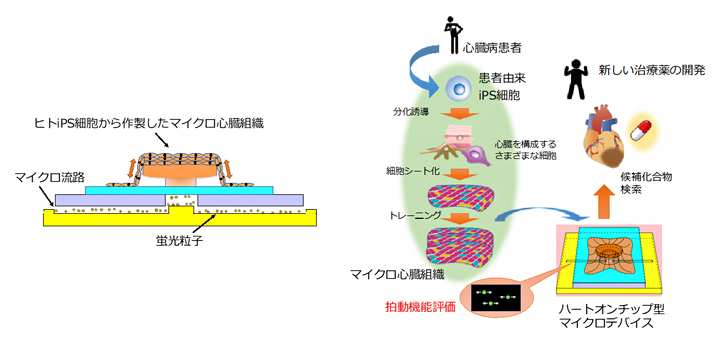
ハートオンチップ型マイクロデバイスの模式図(左)と創薬研究への応用イメージ図(右)
背景
心臓病は、世界的に死亡原因の多くを占めています注1)。特に進行した心不全では、既存の薬剤による治療効果は限られているため、有効な治療薬の開発が望まれています。また、心臓移植を必要とするような重症心不全では、細胞移植などの再生医療が新たな治療法として期待されています。
近年、ヒト人工多能性幹細胞(iPS細胞)から得られた心筋細胞を用い、心臓病に対する再生医療や創薬への応用を試みる研究が進んでいます。しかし、心臓の組織は心筋細胞だけでなく、血管細胞や繊維芽細胞など多種多様な細胞が三次元的に構築されて成り立っているため、心筋細胞のみを用いた方法では、実際の心臓の機能を再現することには限界があります。
共同研究グループの升本英利上級研究員らは、2017年に、心臓に含まれる多様な細胞(心筋細胞や血管を構成する細胞など)をヒトiPS細胞から誘導し、それらを含むヒト心筋組織の機能を模した細胞シート状の人工心臓組織の作製に成功しています注2)。この人工的なヒト心臓組織は、疾患により機能が損なわれた心臓に移植することで機能の回復を目指す、再生医療への応用が期待されます。また創薬分野においても、さまざまな候補化合物を投与してその反応を測定することで、心臓に対する薬効評価や副作用の検証を迅速に行える可能性があります。これらの応用研究を進めるためには、人工心臓組織の血液を送り出すポンプとしての機能を測定する系が必要となりますが、高感度に人工心臓組織の機能を測定する系はこれまで確立されていませんでした。
- 注1)2016年の全世界死因1位はIschaemic heart disease(虚血性心疾患)で、約940万人が亡くなっている。
WHO「The top 10 causes of death(24 May 2018)」 - 注2)Kawatou, M. et al. Modelling Torsade de Pointes arrhythmias in vitro in 3D human iPS cell-engineered heart tissue. Nat Commun 8, 1078, (2017).
研究手法と成果
共同研究グループは、微小な電気機械システムであるMicro Electro Mechanical Systems(MEMS)[3]を用いたオーガンオンチップ[4]技術により、マイクロ流路を含むマイクロ流体チップをデザインし、ヒトiPS細胞由来の人工心臓組織の微細な流体ポンプ機能の可視化を試みました。
マイクロ流体チップ上に装着する三次元的な心臓組織のもととなる細胞は、升本上級研究員らが2014年に開発したヒトiPS細胞からの効率的な分化誘導方法注3)によって得た、心臓を構成する多種の細胞を用いました。これらの細胞を温度感受性培養皿[6]で培養し、細胞シート状の人工心臓組織を形成させた後、1~2週間の動的トレーニング培養を行いました注4、5)。これにより、内部に血管網を持つ、厚み150~200マイクロメートル(μm、1μmは1,000分の1mm)程度の三次元的なマイクロ心臓組織を作製することに成功しました(図1)。
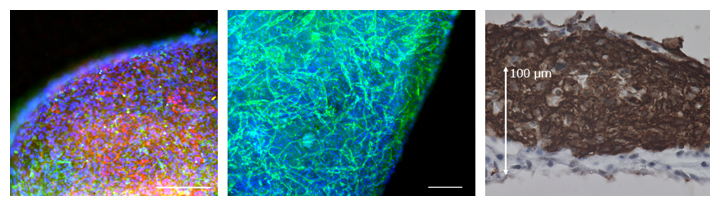
図1 動的トレーニング培養により得られたヒトiPS細胞からの三次元的なマイクロ心臓組織
- (左)心筋細胞(赤)および血管壁細胞(血管内皮をとりまく細胞;緑)。スケールバーは200μm。
- (中)血管内皮細胞(緑)。マイクロ心臓組織内に血管網が形成されている。スケールバーは200μm。
- (右)心筋層(茶)。マイクロ心臓組織は150μmを超える厚みを持つ。
- 注3)Masumoto, H. et al. Human iPS cell-engineered cardiac tissue sheets with cardiomyocytes and vascular cells for cardiac regeneration. Sci. Rep. 4, 6716, 2014.
- 注4)Jackman, C. P., Carlson, A. L. & Bursac, N. Dynamic culture yields engineered myocardium with near-adult functional output. Biomaterials 111, 66-79, 2016
- 注5)Gao, L. et al. Large Cardiac Muscle Patches Engineered From Human Induced-Pluripotent Stem Cell-Derived Cardiac Cells Improve Recovery From Myocardial Infarction in Swine. Circulation 137, 1712-1730, 2018
次に、MEMS技術により、シリコンの一種であるジメチルポリシロキサン(PDMS)を用いてマイクロ流路を作製し、さらにマイクロ心臓組織の拍動を伝えるための装置と組み合わせることで、微細な拍動を蛍光粒子の動きのパターンで可視化するためのマイクロ流体チップを開発しました(図2)。

図2 MEMS技術により作製したマイクロ流体チップ
中央の円形(直径4mm)は下部に直径2mmの凸部を持ち、マイクロ心臓を上に載せると、その拍動が下のマイクロ流路に伝えられる仕組み。白矢印は、蛍光粒子を流すマイクロ流路の流入側幅100μmの溝。
以上の準備を経て、マイクロ心臓組織をマイクロ流体チップに装着することにより、心臓組織機能を評価するためのOrgan-on-a-chipの一種である「ハートオンチップ(Heart-on-a-chip)型マイクロデバイス」を作製しました。このマイクロデバイスでは、マイクロ流路内の蛍光粒子の変位をモニタリングすることで、心臓組織の拍動の動態を可視化し、ポンプ流量・圧力・力などの生理的パラメータを定量化することができます(図3)。またこのマイクロデバイスは、これまでに報告されている心筋細胞シートの収縮力評価系と比べて2桁高い感度となる、0.01ミリニュートン(mN)以下の微小な力を検出できることも示されました。

図3 ハートオンチップ型マイクロデバイス
- (左)デバイスの模式図。
- (中)流路にて観察される蛍光粒子。
- (右)マイクロ心臓組織の拍動に応じた経時的な蛍光粒子の変位が観察された。
次に、作製したハートオンチップ型マイクロデバイスが実際の心臓機能を再現できているかを検証するため、心臓組織の基本的な特性である拍動の速さと拍動の強さの相関を調べました。その結果、拍動を起こさせるための外部電気刺激の周波数(拍動の速さ)と、その際に観察された蛍光粒子の移動距離や移動速度(変位量)との間に強い相関が示されました。この変位のパターンは、これまでに報告された心筋の収縮機能を評価するための画像評価システムと同様のパターンでした。
また、心臓の拍動は細胞内カルシウムイオン濃度と関係することが知られています。カルシウムイオンセンサータンパク質[7]の遺伝子を導入したiPS細胞から作製したマイクロ心臓組織を用いて、細胞内カルシウムイオンの濃度変化をビデオ撮影で観察したところ、カルシウムイオン濃度の振動と拍動の周波数に負の相関があることが分かりました。この相関は、ハートオンチップ型マイクロデバイスで拍動の速さを変化させた際の蛍光粒子の変位と同じパターンでした。このことから、ハートオンチップ型マイクロデバイスでは、カルシウムイオン濃度変化を伴う心筋細胞の活動が捉えられていることが示されました。さらに、ハートオンチップ型マイクロデバイスにβ-アドレナリン受容体[8]作動薬であるイソプロテレノール[8]を作用させたところ、濃度依存的に拍動速度が上昇することが蛍光粒子変位の観察から示されました。
以上の結果から、開発したハートオンチップ型マイクロデバイスが、拍動の速さや強さ、細胞内カルシウムイオン濃度、薬理学的反応などにおいて、実際の心臓機能を十分に再現していることが示されました。
今後の期待
今回開発したハートオンチップ型マイクロデバイスは、創薬や心臓毒性試験のための高感度バイオアッセイ系や、再生医療用のヒトiPS細胞由来の人工心臓組織の機能評価系としての医療応用が期待できます。
抗がん剤などの一部の薬剤は、心臓に対する副作用に個人差があることが知られています。患者個人の血液細胞などから樹立したiPS細胞を用いて、ハートオンチップ型マイクロデバイスを作製すれば、実際の投与前に薬剤の心臓への毒性を調べる「オーダーメード心臓毒性試験」を行うことができ、より安全な投薬治療につながると考えられます。
また、心臓病患者の細胞から樹立したiPS細胞を用いてマイクロデバイスを作製し、さまざまな化合物を投与して反応を調べることは、これまで有効な治療薬がなかった心臓の難病に対する新たな治療薬を発見すること(創薬)に役立つと期待できます。
補足説明
- 1.臨床橋渡しプログラム
理研生命機能科学研究センター独自の研究プログラム。臨床医としての知識・経験を有する研究リーダーが、生命機能科学研究センターでの最先端研究と臨床現場でのニーズの融合から、疾病の理解や再生医療への実用化を目指す。 - 2.iPS細胞
皮膚や血液などから採取した細胞に、少数の遺伝子などを導入して作製された多能性幹細胞。iPSはinduced Pluripotent Stemの略。 - 3.マイクロデバイス、Micro Electro Mechanical Systems(MEMS)
マイクロデバイスは、マイクロメートルサイズの部品で構成される極小デバイスのこと。特に、機械要素部品、センサ、アクチュエータ、電子回路などを一つのシリコン基板、ガラス基板、有機材料などの上に、微細加工技術によって集積化したデバイスをMicro Electro Mechanical Systems(MEMS、メムス)と呼び、DNAや生体試料などのナノ・マイクロメートルの物質を操作・分析するツールとしても用いられる。 - 4.ハートオンチップ、オーガンオンチップ
オーガンオンチップ(Organ-on-a-chip)はマイクロリアクターの一種で、チップ上にMEMS技術を利用してジメチルポリシロキサンなどの高分子有機ケイ素化合物などによるマイクロ流路などを構成し、臓器の培養細胞を組み合わせることにより、臓器機能を再現する新しいコンセプトであり、バイオアッセイ系の構築に応用される。従来の人工臓器では再現できなかった生体の機能を再現することが可能で、動物実験の代替の選択肢としても近年開発が進みつつある。生体機能チップとも呼ばれる。本研究では、心臓機能を再現したオーガンオンチップをハートオンチップ(Heart-on-a-chip)と名付けた。 - 5.動的トレーニング培養
分化させた心筋細胞を親水性ゲルで束状に型取った後、振盪(しんとう)培養することで成熟した心筋組織を得る手法。 - 6.温度感受性培養皿
東京女子医科大学の岡野光夫、清水達也らにより開発された細胞シート回収技術。独自のナノ表面設計により、温度応答性ポリマー(PIPAAm)を培養皿表面に固定(共有結合)している。この温度応答性ポリマーは、32℃以上で疎水性、32℃以下で親水性になるため、培養後32℃以下にすればトリプシン処理を行うことなく、細胞生存に必要な細胞外マトリックスを保持したまま(細胞シートのまま)回収できる。 - 7.カルシウムイオンセンサータンパク質
カルシウムイオン濃度変化の検出に用いられるタンパク質。本研究では、埼玉大学の中井淳一、大倉正道らにより開発された、緑色蛍光タンパク質(EGFP)、カルモジュリン(CaM)、ミオシン軽鎖フラグメント(M13)を遺伝子工学的に結合させたGCaMPを用いた。カルシウムイオンがカルモジュリンと結合すると、Ca2+/CaM複合体がM13と相互作用しEGFPの立体構造を変化させることで、蛍光強度が変化する。これにより、カルシウムイオン濃度の変化をGCaMP蛍光強度の変化として検出できる。遺伝子に組み込むことができるため、目的の細胞や組織においてカルシウムイメージングが可能である。 - 8.β-アドレナリン受容体、イソプロテレノール
β-アドレナリン受容体は平滑筋や心筋に発現し、心筋の収縮作用を持つ。イソプレテレノールは心臓のβ-アドレナリン受容体を刺激して、拍動を増加させる作用を持つ薬剤。
共同研究グループ
理化学研究所 生命機能科学研究センター
網膜再生医療研究開発プロジェクト(臨床橋渡しプログラム・升本研究室)
上級研究員・研究リーダー 升本 英利(ますもと ひでとし)
研修生 アブラティ・モシャ(Mosha Abulaiti)
客員研究員 村田 梢(むらた こずえ)
テクニカルスタッフ 佐々木 裕子(ささき ゆうこ)
研修生(研究当時) 藤原 靖恵(ふじわら やすえ)
集積バイオデバイス研究チーム
チームリーダー 田中 陽(たなか よう)
客員研究員 ヤリクン・ヤシャイラ(Yaxiaer Yalikun)
テクニカルスタッフ 佐藤 麻子(さとう あさこ)
形態形成シグナル研究チーム
テクニカルスタッフ サミ・ムスタファ(Mustafa M. Sami)
京都大学 医学部 心臓血管外科
教授 湊谷 謙司(みなと やけんじ)
信州大学 医学部 再生医科学教室・バイオメディカル研究所
教授 柴 祐司(しば ゆうじ)
研究支援
本研究は、日本医療研究開発機構(AMED)「未来医療を実現する医療機器・システム研究開発事業(分担研究者:升本英利)」、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「細胞の3次元パターニングによるオンチップ心臓創成(代表研究者:田中陽)」、理研生命機能科学研究センター・オルガノイドプロジェクト(代表研究者:升本英利、田中陽)による支援を受けて行われました。
原論文情報
- Mosha Abulaiti, Yaxiaer Yalikun, Kozue Murata, Asako Sato, Mustafa M. Sami, Yuko Sasaki, Yasue Fujiwara, Kenji Minatoya, Yuji Shiba, Yo Tanaka, Hidetoshi Masumoto*(*責任著者), "Establishment of a heart-on-a-chip microdevice based on human iPS cells for the evaluation of human heart tissue function", Scientific Reports, 10.1038/s41598-020-76062-w
発表者
理化学研究所
生命機能科学研究センター 網膜再生医療研究開発プロジェクト
臨床橋渡しプログラム・升本研究室
上級研究員・研究リーダー 升本 英利(ますもと ひでとし)
研修生 アブラティ・モシャ(Mosha Abulaiti)
集積バイオデバイス研究チーム
チームリーダー 田中 陽(たなか よう)
 升本 英利
升本 英利
 アブラティ・モシャ
アブラティ・モシャ
 田中 陽
田中 陽
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
