理化学研究所(理研)生命機能科学研究センター 一細胞質量分析研究チームの川井隆之研究員(現 客員研究員)、先端バイオイメージング研究チームの渡邉朋信チームリーダー(広島大学原爆放射線医科学研究所教授)らの共同研究グループは、次世代中分子医薬品[1]として期待されている環状ペプチド[2]の細胞膜透過性を、がん細胞1個から正確に評価できる新手法を開発しました。
本研究成果は、これまで直接的な評価が難しかった細胞内部の分子を標的とした中分子薬剤の開発に大きく貢献すると期待できます。
今回、共同研究グループは、乳がん細胞(MCF-7細胞)をシクロスポリンA(CsA)[3]などの環状ペプチドとともに培養した後、マイクロニードルを用いて細胞1個から細胞質のみを吸い取り、そこに含まれる環状ペプチドを高感度に計測する「一細胞細胞質質量分析(SCC-MS)法[4]」を開発しました。SCC-MS法は、1ピコリットル(1兆分の1リットル)以下の細胞質サンプルに含まれる約100ナノモルnmol/L(1000万分の1モル/L)以上の濃度の環状ペプチドを測定できます。この技術を用いて、これまで解析が難しかった細胞質中の薬剤濃度の時間変化を追跡し、環状ペプチドの細胞膜透過性と細胞内濃度を同時に評価することに成功しました。
本研究は、科学雑誌『Analytical Chemistry』オンライン版(2月6日付)に掲載されます。
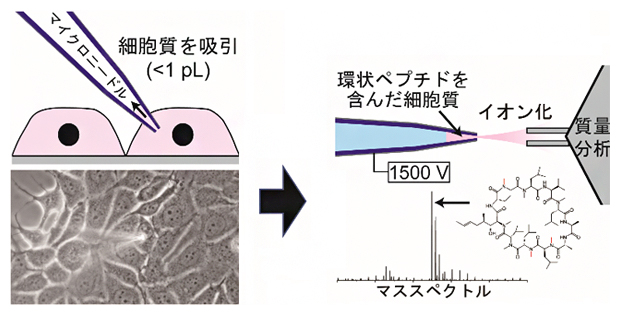
1個の細胞から細胞質のみ抜き取り、環状ペプチドの膜透過性と細胞内濃度を高感度に測定
背景
分子量が500~2000程度の環状ペプチドは中分子薬剤と呼ばれ、低分子薬剤と同じように細胞内へ浸透させることが可能です。また高分子薬剤(抗体医薬品)同様に特定の分子と特異的に結合させられることから、細胞内部の病変分子を標的とする次世代治療プラットフォームとして期待されています。
細胞内部の分子を標的とするには、環状ペプチドが細胞膜を透過して内部へと浸透する必要があります。しかし、環状ペプチドがどれくらい細胞膜を透過して内部に侵入したかを測定する手法は存在しませんでした。単純に膜を透過する速度を評価する方法として、しばしば脂質人工膜を用いた膜透過性試験[5]が用いられてきました。しかし、人工膜と実際の細胞膜では、環状ペプチドの膜透過性が大きく異なる場合が少なくありません。LLC-PK1細胞[6]やCaco-2細胞[6]などを培養して細胞シートを作製し、これを人工膜の代わりに用いた細胞シート透過性試験も頻繁に用いられる手法です。しかし細胞内部だけでなく細胞膜やタイトジャンクション[7]を透過する量まで計測されてしまうため、実際に細胞質部分に存在する環状ペプチドの量を測定できませんでした。
したがって、細胞から細胞質だけを採取して、そこに含まれる環状ペプチドを測定する方法が必要です。細胞質を分ける代表的な手法として、細胞を破砕し、超遠心分離機を用いて細胞小器官を比重の順番で分画する技術が挙げられます。しかしこの技術では、各小器官がダメージを受けて環状ペプチドが漏れ出て細胞質と混ざってしまい、細胞質に含まれる環状ペプチドだけを正確に回収することができませんでした。
研究手法と成果
共同研究グループは、確実に細胞質だけを採取するため、顕微鏡で細胞を観察しながらガラス製マイクロニードルを用いて一つ一つの細胞から細胞質を吸引する技術を開発しました。そして、この採取に使ったニードルをそのまま用いてエレクトロスプレーイオン化(ESI)法[8]で環状ペプチドをイオン化し、質量分析(MS)[9]で解析することでペプチド濃度を計測する、「一細胞細胞質質量分析(SCC-MS)法」を開発しました(図1)。
SCC-MS法では、細胞を環状ペプチドとともに培養した時間に対して、検出された環状ペプチドのシグナル強度をプロットし、新たに考察した理論式に当てはめることで、細胞膜透過性を算出します。また、環状ペプチド標品を用いた分析結果と比較して、細胞内部の環状ペプチド濃度を計算します。これにより、細胞の外側から内側への膜透過性、内側から外側への膜透過性、そして細胞内部での薬剤濃度を計測できます(図1)。
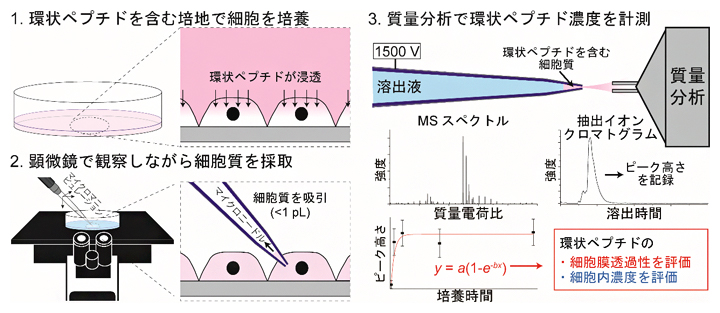
図1 SCC-MS法を用いた細胞内環状ペプチドの計測と細胞膜透過性評価方法
- 1.環状ペプチドを含む培地で細胞を培養し、細胞に環状ペプチドを浸透させる。
- 2.顕微鏡で観察しながら、マイクロニードルで1pL(1兆分の1リットル)以下の細胞質を吸引・採取する。
- 3.2で使ったニードルをそのまま用いて環状ペプチドをイオン化し、質量分析で解析することで、環状ペプチドの細胞膜透過性と細胞内濃度を評価する。
本研究では、細胞膜透過性が高い環状ペプチドであるシクロスポリンA(CsA)とその脱メチル体(dmCsA)3種類に注目しました(図2)。CsAは極性の低いメチル基を含むため、細胞膜の主成分である脂質と親和性が高いことが知られています。一方、CsAのメチル基が脱離すると、極性が上昇して細胞膜透過性が大きく減少します。このように、CsAの高い細胞膜透過性はデリケートな分子構造に依存していることが示唆されています。薬効の高い中分子薬剤の開発にはその細胞膜透過性を高めることが必要であり、分子構造の違いが細胞膜透過性に与える影響を評価することは極めて重要です。
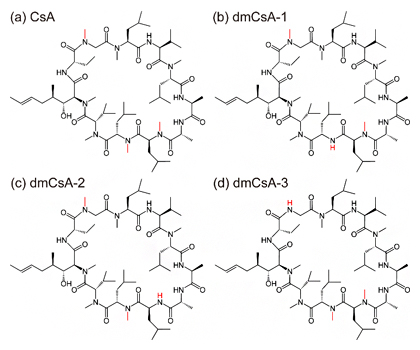
図2 本実験に用いた四つの環状ペプチドの構造式
- (a)膜浸透性が高い環状ペプチドのシクロスポリンA(CsA)。脱メチル化の対象となった部位を赤色で示す。
- (b-d)(a)のCsAの3種類の脱メチル体(dmCsA-1~3)。CsAに比べて膜浸透性が大きく減少する。
まず、50マイクロモル/L(μmol/L、1μmol/Lは100万分の1モル/リットル)の濃度で環状ペプチドを添加した各培養液で、乳がん細胞(MCF-7細胞)を3~1440分(24時間)培養しました。次に、マイクロマニピュレーターを用いてマイクロニードルを操作しながら、細胞内部に針先を挿入し、細胞質のみを採取しました(図3)。最後に、SCC-MS法で細胞質へ浸透した環状ペプチドを測定しました。
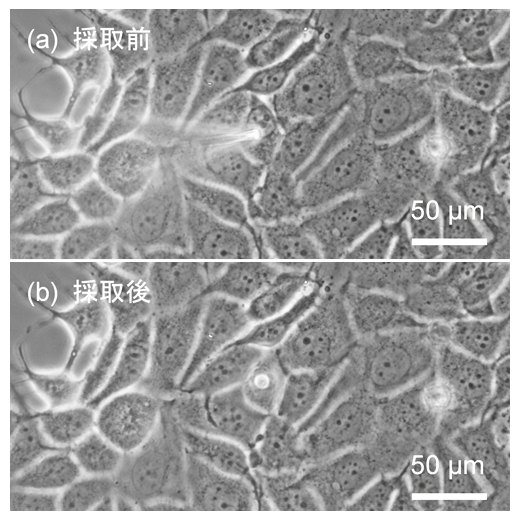
図3 乳がん細胞(MCF-7細胞)からの細胞質採取の様子
- (a)マイクロニードルを細胞に接近させている様子。マイクロニードルを動かし、細胞内部に挿入し、細胞質のみを吸引する。
- (b)細胞質を採取した後の細胞の様子。針を挿入した際にできた穴が見えるが、細胞の大きさがほとんど変わらないほど微量の採取であることが分かる。
まず、それぞれの環状ペプチドで10分間培養した細胞から採取した細胞質を計測しました。図4(a-d)は各サンプルのMSスペクトルを示します。環状ペプチドは主にナトリウム(Na)が付加した形で検出されました。この質量電荷比(m/z)±0.1の抽出イオンクロマトグラム(XIC)[10]を描くと、図4(e-h)に示すような溶出挙動が確認されました。得られるピークの高さはサンプルに含まれる環状ペプチド濃度に比例します。この方法によって、1ピコリットル(1兆分の1リットル)以下の細胞質サンプルに含まれる、約100ナノモル/L(1000万分の1モル/L)以上の濃度の環状ペプチドを測定することができました。
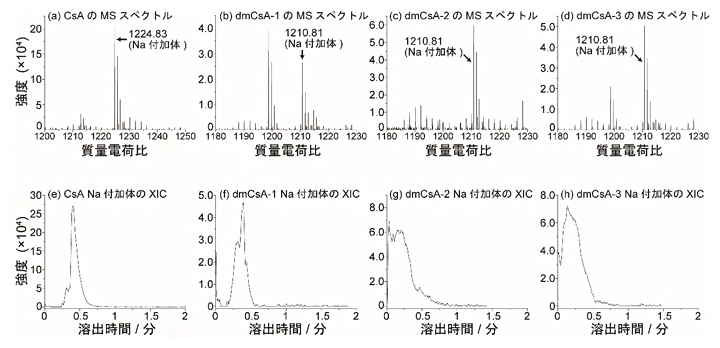
図4 10分間培養したMCF-7細胞のSCC-MS分析結果
50μmol/Lの環状ペプチドを含む培地で10分間培養したMCF-7細胞のSCC-MS分析結果。(a-d)はMSスペクトルを示し、(e-f)はそのNa(ナトリウム)付加体のm/z±0.1の抽出イオンクロマトグラム(XIC)を示す。
続いて、3~1440分と長い範囲で培養時間を変化させ、それぞれの時間に対して得られたXICのピーク高さを培養時間に対してプロットしました。得られた結果をモデル関数 y = a (1-e-bx)でフィッティングした結果を図5に示します。培養時間が長くなるにつれてピーク高さは上昇し、一定時間が経過すると高い値で止まります。これは培養液から細胞内へ環状ペプチドが浸透し、最終的に細胞内への浸透速度と細胞外への排出速度が釣り合ったことを意味しています。モデル関数へのフィッティングにより得られたaとbの値と理論式[11]を比較することで、環状ペプチドの膜透過性と細胞内濃度を算出できます。
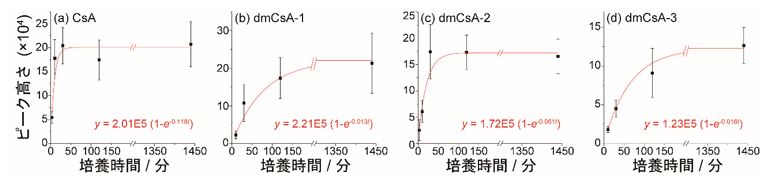
図5 3~1440分間培養したMCF-7細胞のSCC-MS分析結果
50μmol/Lの環状ペプチドを含む培地で3~1440分間培養したMCF-7細胞のSCC-MS分析結果。図4(e-h)のように、XICで得られたピークの高さを培養時間に対してプロットし、モデル関数y = a(1-e-bx)にフィッティングし、得られたaとbの値と理論式を比較することで、環状ペプチドの膜透過性と細胞内濃度を算出できる。
この結果から、浸透係数[12]は細胞外から内部へは0.017~0.121、細胞内から外部へは0.20~1.48であることが分かりました。外部への浸透係数の方が高いのは、CsAの受容体であるP糖タンパク質[13]が薬剤排出トランスポーターとして作用しているからだと考えられます。定常状態における細胞内環状ペプチド濃度は4.1~6.8μmol/Lと添加濃度の10分の1程度であり、薬剤排出トランスポーターにより、浸透した環状ペプチドが効率的に排出されていることを示しています。
これまでの分析手法で測定されたCsAの細胞内濃度は、細胞膜も含めた細胞全体の測定値であるため、培地へのCsA投与濃度よりも高い濃度として報告されていました。これはCsAがP糖タンパク質のリガンド[14]であり、効率的に細胞外へ排出されるという予想と矛盾していました。蛍光標識したCsAは細胞膜に多く存在することが報告されており、上記の報告も、細胞膜を含めて測定してしまったことで過大評価になっていたと推定されます。一方で本手法は、細胞質だけを狙って吸い取り、高感度に環状ペプチドを検出することで、細胞外排出メカニズムに矛盾しない細胞質内の薬剤濃度と膜透過性を測定することに初めて成功しました。
今後の期待
今回、1細胞という極微量の生体試料から細胞質のみを吸い取り、質量分析装置で測定することで、細胞質のみに含まれる環状ペプチドを測定できることを実証しました。これまでの手法では細胞質だけでなく細胞膜も一緒に採取されてしまうため、細胞内の薬剤濃度が過大に定量されていました。今回開発したSCC-MS法を用いることで、細胞質のみに存在する薬剤濃度と膜透過性を評価することに初めて成功しました。
今後、本手法を自動化してハイスループット化することで、細胞内部の病変分子を標的とした中分子創薬を大きく加速できるものと期待できます。
補足説明
- 1.中分子医薬品
ペプチドや核酸などを用いた、分子量が500~2000程度で、低分子医薬品と高分子医薬品の長所(膜透過性と標的選択性)を併せ持つ薬剤の総称。 - 2.環状ペプチド
いくつかのアミノ酸が環状に重合したペプチド。環状骨格によって分子構造が安定するため、一般的な鎖状ペプチドより標的分子に結合しやすく、細胞膜を透過しやすい。また、プロテアーゼ(ペプチド結合の加水分解酵素)のターゲットになりにくく、血中滞留性が良い。 - 3.シクロスポリンA(CsA)
11個のアミノ酸が環状に結合した環状ペプチドの一種。分子量が1,200を超えるにもかかわらず膜透過性が極めて高く、免疫抑制剤として広く利用されている。 - 4.一細胞細胞質質量分析(SCC-MS)法
ガラス製のマイクロニードルで単一細胞から細胞質だけを吸引し、その針をそのまま用いて試料を質量分析で測定する手法。従来では難しかった、細胞質に含まれる環状ペプチドの量を測定できる。SCC-MSはSingle-Cell Cytoplasm Mass Spectrometryの略。 - 5.膜透過性試験
薬剤を含む溶液と含まない溶液の2種類を、脂質人工膜や細胞シートで隔てて、どれくらいの量の薬剤が膜を透過して反対側へと移動するかを測定する手法。主に低分子薬剤が経口で投与できるかを判断するために開発されたが、細胞内部にどれくらい浸透するかを測定するには不向きであった。 - 6.LLC-PK1細胞、Caco-2細胞
LLC-PK1細胞はブタ腎臓由来、Caco-2細胞はヒト結腸がん由来の細胞。比較的容易にシート状に培養でき、膜透過性を評価するためのモデルとして幅広く利用されている。 - 7.タイトジャンクション
隣り合う細胞同士をつなぎ、分子が通過できないようにする細胞間結合。 - 8.エレクトロスプレーイオン化(ESI)法
ニードルに高電圧をかけた状態で試料を吐出すると、帯電した液滴が霧状に噴出され(エレクトロスプレー)、最終的に試料に含まれる分子に主にプロトン(H+)が付加されてイオン化される手法。初期液滴が小さい程イオン化の効率が向上することから、ニードルの先端径を小さくすることで高感度化できる。ESI はElectroSpray Ionizationの略。 - 9.質量分析(MS)
試料に含まれる分子の分子量を測定する装置。試料をイオン化して高真空の装置内部に導入し、そのイオン化分子の質量ごとに電磁気的に分離して検出する。横軸に質量電荷比(分子量÷電荷の数)、縦軸に強度をプロットしたMSスペクトルが得られる。MSはMass Spectrometryの略。 - 10.抽出イオンクロマトグラム(XIC)
経時的にMS分析を行う際、MSスペクトルが連続して得られる。各MSスペクトルの中で、目的化合物と一致する質量電荷比(m/z)のシグナル強度を時間に対してプロットしたもの。目的化合物以外の夾雑成分由来のシグナルを除外できるため、高感度に目的化合物を検出できる。XICはeXtracted Ion Chromatogramの略。 - 11.理論式
ここでPapp,infは細胞外から内部への見かけの浸透係数[12]、Papp,effは細胞内部から外部への見かけの浸透係数、kは環状ペプチドのSCC-MS分析における検量線の傾き、C0は添加薬剤濃度、Dは細胞の厚み。したがって、フィッティングに用いたモデル関数のaとbを上記式と比較することで、Papp,infとPapp,eff(単位: 10-6cm/s)を算出することができる(k、Dは別の実験で算出した)。
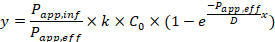
- 12.浸透係数(Papp)
薬剤の膜透過性を評価する際に一般的に用いられる指標。単位時間当たりに薬剤が膜を透過してどれくらいの長さ浸透できるかを表す。単位はcm/sが一般的。 - 13.P糖タンパク質
粘膜や上皮細胞に発現している、薬物などを細胞外へ排出するABCトランスポータータンパク質の一種。 - 14.リガンド
受容体に結合する低分子化合物や抗体、ペプチドなどのこと。
共同研究グループ
理化学研究所 生命機能科学研究センター
一細胞質量分析研究チーム
研究員 (研究当時) 川井 隆之(かわい たかゆき)
(現九州大学 大学院理学研究院 准教授、理化学研究所 客員研究員)
研究パートタイマー 森田 牧子(もりた まきこ)
先端バイオイメージング研究チーム
チームリーダー 渡邉 朋信(わたなべ とものぶ)
(広島大学 原爆放射線医科学研究所 教授)
大正製薬株式会社 医薬研究本部
Discovery研究所 化学第2研究室
主任研究員 御原 康洋(みはら やすひろ)
安全性動態研究所 薬物動態研究室
主任研究員補 大久保 雅彦(おおくぼ まさひこ)
Discovery研究所化学 第1研究室
室長 浅見 泰司(あさみ たいじ)
研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「超高感度CE-MS分析システムによる極微量プロテオーム解析(研究代表者: 川井隆之)」などによる支援を受けて行われました。
原論文情報
- Takayuki Kawai, Yasuhiro Mihara, Makiko Morita, Masahiko Ohkubo, Taiji Asami, and Tomonobu M. Watanabe, "Quantitation of Cell Membrane Permeability of Cyclic Peptides by Single-Cell Cytoplasm Mass Spectrometry", Analytical Chemistry, 10.1021/acs.analchem.0c03901
発表者
理化学研究所
生命機能科学研究センター 一細胞質量分析研究チーム
研究員(研究当時) 川井 隆之(かわい たかゆき)
(現 客員研究員)
先端バイオイメージング研究チーム
チームリーダー 渡邉 朋信(わたなべ とものぶ)
(広島大学 原爆放射線医科学研究所 教授)
 川井 隆之
川井 隆之
 渡邉 朋信
渡邉 朋信
報道担当
理化学研究所 生命機能科学研究センター センター長室 報道担当
川野 武弘(かわの たけひろ)
Email: tkawano [at] riken.jp
理化学研究所 広報室 報道担当
お問い合わせフォーム
広島大学 財務・総務室 広報部広報グループ
Email: koho [at] office.hiroshima-u.ac.jp
※上記の[at]は@に置き換えてください。
