理化学研究所(理研)脳神経科学研究センター神経細胞動態研究チームの武藤悦子上級研究員、鮎川理恵テクニカルスタッフ、中央大学理工学部生命科学科の上村慎治教授、今井洋助教(研究当時)らの国際共同研究グループは、「微小管」の形成(核生成[1])には、初めにタンパク質チューブリンが数個つながった直線状のオリゴマーが作られる必要があることを発見しました。
本研究成果は、微小管ダイナミクス制御の一端を明らかにするもので、微小管の制御異常が関与する神経変性疾患[2]の病態解明や、チューブリンを標的とする抗がん剤の開発に貢献すると期待できます。
細胞の形態形成や染色体分離には、細胞骨格[3]である微小管の長さや本数が正確に制御される必要があります。そのため、細胞内のさまざまなタンパク質が微小管の新生、伸長、短縮の過程を調節していますが、新しい微小管ができるごく初期の反応である核生成のメカニズムはこれまで謎に包まれていました。
今回、国際共同研究グループは、独自に開発した組換え体チューブリンの技術[4]を用いてチューブリン変異体を作製し、微小管への遷移状態である1本鎖チューブリンオリゴマーのサイズや形態を系統的に調べました。その結果、オリゴマーの大多数は曲線状であり成長しないのに対し、稀にできるごく少数の直線状オリゴマーだけが微小管にまで成長できることを明らかにしました。
本研究は、科学雑誌『Journal of Cell Biology』のオンライン版(2月5日付:日本時間2月6日)に掲載されました。
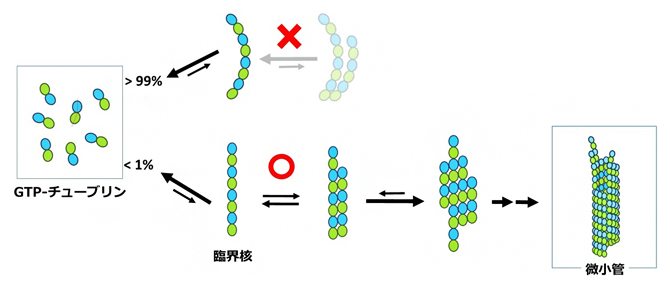
ごく少数の直線状チューブリンオリゴマーだけが、微小管になることができる
背景
「微小管」は真核生物の主要な細胞骨格の一つで、タンパク質のαチューブリンとβチューブリンがつながったダイマー(二量体)を基本構成単位とする、管状の構造体です。微小管は、細胞の形態形成や染色体分離に重要な役割を果たしています。微小管の伸長や短縮は、チューブリンが結合するヌクレオチドによって制御されており、グアノシン三リン酸(GTP)が結合したGTPチューブリンは重合して微小管を作りますが、GTPが分解されてグアノシン二リン酸(GDP)になると微小管は脱重合してダイマーに戻ります。このような微小管の挙動のうち、成長と縮小についてはこれまでよく研究されてきましたが、最初に起こる微小管が生まれる過程(核生成)についてはほとんど分かっていませんでした。
溶液中のGTPチューブリンのダイマーは曲がって結合しているのに対し、微小管の中では直線状に結合しています(図1)。したがって、チューブリンから微小管ができる際、チューブリンは曲線状から直線状に変化するはずです。その変化は微小管ができる前に起こるのか、微小管が作られる過程で起こるのか、長く議論されてきました。微小管になる途中でチューブリンダイマーは数個つながってオリゴマーと呼ばれる中間体になりますが、直線状のオリゴマーが探してもなかなか見つからなかったことから、最近では、チューブリンは微小管に組み込まれた「結果」、直線状になるのだろうと考えられていました。
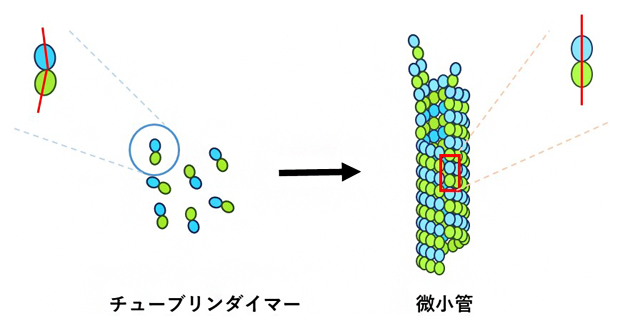
図1 チューブリンダイマーと微小管の構造
微小管はαチューブリンとβチューブリンからなるチューブリンダイマーを構成単位としており、微小管になる前のダイマーではαとβが曲がって結合しているが、微小管中では直線状に結合している。
研究手法と成果
国際共同研究グループはまず、世界にさきがけて独自に開発した組換え体チューブリンの技術を利用して、βチューブリンのGTP結合サイト近くにある222番目のアミノ酸のチロシン(Y)をフェニルアラニン(F)に置換して、野生型よりも重合しやすくした変異体(β-Y222F)を作製しました。この変異体とαチューブリン、GTPを混合した溶液を37℃にすると、重合反応が始まります。実験の結果、野生型チューブリンでは重合反応開始後10分以上経たないと微小管ができないのに対し、変異体チューブリンでは微小管生成が大きく加速し、反応開始直後から溶液中には多数の微小管が形成されることが分かりました(図2)。
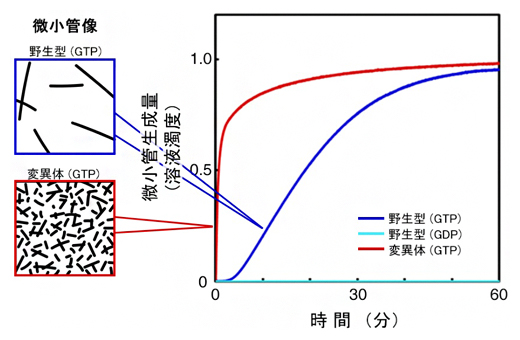
図2 微小管の生成速度
野生型と変異体における微小管の生成速度。変異体GTPチューブリンでは、野生型GTPチューブリンよりもずっと速く微小管が生成され、反応開始直後から多数の微小管が見られた。野生型GDPチューブリンでは微小管は生成されない。
また、ネガティブ染色電子顕微鏡法[5]を用いて、変異体と野生型のオリゴマーを観察しました。これまでの研究では、重合中の試料を電子顕微鏡で観察できませんでしたが、ラピッドフラッシュ法[6]により重合計測に用いた試料を瞬時に希釈して電子顕微鏡観察用に調整したことで、重合中の微小管と共存するオリゴマーの画像を捉えることに成功しました。
その結果、変異体では直線状GTPオリゴマーの割合が野生型のGTPオリゴマーに比べて高く、一方、微小管を作れないGDPを結合した野生型では、直線状オリゴマーは見つかりませんでした。直線状オリゴマーの出現頻度と微小管生成速度の間に相関関係があることから、直線状オリゴマーの形成が微小管生成の第一段階であると考えられました(図3)。
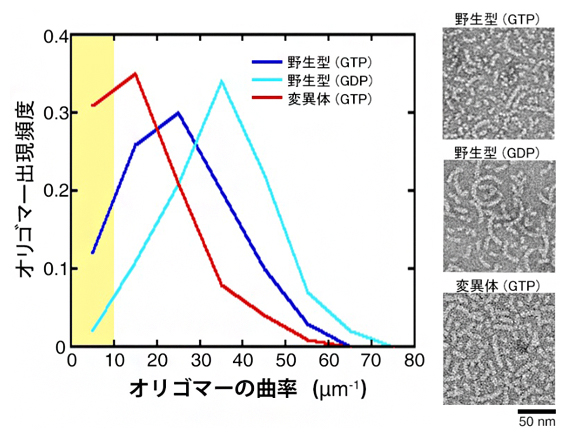
図3 チューブリンオリゴマーの曲率(左)と電子顕微鏡画像(右)
- 左:チューブリンオリゴマーの曲率分布。 直線状オリゴマーは黄色ハイライトの部分にあたる。その頻度は、変異体(GTP)、 野生型(GTP)、野生型(GDP) の順に多かった。
- 右:オリゴマーの電子顕微鏡像。変異体(GTP)では直線状のオリゴマーが多く見られるのに対し、野生型(GTP)、野生型(GDP)では曲線状のオリゴマーが多く見られる。
さらに、変異体では、多数の1本鎖オリゴマーに混じって稀に複数のオリゴマーが束ねられた「複鎖オリゴマー」が見つかりました(図4A-J)。1本鎖と2本鎖のオリゴマーの長さを比べたところ、直線状の1本鎖オリゴマーは、チューブリンが12個つながったドデカマーを超えると2本鎖を作り(図4K, L)、縦方向と側面の両方に成長し続けることが分かりました。重合の速度論的解析や熱力学的解析の結果も、1本鎖オリゴマーがドデカマーに達すると側面方向に集まって、成長を続けることを裏付けました。
これまでの研究では、チューブリンは微小管が作られた「結果」、直線状になると考えられてきましたが、本研究はこれまでの常識とは逆に、直線状になることが微小管生成の「原因」であることを明らかにしました。組換え体チューブリン、ラピッドフラッシュ電子顕微鏡法、臨界核のモデル計算など、イノベーションを組み合わせることによって、これまで手付かずであった、微小管核生成の基本的機構が明らかになりました。
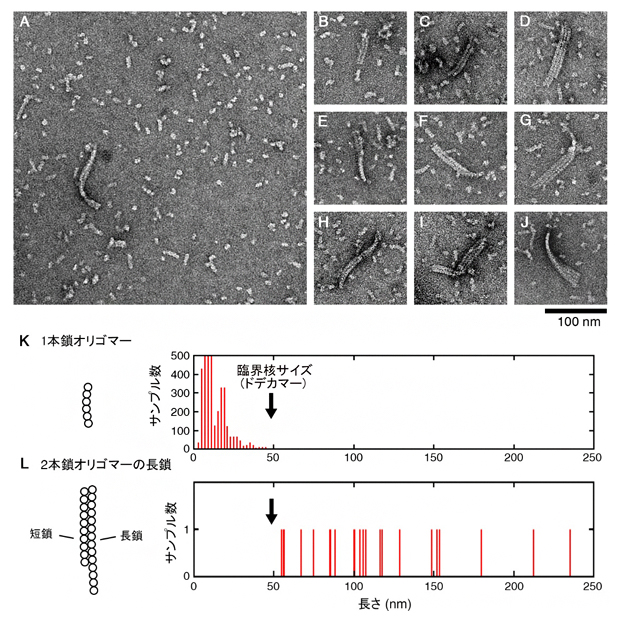
図4 変異体で見つかった複鎖オリゴマー
- A-J:観察された変異体の複鎖オリゴマーの電子顕微鏡像。複数(2~4本)のオリゴマーが束ねられている。
- K:1本鎖オリゴマーの長さ分布。1本鎖オリゴマーの大半は50nm(1nmは10億分の1メートル)より短かった。
- L:2本鎖オリゴマーの長鎖の長さ分布。長鎖はどれも50nmより長かったことから、一定のサイズ(ドデカマー)を超えると2本鎖を作ることが分かった。
今後の期待
微小管ダイナミクスの分子メカニズムについて、これまでの研究ではもっぱら微小管の挙動に注意が向けられてきましたが、本研究によりチューブリンと微視的集合体のダイナミクスの世界に扉が開かれました。
試験管内だけではなく、細胞内の微小管生成においても直線状オリゴマーの生成を誘導することが重要と考えられ、核生成を促進するさまざまな制御タンパク質がオリゴマーの曲率[7]にどのように影響しているか、今後の研究が待たれます。
また、抗がん剤のタキソール[8]は直線的なオリゴマーを安定化することで知られており、今後は、本研究で開発した技術や知見を生かし、薬剤耐性を獲得したがんに対して有効な新しい抗がん剤の開発を目指します。
補足説明
- 1.核生成
分子などの構成要素が局所的に周囲と異なる状態をとる際に、その局所的な領域の成長が、変化を特徴づけるパラメーターのある臨界値以下ではトライアル・アンド・エラーの揺らぎを繰り返すのに対し、臨界値以上では不可逆に成長していく現象。臨界値に相当する状態を臨界核と呼ぶ。核生成は過飽和水蒸気中の液滴や結晶粒の発生、過熱液体中の泡の発生などに見られるが、閾値濃度を上回るチューブリンダイマー溶液中での微小管の発生も核生成に該当する。一般に個々の要素レベルの状態変化が微視的で頻繁であるのに反し、核生成は大きな揺らぎを待って起こる稀な現象で、それを包含するシステムの律速過程になりうる。 - 2.神経変性疾患
アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症など、脳や脊髄にある神経細胞の中で、特定の神経細胞群が徐々に機能を失い脱落していく病気。神経細胞の脱落は、軸索微小管の崩壊とともに起こり、微小管の安定性と神経変性疾患の発症は密接に関係していることが知られている。 - 3.細胞骨格
細胞質内に張り巡らされたタンパク質繊維のネットワークで、細胞の形態維持や細胞運動に関わり、細胞内輸送、細胞分裂、情報伝達などにも重要な役割を果たしている。真核生物ではアクチンフィラメント、微小管、中間径フィラメントの3種が主要な細胞骨格として認められる。 - 4.組換え体チューブリンの技術
遺伝子組換え技術を用いて、遺伝子産物であるタンパク質(ここではチューブリン)を培養細胞に作らせる技術のこと。 - 5.ネガティブ染色電子顕微鏡法
タンパク質の試料そのものではなく、背景の溶液のコントラストを上昇させてから透過型電子顕微鏡で試料を観察する手法のこと。観察対象そのものを染色する方法をポジティブ染色と呼び、観察対象の背景を染色する方法をネガティブ染色と呼ぶ。精製したタンパク質を含む溶液を試料台である支持膜に広げた後に、重金属の溶液で置換する。その結果、タンパク質の背景が重金属の溶液で満たされる。重金属はタンパク質よりも電子線を強く散乱させるので、電子顕微鏡で観察すると、暗い背景にタンパク質の外形が明るく観察できる。 - 6.ラピッドフラッシュ法
タンパク質を、観察のための支持膜にのせた瞬間に、タンパク質を固定・染色剤を与えるネガティブ染色の手法のこと。この手法は、希釈・固定・染色を瞬時(10ミリ秒以内)に行うため、高タンパク質濃度状態のタンパク質の構造を希釈直後に観察できる。 - 7.オリゴマーの曲率
オリゴマーの曲がり具合を表すパラメーター。オリゴマーを半径rの円弧で近似した時、曲率は1/rで求められ、完全な直線オリゴマーの曲率は0になる。 - 8.タキソール
セイヨウイチイから単離されたアルカロイドの一種で、チューブリンに結合して重合を促進する。有糸分裂の阻害剤として、分裂中の細胞を選択的に死滅に導くことで知られ、この性質を利用してがん化学療法に用いられる。一般名はパクリタキセル。
国際共同研究グループ
理化学研究所
脳科学総合研究センター 分子動態解析技術開発チーム(研究当時)
チームリーダー(研究当時) 武藤 悦子(むとう えつこ)
(現理研 脳神経科学研究センター 神経細胞動態研究チーム 上級研究員)
テクニカルスタッフ(研究当時) 鮎川 理恵(あゆかわ りえ)
(現理研 脳神経科学研究センター 神経細胞動態研究チーム テクニカルスタッフ)
研究員(研究当時) 岩田 聖悟(いわた せいご)
(現理研 脳神経科学研究センター 神経細胞動態研究チーム 研究員)
研究員(研究当時) 林 真人(はやし まさひと)
(現法政大学 生命科学部 助手)
研究員(研究当時) キエン・スアン・ンゴー(Kien Xuan Ngo)
(現金沢大学 ナノ生命科学研究所 特任助教)
研究員(研究当時) 箕浦 逸史(みのうら いつし)
(現五稜化薬株式会社 執行役員)
研究員(研究当時) 内村 誠一(うちむら せいいち)
(現株式会社ダイセル 主任研究員)
研究員(研究当時) 牧野 司(まきの つかさ)
(現東京大学大学院 医学系研究科 助教)
生命機能科学研究センター タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(しろうず みかこ)
上級研究員(研究当時) 重松 秀樹(しげまつ ひでき)
(現理研 放射光科学研究センター 生物系ビームライン基盤グループ 研究員)
中央大学 理工学部 生命科学科
教授 上村 慎治(かみむら しんじ)
助教(研究当時) 今井 洋(いまい ひろし)
(現大阪大学大学院 理学研究科 助教)
パリ・サクレー大学
グループリーダー ジャイジャント・ブノア(Gigant Benoit)
パリ(第7)大学
教授 関本 謙(せきもと けん)
研究支援
本研究は日本学術振興会(JSPS)科学研究費補助金基盤研究B「変異チューブリンによる重合―GTP加水分解の共役メカニズムの解明(研究代表者:武藤悦子)」による支援を受けて行われました。
原論文情報
- Rie Ayukawa, Seigo Iwata, Hiroshi Imai, Shinji Kamimura, Masahito Hayashi, Kien Xuan Ngo, Itsushi Minoura, Seiichi Uchimura, Tsukasa Makino, Mikako Shirouzu, Hideki Shigematsu, Ken Sekimoto, Benoit Gigant, Etsuko Muto, "GTP-dependent formation of straight tubulin oligomers leads to microtubule nucleation.", Journal of Cell Biology, 10.1083/jcb.202007033
発表者
理化学研究所
脳神経科学研究センター 神経細胞動態研究チーム
上級研究員 武藤 悦子(むとう えつこ)
テクニカルスタッフ 鮎川 理恵(あゆかわ りえ)
中央大学 理工学部
教授 上村 慎治(かみむら しんじ)
助教(研究当時) 今井 洋(いまい ひろし)
(現 大阪大学大学院 理学研究科 助教)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
中央大学 研究支援室 研究広報担当
Email: kkouhou-grp [at] g.chuo-u.ac.jp
※[at]は@に置き換えてください。
