理化学研究所(理研)生命機能科学研究センター細胞外環境研究チームの森田梨津子研究員、藤原裕展チームリーダーらの研究グループは、毛包[1]の幹細胞が従来の定説とは異なる細胞に由来し、既知のメカニズムとは別の仕組みで誘導されることを明らかにしました。この発見から、毛包を構成する細胞の区画化と幹細胞誘導を同時に可能とする新しい形態形成モデル「テレスコープモデル」を提唱しました。
本研究成果は、毛包幹細胞[1]の発生起源の定説を覆す発見であり、幹細胞生物学および再生医療研究の新たな基盤知識となることが期待できます。またテレスコープモデルは、さまざまな生物種の体表器官に共通する幹細胞誘導原理となる可能性があり、分野を超えて大きなインパクトを与えることが期待できます。
今回、研究グループは、1細胞レベルでマウス毛包の発生を経時観察する長期ex vivoライブイメージング[2]と、1細胞トランスクリプトーム解析[3]を組み合わせた独自のデータ駆動型手法[4]を用いて、毛包幹細胞の発生起源の解明を目指しました。その結果、発生中の毛包は筒状に区画化されており、将来の幹細胞はその区画の一つから誘導されること、またこれらの区画は、毛包形成前の上皮[5]シートでは同心円リング状の細胞プレパターンとして存在することを見いだしました。そして、リング状の細胞プレパターンから望遠鏡が伸びるように筒状の区画が形成される毛包発生の仕組みを、「テレスコープモデル」と名付けました。
本研究は、科学雑誌『Nature』オンライン版(6月9日付:日本時間6月10日)に掲載されます。
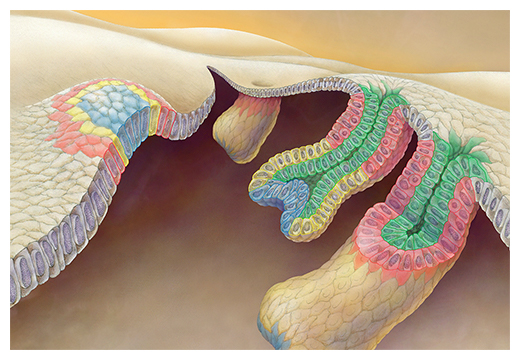
毛包幹細胞の発生起源(赤)と新たな毛包発生モデル「テレスコープモデル」
(イラスト:奈良島 知行)
背景
毛を産生する皮膚付属器官である毛包は、頭部を含む全身に分布し、身体の保護、感覚受容、容姿決定などの機能を担います。毛包は、出生後も生涯にわたって「周期的に再生を繰り返す」というそのユニークな性質ゆえ、いち早く成体における組織幹細胞(毛包幹細胞)の存在が特定された器官であり、幹細胞生物学の発展を牽引してきました。
しかし、マウスの成体毛包における毛包幹細胞の働きが明らかになる注1)一方で、胚の発生過程において、一見均一な胎仔性の上皮細胞の集団から、どのようにして毛包幹細胞が正しい場所に正しいタイミングで誘導されるのかについては十分に理解されていませんでした。2016年にアメリカの研究グループが、マウスの成体毛包幹細胞マーカー遺伝子[6]の発現を指標とした遺伝学的細胞系譜解析[7]に基づき、「毛包幹細胞の起源は、プラコード[8]基底細胞[5]の非対称分裂[9]から生まれる転写因子[10]SOX9[10]陽性の基底上層細胞[5]」と報告すると、これが研究分野での定説として広く信じられるようになりました注2)。
今回研究グループは、毛包とその幹細胞の発生過程の解明に取り組むにあたり、既存の成体幹細胞マーカーに依存しない新しい手法を試みました。研究開始当時、未成熟な胎仔性上皮細胞の中で「毛包幹細胞になる細胞」を特異的に標識し得るマーカー遺伝子は同定されておらず、これが毛包幹細胞の起源や誘導メカニズムの理解が進まない最大の要因だと考えられたからです(図1)。
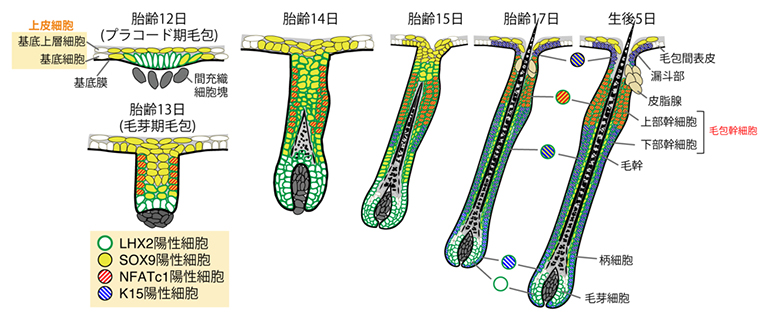
図1 マウスの毛包発生の模式図
毛包は、上皮が内部に陥入してできた筒状の構造をとる。胎仔期に形成された毛包は、毛包幹細胞の働きにより生涯にわたって退縮と再生を繰り返すことができる。成体の毛包幹細胞は、SOX9やLHX2といったマーカー遺伝子の発現により他の細胞と区別できるが、これらの遺伝子は発生過程のさまざまな細胞で発現するため、成体幹細胞マーカー遺伝子を頼りに幹細胞の発生起源を追跡することは困難であると考えられた。
- 注1)Fujiwara, H., Tsutsui, K. & Morita, R. Multi-tasking epidermal stem cells: Beyond epidermal maintenance. Dev Growth Differ 60, 531-541, doi:10.1111/dgd.12577 (2018).
- 注2)Ouspenskaia, T., Matos, I., Mertz, A. F., Fiore, V. F. & Fuchs, E. WNT-SHH Antagonism Specifies and Expands Stem Cells prior to Niche Formation. Cell 164, 156-169, doi:10.1016/j.cell.2015.11.058 (2016).
研究手法と成果
研究グループは、毛包の発生を1細胞解像度で経時観察できる長期ex vivoライブイメージングを新たに開発しました。さらに、1細胞トランスクリプトーム解析を組み合わせたマルチオミクスデータ[4]の統合的解析を行うことで、発生期毛包における①個々の毛包細胞の三次元的な位置や動態、②細胞の発生系譜、③各細胞系譜の遺伝子発現の変化を、これまでにない解像度と精度で解析することを可能にしました。
1)長期ex vivoライブイメージングによるマウス毛包幹細胞の起源の同定
まず、マウスの頬および背中の毛包の発生を生体外(ex vivo)で再現する器官培養法を新たに確立し、1細胞レベルの解像度で毛包発生過程を捉えた動画を撮影しました。この動画を時間を遡って観察すると、毛包を構成する各細胞が最初はどの位置にいたのかが分かります。毛包構成細胞を連続的かつ網羅的に追跡した結果、筒状の形態形成が始まる発生初期の毛芽期毛包において、細胞運命の異なる区画がすでに確立しており、毛包はこの各区画が伸長することで発生すること、そして、将来幹細胞になる細胞は、毛芽期毛包の上部の区画から誘導されることが明らかになりました(図2)。
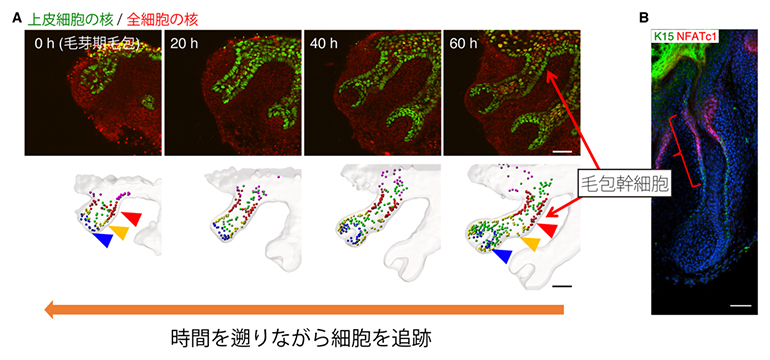
図2 毛包発生の長期ex vivoライブイメージングと毛包幹細胞の発生系譜の同定
- A.マウスの胎齢13日毛芽期毛包から毛球性毛杭期(毛包が杭状の細長い形態を獲得する時期)のライブイメージング(上)と上皮細胞の遡及的追跡結果(下)。将来幹細胞になる細胞(赤矢頭)は、毛芽期毛包の上部に存在し、他の細胞区画(黄、青)に移動しない。スケールバーは100マイクロメートル(μm、1μmは1,000分の1mm)。
- B.生体外で発生した毛包の成体毛包幹細胞マーカー(緑、赤)での免疫染色像。スケールバーは50μm。
続いて、毛芽期毛包より前の毛包発生の開始期まで遡って観察しました。この時期の毛包予定領域はまだ皮膚から陥入しておらず、プラコードと呼ばれる二次元の上皮シート(毛包プラコード)構造をとっています。観察の結果、毛包プラコードには、異なる系譜の細胞群が同心円リング状に配置されており、将来幹細胞になる細胞は、毛包プラコード辺縁に位置するSOX9陽性基底細胞のリングから生まれることが明らかになりました(図3)。従来の定説では、基底細胞の非対称分裂により生じたSOX9陽性の基底上層細胞が毛包幹細胞の起源とされていましたが、この細胞は分化細胞を生み出すだけで、幹細胞領域には寄与しませんでした(図3)。
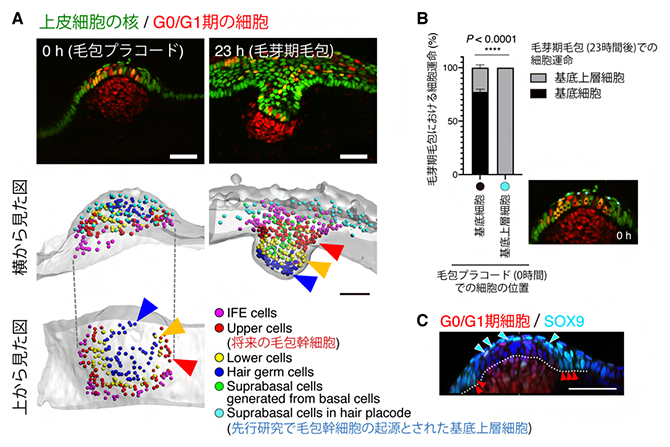
図3 毛包幹細胞の発生予定領域の同定
- A.胎齢12日マウスの、プラコード期から毛芽期に至る毛包発生のライブイメージング(上)。毛芽期の各領域の細胞の動きを遡って追跡することで、プラコード期でのそれぞれの発生予定領域が分かる(下)。毛包プラコードには異なる上皮細胞系譜が同心円上に配置しており、将来幹細胞になる細胞は毛包プラコードの辺縁の基底層(赤矢頭)に存在した。先行研究で、幹細胞の起源とされた基底上層細胞(水色丸)は、毛芽期では表皮内に散在しており、毛包発生にほとんど寄与しなかった。スケールバーは50μm。
- B.プラコード期の基底層および基底上層に存在する細胞が、毛芽期毛包ではどこに存在するのかを集計した。基底層を完全に離れた基底上層細胞(水色丸)は、毛芽期において二度と基底層(成体幹細胞が存在する細胞層)に戻らないことが確認された。
- C.毛包プラコードには、SOX9の発現の強さの異なる2種類の細胞が存在していた。先行研究で幹細胞の起源とされた基底上層細胞(水色矢頭)はSOX9を高発現し、本研究で明らかになった幹細胞予定領域の基底細胞は、SOX9を中程度発現していた(赤矢頭)。スケールバーは50μm。
また、網羅的かつ連続的な細胞系譜データから、毛包プラコード上の同心円リング領域が体内側へ陥入し、かつ各領域が長軸方向に伸長することで、三次元的な筒状の区画構造が形成されることが明らかになりました。そして胎仔期の毛包幹細胞は、この過程での毛包形成にほとんど寄与しないことも判明しました。これは成体において、毛包幹細胞が毛周期で退縮する毛包領域を再生する仕組みとは大きく異なります。
2)1細胞トランスクリプトーム解析による幹細胞誘導過程の解析
次に、発生過程での毛包細胞の状態変化を知るために、経時的な1細胞トランスクリプトーム解析を行いました。発生期の皮膚には発生ステージの異なるさまざまなタイプの毛包が入り混じっているため、皮膚片を切り出して細胞を分離するだけでは、ステージの異なる毛包細胞が混在してしまいます。そこで、光変換型蛍光タンパク質KikGR[11]を全身の細胞核で発現する遺伝子改変マウスを開発し、特定の発生ステージの毛包のみを顕微鏡下で標識することで、同時期の毛包全体の上皮細胞を高精度に単離することに成功しました(図4A)。
経時的に取得した各発生ステージの細胞から、理研の独自技術注3)である1細胞完全長トータルRNAシーケンス法「RamDA-seq」[12]を用いて、1細胞トランスクリプトームデータを取得しました。トランスクリプトームデータに基づいて、細胞系譜と個々の細胞の組織内での時空間配置を再構築した結果(図4B)、毛包プラコードにおいて、ライブイメージングで得られた細胞系譜パターンと一致した同心円リング状の遺伝子発現パターンが存在することが分かりました(図4C)。さらに発生ステージの進行とともに、同心円の各リングに特徴的な複数の遺伝子が、同心円パターンから筒状毛包の各区画の発展と対応するように、その発現領域を変化させることが明らかになりました(図4D)。
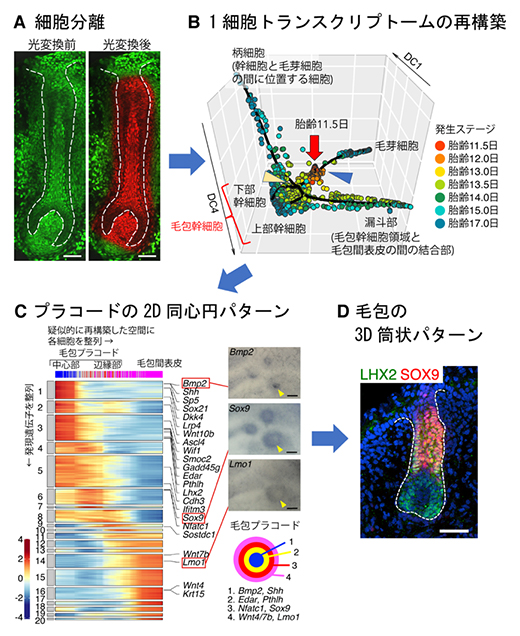
図4 毛包上皮細胞の網羅的1細胞トランスクリプトーム解析
- A.光変換型蛍光タンパク質KikGRを用いて標識された毛包。スケールバーは50μm。
- B.発生期の毛包上皮細胞の網羅的な疑似時系列解析。各発生ステージの毛包上皮細胞の1細胞トランスクリプトームデータを用い、個々の細胞の遺伝子発現の特徴を三次元空間上の位置で表現したもの。似た特徴を持つ細胞は同じ位置にクラスターを作る。胎齢11.5日プレプラコード期(赤丸)を起点に、胎齢12日プラコード期(オレンジ丸)を経て、徐々に細胞運命が分岐して、それぞれの細胞系譜ごとに分化・成熟していく様子を捉えている。青矢頭は毛芽細胞の分岐点、黄矢頭は毛包幹細胞の分岐点を示す。
- C.胎齢12.0日毛包上皮細胞由来の1細胞トランスクリプトームの詳細な解析。(左)遺伝子発現パターンから擬似的に再構築した空間に1細胞トランスクリプトームデータを並べた結果、毛包プラコードの中心部から辺縁部、毛包間表皮細胞に向かって発現遺伝子が変化していく様子が認められた。(右上)擬似的に再構築した空間で、プラコードの中心から辺縁に向かって異なる発現パターンを示した三つの遺伝子について、実際の毛包プラコード上での発現パターンを確認したところ(矢頭)、Bmp2の発現を中心にリング状の発現パターンが観察された。(右下)毛包プラコードで発現する代表的な遺伝子の発現パターンのまとめ。スケールバーは100μm。
- D.毛包プラコード上でリング状の発現パターンを示したSox9は、発生が進んだ毛包では円筒状の発現パターンを示すようになる。スケールバーは50μm。
さらに、成体毛包幹細胞の性質は、毛包の形態形成過程を通じて徐々に獲得されていくことや、プラコード期に形成されたBMP[13]活性が高くWnt[13]活性が低い領域が維持、拡大することで、毛包幹細胞が誘導される場が生じている可能性が示されました。
以上の結果から、毛包プラコードには、異なる遺伝子発現パターンを持ち、異なる細胞に分化する上皮細胞が同心円状に配置されており、このプラコード上の同心円パターンが体内側へ陥入し、各領域が長軸方向に伸長することで、三次元的な筒状の毛包構造が作られることが明らかになりました。
研究グループは、この伸縮式の望遠鏡が伸びるように発生する毛包の形態形成様式を「テレスコープモデル」と名付けました(図5)。これは、ショウジョウバエ[14]胚発生における肢原基[14]の形成機構にもよく似ていることから、哺乳類以外の生物種の器官発生にも共通する普遍的な形態形成システムである可能性があります。胎仔期の毛包幹細胞は、このような形態形成システムと密接に連携しながら生み出され、出生後の毛包再生で中心的な役割を果たします。
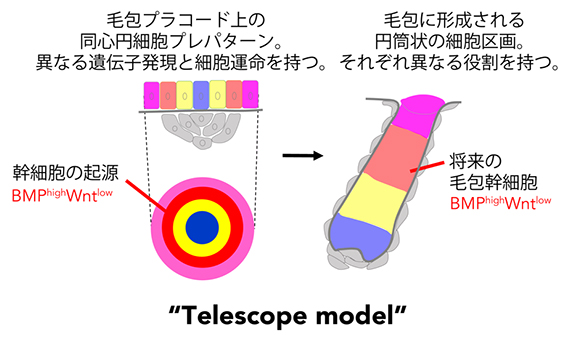
図5 毛包幹細胞の発生起源と新たな毛包発生モデル「テレスコープモデル」
毛包プラコードには、異なる遺伝子発現と細胞運命を持つ上皮細胞が同心円状に配置された毛包のプレパターンが既に存在している。このうち、毛包プラコード辺縁のBMP活性が高くWnt活性が低い区画から将来の毛包幹細胞が誘導される。このプラコード上の同心円パターンは発生とともに体内側に陥入し、各領域が長軸方向に伸長することで、三次元的な筒状の区画が形成され、毛包構造が作られる。
- 注3)2018年2月14日プレスリリース「1細胞から多種多様なRNAのふるまいを計測」
今後の期待
本成果は、基礎および応用の両面で、今後の発展が期待できます。基礎面では、幹細胞を生み出し維持する幹細胞の微小環境「幹細胞ニッチ[15]」が解明されると考えられます。これまでは、幹細胞の起源とその後の系譜が不明であったため、そのニッチの解析が困難でした。今回の技術開発によって、幹細胞予定細胞の動態と状態変化に加え、それらと挙動をともにする周囲の細胞の同定や、その遺伝子発現の詳細な解析も可能になりました。
もう一つの重要な課題は、テレスコープモデルが、毛包と同じようにプラコードから発生する他の体表器官(乳腺や汗腺など)の発生や幹細胞誘導機構にも共通する仕組みかどうかを調べることです。これらの器官を解析することで、器官や生物種を貫く普遍的な形態形成システムに迫れる可能性があります。
応用面では、ES細胞[16]やiPS細胞[16]など多能性幹細胞からの毛包幹細胞の誘導・増殖・分化の制御技術の発展が期待できます。本研究により、毛包幹細胞の正しい細胞系譜とその遺伝子発現変化が明らかとなりました。これらの情報を多能性幹細胞からの分化状態のロードマップにすることで、ES/iPS細胞から効率良く質の高い毛包幹細胞を分化誘導できる可能性が高まります。
補足説明
- 1.毛包、毛包幹細胞
毛包とは、毛を産生する哺乳類の皮膚付属器官のこと。マウスなどのげっ歯類の毛包の発生は、胎仔期の表皮からプラコード期、毛芽期を経て、出生後2週間以内に完了する。毛包幹細胞は、毛包を構成する細胞を供給する源の細胞で、毛包のバルジと呼ばれる領域に存在することが知られている。幹細胞は、長期の自己複製能とさまざまな細胞を生み出す多分化能を併せ持つ。 - 2.ex vivoライブイメージング
生体外に取り出した生きた細胞・組織の活動を経時観察すること。ex vivo(エクスビボ)とは、「生体外で」を意味する用語。緑色蛍光タンパク質(GFP)などの蛍光マーカーを用いて特定の細胞や組織を標識し、蛍光顕微鏡でその動きや変化を詳細に観察できる。 - 3.1細胞トランスクリプトーム解析
1細胞の中でDNAから転写されるRNAを、ハイスループットDNAシーケンサーを用いて配列決定し、網羅的かつ定量的にその量や種類を決定し、解析する手法。一つの細胞の数百から数千に上る遺伝子の発現情報が一気に得られる。 - 4.データ駆動型手法、マルチオミクスデータ
データ駆動型手法は、仮説検証により実験を進める仮説駆動型手法に対し、研究対象の生命現象に関する精密で大量の系統的データの解析から新しい知識を得る研究手法。本研究では、毛包発生過程を1細胞レベルで追跡した細胞の四次元動態(三次元+時間軸)と、1細胞レベルの遺伝子発現変化の複数の網羅的データ(マルチオミクスデータ)を取得・解析した。 - 5.上皮、基底細胞、基底上層細胞
体表を取り巻く上皮は、重層化した数層の上皮細胞から構成される。基底膜に接した最下層を基底層、基底層を構成する細胞を基底細胞、基底細胞の上層を構成する細胞を基底上層細胞と呼ぶ。 - 6.マーカー遺伝子
特定の状態にある細胞に特徴的な発現を示す遺伝子をマーカー遺伝子と呼び、細胞周期や細胞分化の進行度などを正確に把握するために用いられる。 - 7.遺伝学的細胞系譜解析
遺伝子組換えにより特定の細胞に永続的に印や色を付け、その細胞とそこから細胞分裂で作られる細胞全てを追跡する方法。細胞の系譜(家系図)が解析できる。CreリコンビナーゼがloxP配列を認識してDNA組換えを誘導する機構を利用して、特定の遺伝子を発現する細胞で蛍光タンパク質などを発現させる方法が広く用いられている。 - 8.プラコード
感覚器などの発生予定領域で作られる肥厚した上皮組織構造のこと。毛包、眼、耳、乳腺、羽毛などは全てプラコードから形成される。 - 9.非対称分裂
分裂して生じた二つの細胞(娘細胞)が異なる運命をたどる場合、その分裂を非対称分裂と呼ぶ。一方、同じ運命をたどる場合は対称分裂と呼ぶ。 - 10.転写因子、SOX9
転写因子は、DNAに結合して特定の遺伝子の発現を制御するタンパク質。SOX9は転写因子の一つで、哺乳類の器官発生などに重要な役割を持つ。SOX9をコードするマウス遺伝子はSox9と表記する。 - 11.光変換蛍光タンパク質KikGR
蛍光タンパク質の中でも、特定の波長の強い光が当たることによって、蛍光の色が変わるものを光変換蛍光タンパク質と呼ぶ。KikGRはサンゴの蛍光タンパク質の変異体で、理研の宮脇敦史博士のグループにより開発された。紫外光や青紫光を照射すると、発する蛍光が緑色から赤色に変化する。 - 12.1細胞完全長トータルRNAシーケンス法「RamDA-seq」
理研の二階堂愛博士のグループにより開発された、多様なRNAの発現量と全長を1細胞で高感度、高精度に計測する方法。RamDA-seq(ラムダセック)は、Random Displacement Amplification sequencingの略。 - 13.BMP、Wnt
いずれも分泌性タンパク質であり、幹細胞の増殖や分化の制御に関わるほか、初期発生やがんなど多様な生命現象に関与する。BMPはBone Morphogenetic Proteinの略。Wntは、ショウジョウバエの遺伝子winglessとマウス乳がん遺伝子int-1から名付けられた。 - 14.ショウジョウバエ、肢原基
ショウジョウバエは、遺伝子による胚発生の研究などによく用いられる昆虫。肢原基は、ハエの肢のもとになる未熟な二次元の上皮組織。伸長する前の肢原基に同心円状の細胞運命地図が形成され、それらが肢の先端、中間、根元部分へ分化していく。 - 15.幹細胞ニッチ
幹細胞を取り囲む幹細胞固有の微小環境のことで、いわば幹細胞のゆりかご。ニッチは幹細胞にシグナルを送ることで、幹細胞の誘導、維持、分化を制御する。生体外での幹細胞の培養にも、ニッチの成分が使われることがある。 - 16.ES細胞、iPS細胞
ES細胞(胚性幹細胞)は、哺乳類の着床前胚(胚盤胞)に存在する多能性幹細胞(内部細胞塊)から樹立した細胞。iPS細胞(人工多能性幹細胞)は、体細胞に特定の遺伝子を導入することで分化多能性を獲得した細胞。
研究グループ
理化学研究所 生命機能科学研究センター
細胞外環境研究チーム
研究員 森田 梨津子(もりた りつこ)
テクニカルスタッフ 三千 典子(さんぜん のりこ)
テクニカルスタッフ 佐々木 弘子(ささき ひろこ)
チームリーダー 藤原 裕展(ふじわら ひろのぶ)
バイオインフォマティクス研究開発チーム
技師 林 哲太郎(はやし てつたろう)
テクニカルスタッフ 梅田 茉奈(うめだ まな)
専門技術員 芳村 美佳(よしむら みか)
チームリーダー 二階堂 愛(にかいどう いとし)
生体ゲノム工学研究チーム
チームリーダー(研究当時) 古田 泰秀(ふるた やすひで)
(現 Core Head, Mouse Genetics Core Facility, Sloan Kettering Institute, Memorial Sloan Kettering Cancer Center)
生体モデル開発チーム
技師 阿部 高也(あべ たかや)
チームリーダー 清成 寛(きよなり ひろし)
フィジカルバイオロジー研究チーム
研究員(研究当時) 山本 尚貴(やまもと たかき)
(現 生体非平衡物理学理研白眉研究チーム 研究員)
チームリーダー 柴田 達夫(しばた たつお)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、分野横断連携研究 「一細胞プロジェクト」)、科学技術振興機構(JST)戦略的創造研究推進事業CREST「多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出(研究総括:松田道行)」領域の研究課題「体表多様性を創発する上皮―間充織相互作用の動的制御機構の解明(研究代表者:藤原裕展)」、AMED 創薬等支援技術基盤プラットフォーム 「毛包幹細胞の起源と誘導メカニズムの解明(研究代表者:藤原裕展)」、日本学術振興会(JSPS)
科学研究費補助金若手研究 (B) 「細胞外環境依存的な毛包幹細胞の恒常性維持機構の解明(研究代表者:森田梨津子)」「毛包幹細胞の起源と誘導メカニズムの解明(研究代表者:森田梨津子)」、同基盤研究 (C) 「毛包幹細胞へのlineage primingに寄与する遺伝子ネットワークの同定(研究代表者:森田梨津子)」、理研BDR-大塚製薬連携センター RBOC 2019年度公募プログラム「かけ橋」「毛包幹細胞へのlineage primingに寄与する遺伝子ネットワークの同定(研究代表者:森田梨津子)」、第13回資生堂女性研究者サイエンスグラント 「毛包上皮幹細胞へのlineage primingに寄与する細胞間相互作用の理解(研究代表者:森田梨津子)」、科学技術振興機構(JST)戦略的創造研究推進事業CREST「統合1細胞解析のための革新的技術基盤(研究総括:菅野純夫)」領域の研究課題 「臓器・組織内未知細胞の命運・機能の1細胞オミクス同時計測(研究代表者:二階堂愛)」による支援を受けて行われました。
原論文情報
- Ritsuko Morita, Noriko Sanzen, Hiroko Sasaki, Tetsutaro Hayashi, Mana Umeda, Mika Yoshimura, Takaki Yamamoto, Tatsuo Shibata, Takaya Abe, Hiroshi Kiyonari, Yasuhide Furuta, Itoshi Nikaido, and Hironobu Fujiwara, "Tracing the origin of hair follicle stem cells", Nature, 10.1038/s41586-021-03638-5
発表者
理化学研究所
生命機能科学研究センター 細胞外環境研究チーム
研究員 森田 梨津子 (もりた りつこ)
チームリーダー 藤原 裕展(ふじわら ひろのぶ)
 森田 梨津子
森田 梨津子
 藤原 裕展
藤原 裕展
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
科学技術振興機構 広報課
Tel: 03-5214-8404
Email: jstkoho [at] jst.go.jp
JST事業に関すること
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
保田 睦子(やすだ むつこ)
Tel: 03-3512-3524
Email: crest [at] jst.go.jp
※上記の[at]は@に置き換えてください。
