理化学研究所(理研)環境資源科学研究センター植物免疫研究グループの白須賢グループディレクター、石濱伸明研究員、岡山大学学術研究院環境生命科学学域の能年義輝研究教授らの国際共同研究グループは、ヒトの非ステロイド性抗炎症薬[1]であるテノキシカムに植物の免疫応答を抑制する作用があることを発見しました。
本研究成果は、植物の免疫機構の理解や耐病性を制御する技術開発に貢献すると期待できます。
非ステロイド性抗炎症薬として知られるサリチル酸は、植物体内では耐病性を亢進する内生のシグナル分子として働きます。しかし、サリチル酸が植物細胞内でシグナルを伝える仕組みには、まだ不明な点が残されています。
今回、国際共同研究グループは、新たに化合物ライブラリー[2]から植物の免疫応答を抑制する化合物として、化学構造の類似した3種類のオキシカム系非ステロイド性抗炎症薬(テノキシカム、メロキシカム、ピロキシカム)を同定しました。さらに、テノキシカムが細胞内の酸化還元状態を酸化側に傾かせること、そしてサリチル酸で発現が上昇する遺伝子群を広範に抑制することを示し、サリチル酸のシグナル伝達機構の一端を明らかにしました。
本研究は、オンライン科学雑誌『Nature Communications』(12月15日付)に掲載されます。
テノキシカムによるサリチル酸依存性の植物免疫応答の阻害
背景
植物は、病原菌の感染行動を認識すると、生体防御反応を誘導することで病原菌の感染および増殖を防ぎます。この防御システムは、動物細胞の自然免疫系に類似した点が多々あることから、「植物免疫」と呼ばれています。
ヒトの非ステロイド性抗炎症薬として知られるサリチル酸は、ヤナギの樹皮から抽出した解熱鎮痛剤の実体として2000年以上前から使用されてきました。一方、植物体内においては、サリチル酸は内生のシグナル分子であり、転写補助因子[3]NPR1を介して植物免疫応答を活性化する働きを持っています。しかし、サリチル酸依存のシグナル伝達におけるNPR1の働きには、不明な点が残されています。このシグナル伝達経路をかく乱する化合物が同定できれば、それを鍵として植物の免疫機構の理解が進むとともに、作物の耐病性を制御する技術の開発にも援用できます。
研究手法と成果
国際共同研究グループは、2012年にモデル植物シロイヌナズナの懸濁培養細胞に薬剤と病原細菌(斑葉細菌病菌[4])を混合し、培養細胞が示す抵抗反応の一つであるプログラム細胞死を定量検定するハイスループットアッセイ[5]を開発しました注1)。
今回、このアッセイ系を用いて、約2,800個の低分子化合物を含む化合物ライブラリーから、植物免疫応答をかく乱する生理活性物質を探索しました。そして、選抜された化合物と斑葉細菌病菌とを植物に接種し、細菌増殖に与える影響を調べました。その結果、細菌増殖を促進し、植物免疫応答を抑制する化合物として、非ステロイド性抗炎症薬である3種のオキシカム化合物(テノキシカム、メロキシカム、ピロキシカム)を同定しました(図1)。
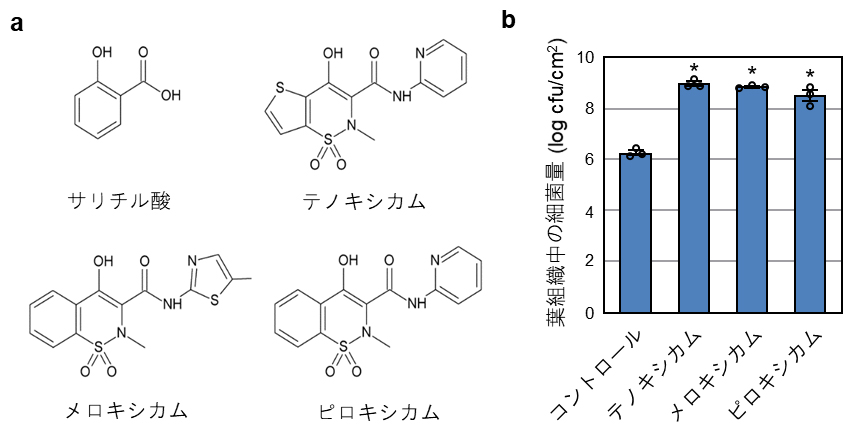
図1 オキシカム化合物の化学構造とその植物免疫応答への作用
- (a)サリチル酸およびオキシカム化合物の化学構造。
- (b)トマト斑葉細菌病菌を、aに示すオキシカム化合物存在下で野生型シロイヌナズナに感染させ、3日後に植物体内の細菌量を調べた。アスタリスク(*)は、コントロールと比較して統計学的な有意差があることを示す。オキシカム化合物によって病原細菌の増殖量が増加した。
- 注1)2012年9月11日プレスリリース「植物の耐病性を向上させる新規化合物を5個発見」
植物病原細菌の感染に伴い、サリチル酸は防御関連遺伝子であるPR1を発現誘導します。テノキシカムを投与するとサリチル酸誘導性のPR1遺伝子の発現が抑制されたため、テノキシカムがサリチル酸のシグナル伝達を阻害している可能性が考えられました(図2a)。テノキシカムがサリチル酸による遺伝子発現変動に与える影響を網羅的に解析したところ、サリチル酸で発現が上昇するNPR1依存性の遺伝子631個のうち、313個(49.6%)がテノキシカムにより抑制されることが分かりました(図2b)。
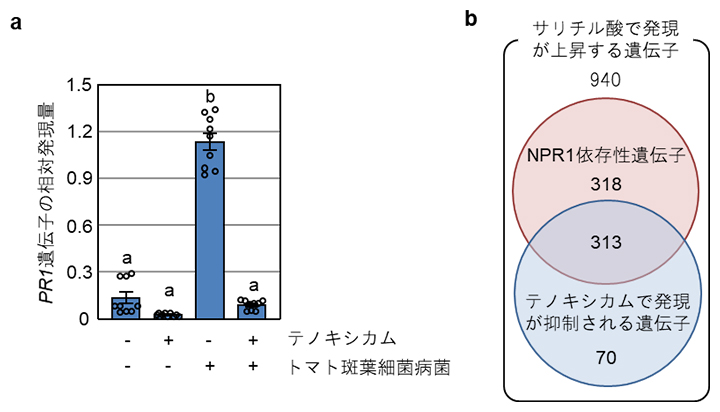
図2 テノキシカムによるサリチル酸依存遺伝子の発現抑制
- (a)トマト斑葉細菌病菌をテノキシカム存在下で野生型シロイヌナズナに感染させ、1日後の感染組織におけるPR1遺伝子の発現量を調べた。a同士、b同士のグループは、それぞれ統計学的な有意差がないことを示す。テノキシカム添加により、PR1遺伝子の発現量が低下することが分かった。
- (b)サリチル酸および/あるいはテノキシカム処理で、発現量が変動するシロイヌナズナの遺伝子を網羅的に解析した。631個のサリチル酸で発現が上昇するNPR1依存性の遺伝子のうち、313個の遺伝子がテノキシカムにより抑制されることが分かった。
植物の細胞内酸化還元状態は、サリチル酸処理後一時的に酸化側に傾き、その後大きく還元側へと変化します。このとき、細胞内では主要な抗酸化成分であるグルタチオン[6]の総量が増加するとともに、還元型グルタチオンの比率が上昇します。しかし、テノキシカムを添加した場合、サリチル酸処理に応じた総グルタチオン量の増加および還元型グルタチオン比の上昇が抑制されました(図3)。
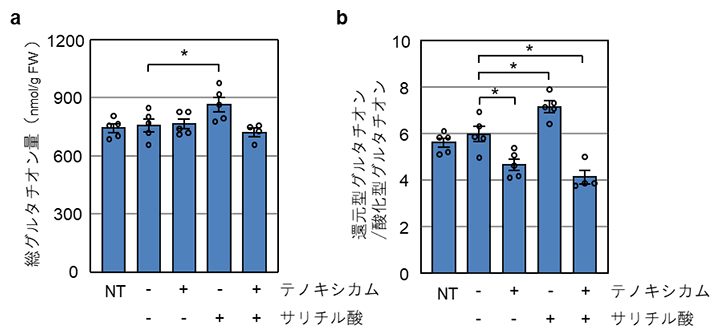
図3 テノキシカムの細胞内グルタチオン量に対する作用
- (a)サリチル酸および/あるいはテノキシカムを野生型シロイヌナズナに処理し、1日後の細胞内総グルタチオン量を調べた。サリチル酸処理に応じた総グルタチオン量の増加が、テノキシカム添加により抑制されることが分かった。NTは無処理のコントロールを示す。アスタリスク(*)は、サンプル間で統計学的な有意差があることを示す。
- (b)サリチル酸および/あるいはテノキシカムを野生型シロイヌナズナに処理し、1日後の細胞内グルタチオンの酸化型に対する還元型の比率を調べた。サリチル酸処理に応じた還元型グルタチオン比の上昇が、テノキシカム添加により抑制されることが分かった。
NPR1はシステイン残基を多数含むタンパク質であり、それらシステイン残基が細胞内酸化還元状態に応じてジスルフィド結合[7]を形成する可能性が、提唱されてきました。今回、サリチル酸やテノキシカム処理に応じてNPR1中のシステイン残基の酸化還元状態が変化するかどうか、新たに遊離システイン残基を高分子マレイミド[8]で標識する手法を用いて詳細に調べました(図4a)。その結果、サリチル酸やテノキシカム処理の有無にかかわらず、NPR1中のシステイン残基は常に還元型であることが分かりました(図4b)。これより、テノキシカムの作用は、NPR1中のシステイン残基の酸化還元状態とは関連しないと考えられました。
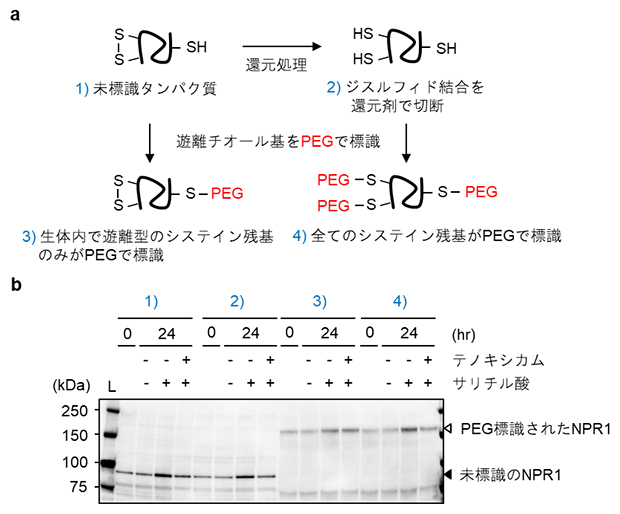
図4 NPR1中のシステイン残基の酸化還元状態に対するサリチル酸とテノキシカムの影響
- (a)タンパク質のシステイン残基にポリエチレングリコール(PEG)を付加することで分子質量を大きくし、電気泳動で分画した際のゲル中での移動度をシフトさせた。遊離システイン残基のみを標識したサンプル3)と、還元後に全てのシステイン残基を標識したサンプル4)の移動度を比較することで、生体内でタンパク質中にジスルフィド結合が存在していたかが分かる。
- (b)緑色蛍光タンパク質とNPR1の融合タンパク質を発現するシロイヌナズナに、サリチル酸および/あるいはテノキシカムを処理し、1日後の植物組織からタンパク質を抽出した。標識サンプルは(a)のスキームに従って調製した。SDS-PAGEゲルで分画後、抗NPR1抗体を用いてNPR1タンパク質を検出した。サリチル酸やテノキシカム処理の有無に関わらず、PEG標識されたNPR1のゲル中での移動度が一定であったことから、NPR1中のシステイン残基は常に還元型であることが分かった。
今後の期待
非ステロイド性抗炎症薬であるサリチル酸とテノキシカムは、ともにヒトのシクロオキシゲナーゼ[9]を標的として解熱鎮痛作用を示しますが、本研究により、これらは植物免疫ではそれぞれ正と負の逆の働きを示すことが明らかになりました。植物はシクロオキシゲナーゼを持っていないため、植物体内でテノキシカムは、ヒトとは異なるタンパク質を標的としていると予想されます。今後、テノキシカムの標的を同定することで、サリチル酸の新たな標的、もしくはサリチル酸シグナル伝達の新たな構成因子の発見が期待できます。
また、テノキシカムの植物免疫抑制作用は、アグロバクテリウム[10]法による植物への遺伝子導入の効率を向上させる可能性があり、ゲノム編集[11]による機能性農作物開発の加速が期待できます。
今回の研究成果は、国際連合が2016年に発行した17項目の「持続可能な開発目標(SDGs)[12]」のうち「2.飢餓をゼロに」と「15.陸の豊かさも守ろう」に大きく貢献すると期待できます。
補足説明
- 1.非ステロイド性抗炎症薬
ヒトの炎症などのシグナル伝達物質として働くプロスタグランジン類の生成を抑制し、抗炎症・解熱・鎮痛などの作用を示す薬。 - 2.化合物ライブラリー
特定の生理活性物質を探索する際に対象となる化合物の集団。 - 3.転写補助因子
特定の転写因子に結合し、遺伝子の転写を活性化あるいは抑制するタンパク質。 - 4.斑葉細菌病菌
主にトマトの果実、果柄、葉柄、葉身に斑点を発生させる病原細菌。シロイヌナズナにも感染するため、モデル病原細菌として研究に用いられる。 - 5.ハイスループットアッセイ
大量の化合物の生理作用を短期間で評価可能な実験系。 - 6.グルタチオン
グルタミン酸、システイン、グリシンという三つのアミノ酸が連なったトリペプチド。細胞内の主要な抗酸化成分であり、遊離チオール基を持つ還元型と、2分子のグルタチオンがジスルフィド結合でつながった酸化型がある。細胞質は、一般に高濃度の還元型グルタチオンを含んでおり、還元的環境に保たれている。 - 7.ジスルフィド結合
システインのチオール基間で、酸化により形成される共有結合。タンパク質の立体構造の安定化や機能に寄与することが知られる。還元型グルタチオンなどの還元作用により切断される。 - 8.高分子マレイミド
ポリエチレングリコールなどの高分子ポリマーに、中性条件下でチオール基と選択的に反応するマレイミドを付加した標識試薬。タンパク質中の遊離チオール基の数に応じて、タンパク質の分子質量を増加させる。 - 9.シクロオキシゲナーゼ
プロスタグランジン類の生合成に関与する酵素複合体で、シクロオキシゲナーゼ活性とペルオキシダーゼ活性の二つの異なる酵素活性を併せ持つ。 - 10.アグロバクテリウム
リゾビウム属に属する土壌細菌で、植物細胞に感染し、T-DNAと呼ばれるDNA断片を植物ゲノムに挿入する能力を持つ。バイオテクノロジー分野では、植物ゲノムに任意のDNA断片を挿入する用途に使用されている。 - 11.ゲノム編集
生物のゲノムDNA配列を任意に改変する技術。 - 12.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる。(外務省ホームページから一部改変して転載)
国際共同研究グループ
理化学研究所 環境資源科学研究センター
植物免疫研究グループ
グループディレクター 白須 賢(しらす けん)
(環境資源科学研究センター 副センター長)
研究員 石濱 伸明(いしはま のぶあき)
特別研究員(研究当時) 崔 勝媛(ちぇ すんうぉん)
特別研究員(研究当時) イヴァーナ・サスカ(Ivana Saska)
上級研究員 浅井 秀太(あさい しゅうた)
テクニカルスタッフⅡ 瀧澤 香(たきざわ かおり)
ケミカルバイオロジー研究グループ
グループディレクター 長田 裕之(おさだ ひろゆき)
岡山大学 学術研究院 環境生命科学学域(農)
研究教授 能年 義輝(のうとし よしてる)
ミシガン州立大学
教授(研究当時) シェン・ヤン・ヒー(Sheng Yang He)
(ハワードヒューズ医学研究所 研究員)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(S)「植物と病原体の攻防における分子機構(研究代表者:白須賢)」、同基盤研究(S)「植物免疫システムの分子機構(研究代表者:白須賢)」、文部科学省新学術領域研究(研究領域提案型)「植物の成長可塑性を支える環境認識と記憶の自立分散型統御システム(研究領域代表者:木下俊則)」の計画研究「寄生植物による維管束情報ハイジャック機構の解明(研究代表者:白須賢)」、同学術変革領域研究(A)「不均一環境変動に対する植物のレジリエンスを支える多層的情報統御の分子機構(研究領域代表者:松下智直)」の計画研究「不均一土壌環境に応答した寄生植物の感染統御機構(研究代表者:吉田聡子)」、同特定領域研究「植物の環境適応戦略としてのオルガネラ分化(研究領域代表者:西村幹夫)」の公募研究「ケミカルジェネティクスによる葉緑体内植物免疫シグナルクロストークの解明(研究代表者:白須賢)」などの支援を受けて行われました。
原論文情報
- Nobuaki Ishihama, Seung-won Choi, Yoshiteru Noutoshi, Ivana Saska, Shuta Asai, Kaori Takizawa, Sheng Yang He, Hiroyuki Osada, Ken Shirasu, "Oxicam-type non-steroidal anti-inflammatory drugs inhibit NPR1-mediated salicylic acid pathway", Nature Communications, 10.1038/s41467-021-27489-w
発表者
理化学研究所
環境資源科学研究センター 植物免疫研究グループ
グループディレクター 白須 賢(しらす けん)
(環境資源科学研究センター 副センター長)
研究員 石濱 伸明(いしはま のぶあき)
岡山大学 学術研究院 環境生命科学学域(農)
研究教授 能年 義輝(のうとし よしてる)
 白須 賢
白須 賢
 石濱 伸明
石濱 伸明
 能年 義輝
能年 義輝
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
国立大学法人岡山大学 総務・企画部広報課
Tel: 086-251-8415 / Fax: 086-251-7294
Email: www-adm [at] adm.okayama-u.ac.jp
