理化学研究所(理研)バイオリソース研究センター遺伝工学基盤技術室の羽田政司客員研究員、小倉淳郎室長(開拓研究本部小倉発生遺伝工学研究室主任研究員)らの共同研究グループは、将来胎盤を構成する「胎盤系列の細胞」は巨大なヘテロクロマチン[1]構造をとり、これらが胎盤の細胞を維持させるために重要であることを明らかにしました。
本研究成果は、胎盤研究のさらなる発展のみならず、胎盤形成異常に由来する胎児発育不良の改善など、医療分野にも貢献すると期待できます。
胎盤は発生の最も初期に将来胎児を構成する「胎児系列の細胞」から分化する組織ですが、その詳しい制御機構は不明でした。
今回、共同研究グループは遺伝子発現に抑制的なエピゲノム情報[2]であるH3K9me3[3](ヒストン[4]H3の9番目のリジン残基に対するトリメチル化修飾)に着目し、胎盤系列と胎児系列の細胞におけるゲノム局在を網羅的に解析したところ、胎盤系列の細胞では高度に安定化されたH3K9me3のドメイン構造「THD」が多数存在することが分かりました。また、このTHDは細胞核のエピゲノム情報をリプログラミング(初期化)させる手法である体細胞核移植法[5]に強い抵抗性を示しましたが、THDを取り除くことで世界初の胎盤系列細胞に由来するクローンマウスを作出することに成功しました。
本研究は、科学雑誌『Genes & Development』オンライン版(1月6日付)に掲載されました。
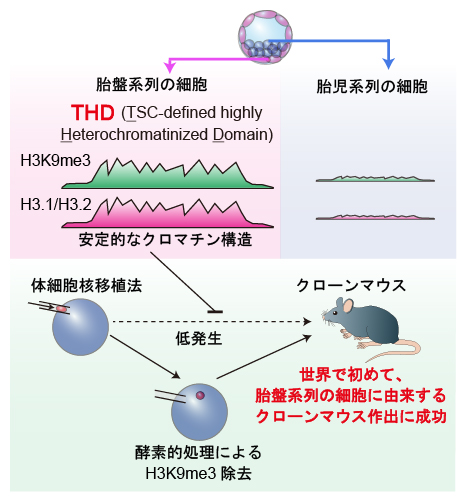
胎盤系列の細胞は巨大なヘテロクロマチン構造をとる
背景
哺乳類の全ての細胞は1個の受精卵から発生しますが、最も初期の分化は着床前後に起こり、将来胎児になる「胎児系列の細胞」と、胎盤になる「胎盤系列の細胞」に分かれます。この両系列の細胞は遺伝子発現が異なっており、それを支えるエピゲノム情報にもいくつかの点で違いがあることが分かっています。
特に、胎児系列の細胞は個体を形成する全ての細胞に分化できるという特徴から、再生医療などへの応用が期待されており、多くの知見が報告されています。一方で、胎盤系列の細胞は個体の細胞には全く分化しないというユニークな特徴を持っていますが、その詳しい制御機構は明らかにされていませんでした。
そこで本研究では、胎盤系列の細胞を用いたさまざまなエピゲノム情報の網羅的解析手法を駆使し、その謎に迫りました。
研究手法と成果
共同研究グループはまず、マウスの胎盤系列と胎児系列おのおのの培養幹細胞である栄養膜幹細胞(TS細胞)[6]と胎性幹細胞(ES細胞)[6]を材料とし、両者におけるエピゲノム情報の違いをウェスタンブロット法(抗体を用いて特定のタンパク質を検出する方法)で調べました。その結果、TS細胞ではヒストンバリアント[4]であるH3.1またはH3.2(H3.1/H3.2)が有意に増加しており、加えてH3K9me3(ヒストンH3の9番目のリジン残基に対するトリメチル化修飾)も増加傾向にありました。小倉淳郎室長らはこれまでの研究で、初期発生期の胚ではH3.1/H3.2がH3K9me3の蓄積に重要であることを報告しています注1)。
そこで、TS細胞とES細胞におけるH3.1/H3.2とH3K9me3の局在をゲノム全体で比較するために、ChIP-seq解析[7]を行いました。その結果、TS細胞ではH3K9me3が特に集中している大きな領域が多数存在することが分かり、これらを「TSC-defined highly heterochromatinized domain(THD)」と名付けました(下図)。興味深いことに、THDではH3.1/H3.2も同様に大きなドメインを形成していました。THDは大きなもので100万塩基対以上にわたって存在することから、マクロなクロマチン構造に影響していることが予想されました。
そこで、クロマチンの高次構造を解析する手法であるATAC-seq解析[8]やHi-C解析[9]を行ったところ、THDが形成されている領域は特に安定的なクロマチン構造であることが分かりました。また、このTHDはTS細胞だけでなく、マウス初期発生期の胎盤系列の細胞やヒト胎盤細胞においても観察され、胎盤系列の細胞において広く重要な意味を持つことが示唆されました。
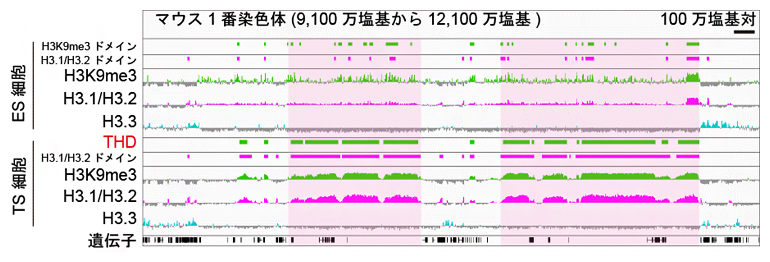
図 ES細胞とTS細胞を用いたH3K9me3とH3.1/H3.2のChIP-seq解析結果
マウス1番染色体の9,100万塩基から12,100万塩基までの部分におけるChIP-seq解析結果を可視化した。中心よりも上にシグナルが出ていれば濃縮(H3K9me3は緑、H3.1/H3.2はピンク、H3.3は水色)しており、下に出ていれば疎(灰色)になっていることを示している。ES細胞(上段)では小さなH3K9me3のドメインが点在していたが、TS細胞(下段)ではより大きなものが観察された(淡ピンク色四角で強調)。このTHDでは、H3.1/H3.2も同様に大きなドメインを形成していた。スケールバーは100万塩基対を示す。
次に、H3.1/H3.2とTHDの関係性を調べるため、TS細胞においてH3.1/H3.2をクロマチンに組み込む因子であるP150の発現量を低下させたところ、THDにおけるH3K9me3とH3.1/H3.2の両者が減少していました。また、P150の発現量が低下したTS細胞の遺伝子発現を調べたところ、TS細胞の幹細胞マーカー遺伝子であるCdx2やElf5などの発現は減少し、ES細胞の幹細胞マーカー遺伝子であるOct3/4の発現が上昇していました。これらの結果から、H3.1/H3.2はTHDを制御することで、TS細胞特異的な遺伝子発現を制御していることが明らかになりました。
最後に、THDの存在意義をより詳しく調べるため、体細胞核移植法(SCNT法)を行いました。SCNT法は分化した細胞の核を卵母細胞に移植することで、核を提供した細胞(ドナー細胞)の情報をリプログラミング(初期化)し、完全なクローン(コピー)動物を作出します。その成功率の低さには課題がありますが、その原因として、ドナー細胞が持つH3K9me3がクローン胚の発生を強力に阻害することが報告されています注2)。実際、TS細胞をドナー細胞としてSCNT法を行ったところ、その発生効率は著しく低下し、THDがリプログラミングに対して強い抵抗性を示すことが考えられました。
そこで、酵素的処理によってH3K9me3を人工的に取り除き、THDを破壊したところ、TS細胞由来クローン胚の発生効率は大きく向上し、胎盤系列の細胞に由来するクローンマウスを作出することに世界で初めて成功しました。これにより、THDがリプログラミングを阻害することで、胎盤細胞としての性質を維持させている可能性が示されました。
以上の結果から、胎盤の細胞では特徴的な大きなヘテロクロマチン構造が形成されており、これらが胎盤の個性に重要であることが明らかになりました。
- 注1)Yuki Hatanaka et al, Histone chaperone CAF-1 mediates repressive histone modifications to protect preimplantation mouse embryos from endogenous retrotransposons.PNAS., 2015
- 注2)Shogo Matoba et al, Embryonic Development following Somatic Cell Nuclear Transfer Impeded by Persisting Histone Methylation.Cell, 2014
今後の期待
胎盤系列と胎児系列の細胞分化は、最も初期の分化であることからこれまでも注目されてきました。胎盤系列への分化を制御する転写因子[10]や細胞内シグナル伝達経路などは既に明らかになっていましたが、本研究によってクロマチンの高次構造も同様に重要であることが示されました。今後は上記のような因子とTHDとの関係性を明らかにする必要があり、これらを通して胎盤発生についての理解が進むものと期待できます。
また、本研究で明らかにした大きなヘテロクロマチン構造は、ヒトでも特徴的な配置を示していました。このことから、将来的にはヒトにおいて妊娠中の胎盤異常の原因解明やその治療法の開発などにつながると期待できます。
補足説明
- 1.ヘテロクロマチン
クロマチン(DNA、RNA、タンパク質からなる核内の構造体)のうち、遺伝子発現が抑制され、常に凝縮した状態にある領域。 - 2.エピゲノム情報
DNA配列の変化によらず、遺伝子発現を制御する情報。特にDNAのメチル化修飾やヒストンタンパク質に対する翻訳後修飾を指すことが多い。 - 3.H3K9me3
ヒストンH3の9番目のリジン残基に対するトリメチル化修飾。結合タンパク質を介してヘテロクロマチンを形成する。 - 4.ヒストン、ヒストンバリアント
ヒストンは高塩基性のタンパク質で、酸性高分子であるDNAを自身に巻き付けることによって真核生物のゲノムDNAを核内に収納している。ヒストンには四つの主要な因子(H2A、H2B、H3、H4)が存在し、これらの8量体(2量体×4ヒストン)にDNA146塩基対が巻き付いたヌクレオソームを基本単位としている。ヒストンバリアントとは、基本的なヒストンとアミノ酸配列が異なった変異体を指す。基本的なヒストンを含むヌクレオソームと異なった構造・機能を示すものがある。 - 5.体細胞核移植法(SCNT法)
分化した細胞の核を卵母細胞に移植することで、核を提供した細胞(ドナー細胞)の情報をリプログラミング(初期化)し、完全なクローン(コピー)動物を作出する方法。SCNTはsomatic cell nucleus transferの略。 - 6.栄養膜幹細胞(TS細胞)、胎性幹細胞(ES細胞)
受精後3~5日目のマウス胚は胚盤胞と呼ばれるが、既に将来胎盤になる細胞(栄養膜)と胎児になる細胞(内部細胞塊)に分かれている。それぞれの細胞は専用培地で培養することで培養幹細胞を樹立でき、樹立されたものがTS細胞(胎盤系列)とES細胞(胎児系列)である。両細胞は胚盤胞に移植することによって、それぞれ胎盤と胎児の細胞に分化する能力を持つ。 - 7.ChIP-seq解析
ヒストン修飾が生じているゲノム領域を網羅的に解析する手法。目的のヒストン修飾があるクロマチンを、修飾特異的抗体によって生化学的に精製しDNAを回収する。その後、次世代シークエンサーによってそのDNAを解読する。 - 8.ATAC-seq解析
ゲノム全体でクロマチンの緩みや凝集を網羅的に解析する方法。マークを付けた短い2本鎖DNAをゲノムDNAに人工的に挿入させることで、クロマチン領域の凝集度合いを解析できる。 - 9.Hi-C解析
ゲノムの3次元構造を解析する方法。核内において、空間的に近接するゲノムDNA領域を網羅的に解析できる。 - 10.転写因子
DNAに配列特異的に結合するタンパク質で、プロモーターやエンハンサーなどの転写調節領域に結合し、RNAポリメラーゼによる遺伝子の転写を促進、あるいは抑制する。
共同研究グループ
理化学研究所
バイオリソース研究センター 遺伝工学基盤技術室
客員研究員 羽田 政司(はだ まさし)
(東京大学 定量生命科学研究所 病態発生制御研究分野 助教)
専任研究員 的場 章悟(まとば しょうご)
専任研究員 井上 貴美子(いのうえ きみこ)
専任技師 越後貫 成美(おごぬき なるみ)
テクニカルスタッフⅡ 廣瀬 美智子(ひろせ みちこ)
研修生 渡邉 奈穂美(わたなべ なおみ)
テクニカルスタッフⅡ 長谷川 歩未(はせがわ あゆみ)
大学院生リサーチ・アソシエイト 四方 大樹(しかた だいき)
室長 小倉 淳郎(おぐら あつお)
(開拓研究本部 小倉発生遺伝工学研究室 主任研究員)
生命機能科学研究センター 発生エピジェネティクス研究チーム
上級研究員 三浦 尚(みうら ひさし)
テクニカルスタッフⅠ 谷川 明恵(たにがわ あきえ)
チームリーダー 平谷 伊智朗(ひらたに いちろう)
東京大学 定量生命科学研究所
講師 中戸 隆一郎(なかと りゅういちろう)
助教 藤木 克則(ふじき かつのり)
教授 白髭 克彦(しらひげ かつひこ)
慶應義塾大学 分子生物学教室
助教 坂下 陽彦(さかした あきひこ)
東北大学 情報遺伝学分野
准教授 岡江 寛明(おかえ ひろあき)
教授 有馬 隆博(ありま たかひろ)
広島大学 原爆放射線医科学研究所
助教 三浦 健人(みうら けんと)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業特別研究員奨励費「マウス精子エピゲノム情報のプログラムによる初期胚発生制御機構の解明とその応用(研究代表者:羽田政司)」、同若手研究「ヒストンH3バリアントH3.3の量的操作による、体細胞核移植法の改善(研究代表者:羽田政司)」、文部科学省科学研究費補助金新学術領域研究「全能性プログラム:デコーディングからデザインへ(領域代表者:小倉淳郎、研究代表者:岡江寛明)」「遺伝子制御の基盤となるクロマチンポテンシャル(研究分担者:平谷伊智朗)」、科学技術振興機構(JST)戦略的創造研究推進事業CREST「潜在的不安定性から読み解くゲノム設計原理(研究代表者:平谷伊智朗)」、RIKEN Pioneering Projects「Genome building from TADs(研究分担者:小倉淳郎、平谷伊智朗)」による支援を受けて行われました。
原論文情報
- Masashi Hada, Hisashi Miura, Akie Tanigawa, Shogo Matoba, Kimiko Inoue, Narumi Ogonuki, Michiko Hirose, Naomi Watanabe, Ryuichiro Nakato, Katsunori Fujiki, Ayumi Hasegawa, Akihiko Sakashita, Hiroaki Okae, Kento Miura, Daiki Shikata, Takahiro Arima, Katsuhiko Shirahige, Ichiro Hiratani, and Atsuo Ogura, "Highly rigid H3.1/H3.2-H3K9me3 domains set a barrier for cell fate reprogramming in trophoblast stem ", Genes & Development, 10.1101/gad.348782.121
発表者
理化学研究所
バイオリソース研究センター 遺伝工学基盤技術室
理化学研究所 バイオリソース研究センター 遺伝工学基盤技術室
客員研究員 羽田 政司(はだ まさし)
室長 小倉 淳郎(おぐら あつお)
(開拓研究本部 小倉発生遺伝工学研究室 主任研究員)
 羽田 政司
羽田 政司
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
