理化学研究所(理研)環境資源科学研究センターケミカルバイオロジー研究グループの本山高幸専任研究員、近藤恭光専任研究員、清水猛研究嘱託、長田裕之グループディレクターらの研究チームは、農薬耐性のイネいもち病菌[1]に有効な化合物を作ることに成功しました。
本研究成果は、世界的に重要な病害であるイネいもち病の制御に貢献すると期待できます。
イネいもち病を制御するためにさまざまな農薬が開発されてきましたが、耐性菌の出現の問題があり、その防除が重要な課題になっています。特に、MBI-Dタイプの農薬は優れた効果を示していましたが、耐性菌が生じたために防除に使えなくなっていました。MBI-D耐性菌は、イネいもち病菌のシタロン脱水酵素(SDH1)の75番目のバリンがメチオニンに置換されるV75M変異により生じることが分かっていました。
今回、研究チームは理研独自の化合物アレイ[2]という技術により、SDH1のV75M変異酵素も強力に阻害できる化合物NPD13731を見いだしました。そして、NPD13731の構造の最適化により、MBI-D耐性菌を防除可能な化合物「メラビオスチン」を創製しました。
本研究は、科学雑誌『Journal of Agricultural and Food Chemistry』のオンライン版(3月2日)に掲載されました。
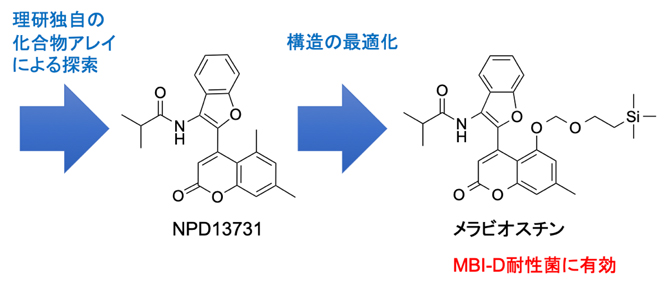
農薬耐性イネいもち病菌の防除化合物メラビオスチンの創製
背景
イネいもち病は世界的に重要な病害であり、その原因となるイネいもち病菌の制御は農業にとって重要なテーマです。イネいもち病菌がイネに感染するためには、メラニンという二次代謝産物[3]が必要です。そのため、イネいもち病菌のメラニン生合成酵素はイネいもち病を制御するための標的となっており、さまざまなメラニン生合成阻害剤(MBI)が農薬として開発されてきました。
MBIは病原菌の生育に対する毒性を示さずに病害防除が可能なことから、環境に優しい農薬で、MBI-R、MBI-D、MBI-Pの三種に分類されます。特に、MBI-Dは優れた効果を示す農薬として使われてきましたが、耐性菌の発生が大きな問題になっています。これまでに本山高幸専任研究員らは、MBI-D耐性菌の発生は標的酵素であるシタロン脱水酵素(SDH1/RSY1)の75番目のバリン(V)がメチオニン(M)に置換されるV75M変異によることを報告しています注1)。
一方、理研では、対象とするタンパク質の結合化合物をハイスループットで探索するための手法として、化合物アレイ技術を開発しています。また、化合物スクリーニングに応用可能な理研天然化合物バンクNPDepo[4]を設立しました。そこで、研究チームは化合物アレイ技術を利用して、MBI-D耐性菌に対しても有効なSDH1-V75M阻害剤の開発を目指しました。
- 注1)Naoki YAMADA, Takayuki MOTOYAMA, et.al. Enzymatic Characterization of Scytalone Dehydratase Val75Met Variant Found in Melanin Biosynthesis Dehydratase Inhibitor (MBI-D) Resistant Strains of the Rice Blast Fungus. Bioscience, Biotechnology, and Biochemistry, Volume 68, Issue 3, 1 January 2004, Pages 615-621,
研究手法と成果
研究チームはまず、野生型SDH1(SDH1-WT)およびMBI-D耐性SDH1(SDH1-V75M)の組換え酵素をそれぞれ調製し、理研天然化合物バンクNPDepoの29,893化合物に対して、SDH1-WTおよびSDH1-V75Mに結合するものを化合物アレイによって探索しました。その結果、9個の化合物が得られました。これらの中で、化合物NPD13731のSDH1-WTおよびSDH1-V75Mに対する50%阻害濃度(IC50)値[5]はそれぞれ8.4ナノモーラー(nM、1nMは10億分の1モーラー)および9.1nMであり、NPD13731が両方の酵素に対して同程度の高い阻害活性を示すことが分かりました(図1)。
比較対象として、市販のMBI-Dであるカルプロパミドの阻害活性を同じ条件下で調べたところ、SDH1-WTに対しては非常に高い阻害活性(IC50値は3.0nM以下)を示しましたが、SDH1-V75Mに対する阻害活性は大幅に低いことが分かりました(IC50値は100nM)。したがって、NPD13731を創薬過程の出発点となるリード化合物[6]として選択しました。
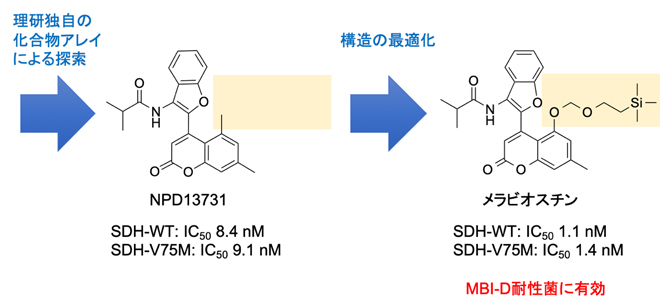
図1 MBI-D農薬耐性イネいもち病菌の防除化合物メラビオスチンの創製
化合物アレイにより、理研NPDepoの化合物の中からSDH1に結合する化合物を探索し、SDH-WTおよびSDH-V75Mを強力に阻害する化合物NPD13731を見いだした。さらに、NPD13731の構造の最適化を行い、MBI-D耐性菌にも有効な化合物であるメラビオスチンを創製した。
次に、NPDepoの化合物ライブラリーから、NPD13731の類似化合物5個を見いだしました。これら類似化合物のSDH1-WTおよびSDH1-V75Mに対する阻害活性を評価したところ、NPD13731よりも高い阻害活性を示す化合物はありませんでしたが、化合物の構造と阻害活性の相関に関する情報を得ることができました。NPD13731のクマリン[7]部位とアミド部位(-CONH-)の修飾が、阻害活性に影響を与えることが示唆されました(図2)。さらに、上記5個のNPD13731類似化合物とは異なる市販のNPD13731類似化合物11個の阻害活性を評価したところ、クマリン部位でのNPD13731タイプの修飾がSDH1-V75Mを阻害するのに最適であることが示唆されました。
さらに、NPD13731のさまざまな類似化合物を有機合成し、それらの阻害活性を評価しました。クマリン部位を固定して、それ以外の部分を改変したところ、阻害活性を示すものはあったものの、合成した全化合物の中でNPD13731よりも高い阻害活性を示すものはありませんでした。これらの結果をまとめると、アミド部位およびベンゾフラン[8]部位での修飾は、NPD13731タイプの構造がSDH1-WTとSDH1-V75Mの両方の活性を阻害するのに最適であることが示唆されました(図2)。
次に、クマリン部位を改変しました。NPD13731の5位のメチル基(-CH3)を水酸基(-OH)に変換すると、阻害活性が低下しました。対照的に、SEM基[9]で保護された水酸基を持つ誘導体(メラビオスチン、図1右)は阻害活性が高くなりました(SDH-WTおよびSDH-V75Mに対するIC50値はそれぞれ1.1nMおよび1.4nM)(図2)。他にもさまざまなクマリン部位を改変した化合物を合成しましたが、メラビオスチンよりも高い阻害活性を示す化合物はありませんでした。
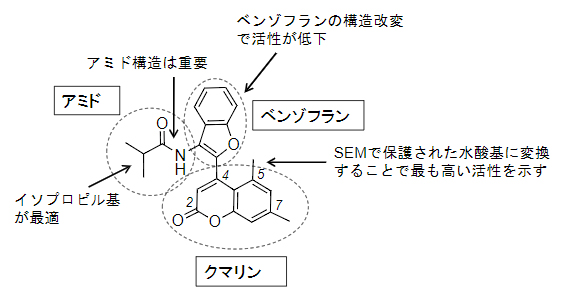
図2 NPD13731の構造活性相関
NPD13731の類似化合物のSDH1阻害活性を解析することにより、構造活性相関を明らかにした。アミド部位とベンゾフラン部位はNPD13731タイプが最適であり、クマリン部位の5位のメチル基(-CH3)をSEM基で保護された水酸基にすると最も高い阻害活性が得られた。
また、SDH1とNPD13731との結合をドッキングシミュレーション[10]で予測しました。本山高幸専任研究員らが既に報告しているSDH1とカルプロパミドの複合体の構造注2)をドッキングシミュレーションに使用しました。その結果、NPD13731がSDH1に結合でき、耐性菌が生じる原因となるSDH1のV75(75番目のバリン)がNPD13731のベンゾフラン部位と疎水的に相互作用することが示唆されました(図3右)。一方、カルプロパミドはフェニル環(-C6H5)とメチル基でV75と相互作用します(図3左)。また、カルプロパミドとSDH1の結合においては、アミド部位が2個の水分子を介した水素結合[11]をしていることが明らかになっています。一方、NPD13731とSDH1との間の水素結合には、水分子は結合に関与せず、水素結合の様式はカルプロパミドとNPD13731の間で異なることが示唆されました。
なお、同様の方法でSDH1とメラビオスチンとの結合をドッキングシミュレーションで予測することは不可能でした。SDH1とメラビオスチンとの詳細な結合様式を分析するには、X線結晶構造解析[12]などの別のアプローチが必要であると考えられます。
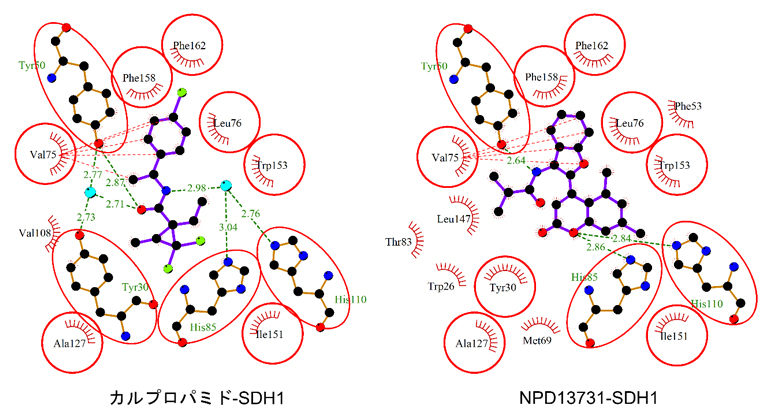
図3 ドッキングシミュレーションによるSDH1と阻害剤の結合の予測
ファンデルワールス相互作用を赤色の波線、水素結合を緑色の波線で示した。水分子は水色の球で示した。
- 左:カルプロパミドは、SDH1のフェニル環(-C6H5)とメチル基(-CH3)でSDH1のVal75とファンデルワールス相互作用する。アミド部位(-CONH-)が2個の水分子を介した水素結合をしている。
- 右:NPD13731のベンゾフラン部位は、SDH1のVal75と疎水的にファンデルワールス相互作用する。水素結合には、水分子は関与しない。
最後に、MBI-D耐性菌に対するメラビオスチンの阻害活性を評価しました。カルプロパミドで処理した場合は、30マイクロモーラー(μM、1μMは100万分の1モーラー)の濃度で感受性菌株のメラニン生合成を阻害しましたが、耐性菌株の場合は100μMまでの濃度ではメラニン生合成を阻害できませんでした(図4中段)。対照的に、メラビオスチンは30μMの濃度で両方の菌株でメラニン生合成を阻害できました(図4下段)。
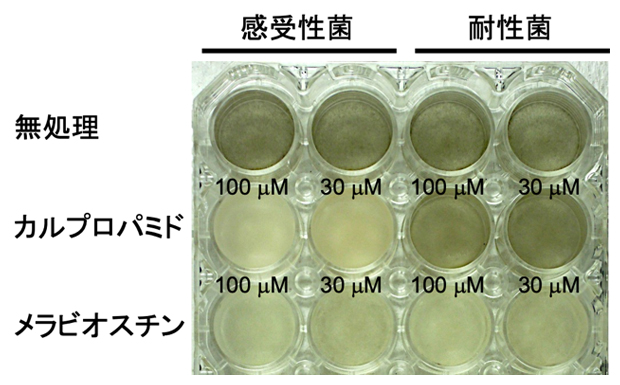
図4 メラビオスチンのメラニン生合成の阻害活性評価
イネいもち病菌をメラビオスチンの存在下で培養し、メラニン形成の阻害活性を評価した。メラニン形成すると黒くなる。市販のMBI-Dであるカルプロパミドをコントロールとして用いた。
さらに、イネいもち病菌のイネへの感染抑制におけるメラビオスチンの効果を解析しました。イネにカルプロパミド処理を施した場合、10μMで感受性菌株の感染を完全に抑制しましたが、耐性菌株の感染を抑制することはできませんでした。対照的に、メラビオスチンは10μMの濃度で両方の菌株による病斑形成を抑制できました。
- 注2)Masayoshi Nakasako, Takayuki Motoyama,et.al. Cryogenic X-ray Crystal Structure Analysis for the Complex of Scytalone Dehydratase of a Rice Blast Fungus and Its Tight-Binding Inhibitor, Carpropamid: The Structural Basis of Tight-Binding Inhibition. Biochemistry 1998, 37, 28, 9931–9939(1998)
今後の期待
理研独自の技術である化合物アレイにより、SDH1のV75M変異酵素も強力に阻害できる化合物NPD13731を見いだし、構造の最適化により、MBI-D耐性菌を防除することが可能な化合物メラビオスチンを創製することに成功しました。
メラビオスチンは、イネいもち病菌の生育を阻害することなく、メラニンの生合成酵素の一つSDH1を強力に阻害し、イネいもち病菌の感染を抑制することができます。また、通常のイネいもち病菌だけではなく、MBI-D耐性菌の感染も同様に抑制できることから、新たなイネいもち病防除薬剤あるいはそのリード化合物として期待できます。
今回の研究成果は、環境に優しい化合物によるイネいもち病の制御を可能にし、2016年に国際連合が発表した「持続可能な開発目標(SDGs)[13]」にある「2 飢餓をゼロに」や「15 陸の豊かさも守ろう」に貢献するものです。
補足説明
- 1.イネいもち病菌
学名はPyricularia oryzae(Magnaporthe oryzae)。病原性の糸状菌(かび)の一種。イネにいもち病を引き起こす。いもち病はイネにとって最重要病害であり、大幅な減収と食味の低下を引き起こす。 - 2.化合物アレイ
小分子化合物をスライドガラスに固定化したもの。超ハイスループットで、特定のタンパク質に結合する化合物を探索できる。 - 3.二次代謝産物
生物体を構成、維持する上で重要な物質を一次代謝産物と呼ぶ。一方、生育そのものには必要とされない代謝産物を二次代謝産物と呼び、抗生物質などが含まれる。 - 4.理研天然化合物バンクNPDepo
天然化合物(特に放線菌や糸状菌の二次代謝産物)を収集した天然化合物ライブラリーの構築や管理などを行う組織。 - 5.50%阻害濃度(IC50)値
化合物の有効度を示す値であり、どの濃度で活性を半分(50%)阻害できるかを示す。 - 6.リード化合物
創薬過程の出発点となる新薬候補化合物のこと。 - 7.クマリン
桜の葉に代表される植物の芳香成分の一種。 - 8.ベンゾフラン
ベンゼン環とフラン環が一辺を共有して縮合した複素環式化合物のこと。 - 9.SEM基
2-(トリメチルシリル)エトキシメチル基。有機合成化学で用いられる保護基の一種で、(CH3)3SiCH2CH2OCH2-と表記される1価の置換基のこと。 - 10.ドッキングシミュレーション
主に小分子をあるタンパク構造に結合させ、結合力を推定するために使用するシミュレーション技術。 - 11.水素結合
二つの電気陰性度の大きい原子(N、O、F、Clなど)の間に水素原子(H)が入ってできる結合。 - 12.X線結晶構造解析
散乱されたX線を観測することで、物質の中の電子の分布、すなわち物質の3次元構造を知る手法。 - 13.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。
研究チーム
理化学研究所 環境資源科学研究センター ケミカルバイオロジー研究グループ
専任研究員 本山 高幸(もとやま たかゆき)
専任研究員 近藤 恭光(こんどう やすみつ)
研究嘱託 清水 猛(しみず たけし)
研究嘱託(研究当時) 林 輝雄(はやし てるお)
テクニカルスタッフ 本田 香織(ほんだ かおり)
テクニカルスタッフ(研究当時) 内田 素子(うちだ もとこ)
グループディレクター 長田 裕之(おさだ ひろゆき)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域研究(研究領域提案型)「プロテオミクスをベースにした化学シグナル解析技術開発(研究代表者:長田裕之)」「ユビキチン機能制御のためのケミカルバイオロジー(研究代表者:吉田稔)」、同基盤研究(C)「「共生糸状菌」の二次代謝産物:ゲノムからの発掘と生物間相互作用における役割の解明(研究代表者:本山高幸)」「ケミカルアレイによる膜結合蛋白質発現細胞を用いたリガンド探索手法の開発(研究代表者:近藤恭光)」「「共生糸状菌」からの二次代謝産物発掘および生物間相互作用における役割の解明(研究代表者:本山高幸)」、同基盤研究(A)「ケミカルバイオロジー研究が解き明かすテヌアゾン酸の3W1H(研究代表者:長田裕之)」、農林水産省「農林水産業・食品産業科学技術研究推進事業」および生物系特定産業技術研究支援センター「イノベーション創出強化研究推進事業」の研究課題「植物保護を目指した天然物ケミカルバイオロジー研究(研究統括:長田裕之)」による支援を受けて行われました。
原論文情報
- Takayuki Motoyama, Yasumitsu Kondoh, Takeshi Shimizu, Teruo Hayashi, Kaori Honda, Motoko Uchida, and Hiroyuki Osada, "Identification of Scytalone Dehydratase Inhibitors Effective against Melanin Biosynthesis Dehydratase Inhibitor-Resistant Pyricularia oryzae", Journal of Agricultural and Food Chemistry, 10.1021/acs.jafc.1c04984
発表者
理化学研究所
環境資源科学研究センター ケミカルバイオロジー研究グループ
専任研究員 本山 高幸(もとやま たかゆき)
専任研究員 近藤 恭光(こんどう やすみつ)
研究嘱託 清水 猛(しみず たけし)
グループディレクター 長田 裕之(おさだ ひろゆき)
 本山 高幸
本山 高幸
 近藤 恭光
近藤 恭光
 清水 猛
清水 猛
 長田 裕之
長田 裕之
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
