理化学研究所(理研)環境資源科学研究センター天然物生合成研究ユニットの高橋俊二ユニットリーダー、ニュー・ノック・クウィン・ヴォ特別研究員、技術基盤部門生命分子解析ユニットの野村勇太特別研究員(研究当時、現埼玉大学大学院理工学研究科生命科学部門分子生物学領域助教)らの研究チームは、細菌のタンパク質データベースを用いてテルペノイド[1]を生産する酵素遺伝子を探索し、ファルネシル二リン酸(FPP)からドリメノール(二環性のドリマン型セスキテルペン[1])を効率的に生産させる海洋細菌由来の新しいセスキテルペン合成酵素を見いだしました。
本研究成果は、構造が複雑なために合成が難しいテルペノイドの生産を効率化するとともに、新たな生理活性を持つ天然化合物の創出につながると期待できます。
これまで、細菌由来のテルペン[1]合成酵素の利用例は少なく、微生物起源の新しい酵素遺伝子を探索し、有用化合物生産に活用することは重要です。
今回、研究チームは、海洋細菌Aquimarina spongiae由来のドリメノール合成酵素DMS(AsDMS)のタンパク質構造モデリング[2]と部位特異的変異導入[3]を行い、植物から広く発見されているテルペン合成酵素とは全く異なる機能ドメインを持つドリメノール合成酵素を発見しました。AsDMSは、異なる酵素起源から進化したハロ酸デハロゲナーゼ(HAD)様ヒドロラーゼ[4]ドメインとテルペン合成酵素βドメイン[5]から構成される新しい構造を持っており、今後新たなテルペン合成酵素の発見とその活用が期待できます。
本研究は、科学雑誌『ACS Chemical Biology』(4月21日付)に掲載されました。
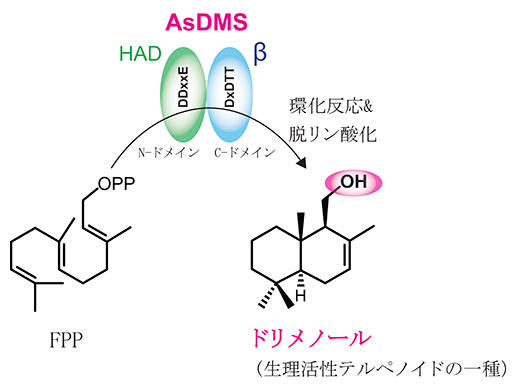
ドリメノールを高効率で生産する海洋細菌由来の新しい酵素(AsDMS)
背景
テルペノイドは、自然界でも最も複雑な構造を持つ化合物の一群です。植物由来のテルペノイド生合成遺伝子は、医薬品、農薬、抗菌剤、香料の生産に広く活用されています。細菌は天然物の宝庫であることが知られていますが、細菌由来のテルペン合成酵素の利用例は少なく、微生物起源の新しい酵素遺伝子を探索し、有用化合物生産に活用することは重要です。
セスキテルペンは、炭素数15からなる化合物であり、医薬品や香料として広く使われています。「ドリメノール」は植物や糸状菌が持つドリマン型セスキテルペンの一種で、生合成に関わる酵素遺伝子が同定されていますが、細菌由来のテルペン合成酵素遺伝子は未解明でした。
研究手法と成果
研究チームは、糸状菌Aspergillus oryzaeから得られたセスキテルペン合成酵素(AstC)のアミノ酸配列を基に、類似の酵素遺伝子を細菌のタンパク質データベースから探索しました。さらにアミノ酸配列解析により、テルペン合成酵素に共通する重要なDDxxEとDxDTTというモチーフ[6]が保存されている六つの候補を選び出しました。候補は全て、Aquimarina、Flavivirga、Rhodobacteraceaeなどの海洋細菌に由来していました。
これら酵素遺伝子の機能を解析するため、人工合成DNAを用いて発現ベクターを調製し、大腸菌で酵素を発現させました。精製酵素と複数の基質を用いて反応解析を行った結果、五つの酵素がファルネシル二リン酸(FPP)からドリメノールを生産するドリメノール合成酵素(DMS)であることが判明しました。このうち、Aquimarina spongiae由来のDMS(AsDMS)は、報告されている植物由来のDMSと比較して高い触媒活性を示しました。この結果は、今回見いだした酵素のうち、AsDMSがドリメノール生産を迅速かつ低コストで実現するために最適であることを示しています。
AsDMSの反応機構を理解するため、AsDMSの構造モデルを構築したところ、基質(FPP)は酵素のN末端側とC末端側のタンパク質構造の空間に結合しました。触媒活性を担う必須領域を検証するために、活性中心に存在すると推定されるアミノ酸に部位特異変異を導入した酵素を調製し、反応を解析しました。その結果、この酵素はDDxxEとDxDTTの二つのモチーフが活性中心を構成しており、FPPからドリメニル二リン酸(中間体)への環化とドリメニル二リン酸からの脱リン酸化により、ドリメノールを生成する連続した反応に関わることが示唆されました。
また、AsDMSの各ドメインの進化起源を調べるために、系統樹解析を行いました。その結果、ハロ酸デハロゲナーゼ(HAD)様ヒドロラーゼ、およびテルペン合成酵素βから進化し、二つの機能ドメインが融合することで構築された新しいテルペン合成酵素であると予想されました(図)。このようなドメインの組み合わせは既知のテルペン合成酵素では例がなく、将来、新しいテルペノイドを作るための重要な知見となります。
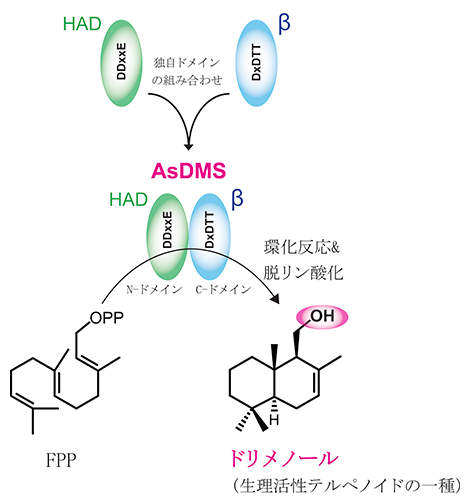
図 海洋細菌由来の新しいドリメノール合成酵素のドメイン構成
Aquimarina spongiae由来のDMS(AsDMS)は、N-ドメインに位置するDDxxEモチーフおよびC-ドメインに位置するDxDTTモチーフを利用し、ファルネシル二リン酸(FPP)からドリメノールへの環化反応と脱リン酸化反応を触媒する活性を持つ。AsDMSは、進化過程でハロ酸デハロゲナーゼ(HAD)様ヒドロラーゼドメインとテルペン合成酵素のβドメインが融合した新しい酵素である。
今後の期待
本研究では、テルペン合成酵素をゲノムデータベースから探索し、合成DNAを大腸菌で発現させることによって、海洋細菌由来の新しいドリメノール合成酵素(AsDMS)を見いだすことに成功しました。AsDMSは植物由来の既知酵素よりも酵素活性が強いことから、ドリメノール高生産および生物活性の評価が期待されます。
また、AsDMSはこれまでに報告がない機能ドメインの組み合わせから構成される新しい酵素です。今後同じ組み合わせを持つ酵素を探索することにより、新たな機能を持つテルペン合成酵素の発見が期待できます。
本研究成果は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)[7]」のうち「3.すべての人に健康と福祉を」に大きく貢献するものです。
補足説明
- 1.テルペノイド、セスキテルペン、テルペン
テルペノイドは、炭素5個のイソプレンを構成単位とする天然有機化合物の総称。テルペンとも呼ばれる。医薬品、農薬、抗菌剤、香料、食品添加物として使用されている。セスキテルペンは、イソプレンが3個つながった炭素15個のファルネシル二リン酸(FPP)から誘導される化合物であり、環化の様式によって多様な構造が存在する。 - 2.タンパク質構造モデリング
既知のタンパク質の構造をもとにして、自動計算ツールによりタンパク質の立体構造を予測する方法。 - 3.部位特異的変異導入
タンパク質を構成する特定のアミノ酸の改変を目的として、酵素遺伝子に変異を導入する実験手法。 - 4.ハロ酸デハロゲナーゼ様ヒドロラーゼ
ハロ酸デハロゲナーゼ様ヒドロラーゼスーパーファミリー(haloacid dehalogenase-like hydrolase superfamily)に属する酵素。酵素の機能の多くは明らかにされていないが、その一つに脱リン酸化活性が知られている。 - 5.テルペン合成酵素βドメイン
テルペン合成酵素はα、β、γドメインの組み合わせで構成される。βドメインはテルペン合成反応に関わるタンパク質構造の一つ。 - 6.モチーフ
酵素反応に重要なアミノ酸配列で、類似の機能を持つ酵素間で保存された領域。 - 7.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された、持続可能でよりよい世界を目指す国際目標。17のゴールおよび169のターゲットで構成されており、国連加盟193か国が、2016年から2030年の15年間でこれらを達成することを目標としている。
研究チーム
理化学研究所 環境資源科学研究センター
天然物生合成研究ユニット
ユニットリーダー 高橋 俊二(タカハシ・シュンジ)
特別研究員 Nhu Ngoc Quynh Vo(ニュー・ノック・クウィン・ヴォ)
テクニカルスタッフⅠ 高木 海(タカギ・ヒロシ)
技術基盤部門 生命分子解析ユニット
特別研究員(研究当時) 野村 勇太(ノムラ・ユウタ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域研究(研究領域提案型)「テルペノイド生産特化型放線菌生合成プラットフォームの構築と新規二次代謝産物の創出(研究代表者:高橋俊二)」「放線菌代謝ロジックに基づく有用物質生産基盤の構築と未知生合成遺伝子の機能解明(研究代表者:高橋俊二)」、同基盤研究(A)「天然化合物の多様性拡張を志向した生合成分子基盤の解明(研究代表者:高橋俊二)」の支援を受けて行われました。
原論文情報
- Vo, Nhu Ngoc Quynh; Nomura, Yuhta; Kinugasa, Kiyomi; Takagi, Hiroshi; Takahashi, Shunji, "Identification and Characterization of Bifunctional Drimenol Synthases of Marine Bacterial Origin", ACS Chemical Biology, 10.1021/acschembio.2c00163
発表者
理化学研究所
環境資源科学研究センター 天然物生合成研究ユニット
ユニットリーダー 高橋 俊二(タカハシ・シュンジ)
特別研究員 Nhu Ngoc Quynh Vo(ニュー・ノック・クウィン・ヴォ)
技術基盤部門 生命分子解析ユニット
特別研究員(研究当時) 野村 勇太(ノムラ・ユウタ)
(現 埼玉大学大学院 理工学研究科 生命科学部門 分子生物学領域 助教)
 Nhu Ngoc Quynh Vo
Nhu Ngoc Quynh Vo
 野村 勇太
野村 勇太
 高橋 俊二
高橋 俊二
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
