理化学研究所(理研)環境資源科学研究センター 技術基盤部門 質量分析・顕微鏡解析ユニットの豊岡 公徳 上級技師、後藤 友美 テクニカルスタッフⅡ、平井 優美 ユニットリーダーらの研究チームは、最先端の電子顕微鏡技術を駆使し、シロイヌナズナの側部根冠[1]ではグルコシノレート[2]の加水分解酵素(β-グルコシダーゼ[3])が、小胞体(ER)[4]から分化し膨らんだ「ERボディ[5]」と呼ばれる細胞小器官により、小胞体からゴルジ体[4]を経由せずに、直接液胞[4]へ輸送されることを明らかにしました。
本研究成果は、植物の成長、根圏の生体防御や土壌微生物との共生関係などの解明に貢献すると期待できます。
これまでシロイヌナズナの葉では、ERボディ内のβ-グルコシダーゼと液胞内のグルコシノレートは、食害などによって液胞が壊れると混ざり合い、病虫害忌避物質が放出されることが明らかになっていましたが、根における仕組みはよく分かっていませんでした。
今回、研究チームは高圧凍結技法[6]と広域電子顕微鏡撮像法を用いて、シロイヌナズナ側部根冠に多数のERボディが存在することを見いだしました。これらのERボディと液胞の接触部位を、高圧凍結技法と光-電子相関顕微鏡法(CLEM法)[7]により可視化したところ、ERボディが液胞に接触・突出する様子と液胞が崩壊する様子が捉えられました。従って、β-グルコシダーゼはERボディにより液胞へ恒常的に輸送され、液胞内のグルコシノレートと反応し、液胞が崩壊することで病虫害忌避物質が根圏に放出されると考えられます。
本研究は、科学雑誌『Plant & Cell Physiology』オンライン版(1月7日付)に掲載されました。
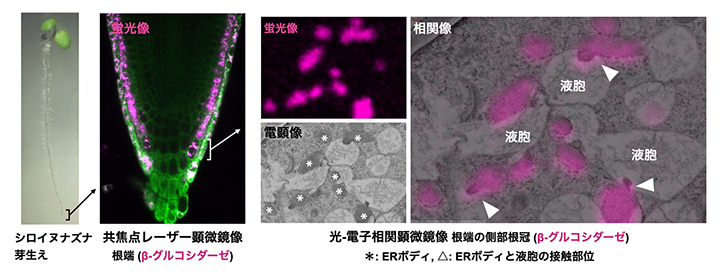
側部根冠細胞でβ-グルコシダーゼを含むERボディが液胞と接触した決定的瞬間の写真
背景
キャベツやブロッコリー、ワサビ、シロイヌナズナなどアブラナ科の植物には、病虫害忌避物質として、また発がんの予防物質として知られる「グルコシノレート(からし油配糖体)」という硫黄原子を含む特化代謝産物[8]と、その加水分解酵素である「β-グルコシダーゼ」が多量に含まれています。
シロイヌナズナの葉では、β-グルコシダーゼの一種であるPYK10は小胞体(ER)から分化し膨らんだ「ERボディ」と呼ばれる細胞小器官に、グルコシノレートは液胞に蓄積されています。傷害や食害によって液胞が壊れると、PYK10とグルコシノレートが混ざり合い、防虫効果を持つ揮発性成分(からし油:病虫害忌避物質)が生成されるという、病虫害に対する防御機構がこれまでに明らかになっています。一方、シロイヌナズナの根にもPYK10がERボディに多量に含まれることから、葉と同様に病虫害忌避物質が根圏に放出されると考えられてきましたが、その仕組みは分かっていませんでした。
根の先端である根端組織は、土壌のなかで最外層の根冠[1]と側部根冠の剥離を繰り返し、プログラム細胞死[9]を起こしながら土の中へ伸長します。これまで、根端組織は主に蛍光タンパク質や蛍光試薬を用いて解析されてきましたが、光学顕微鏡(光顕)では微細な構造までは捉えることができませんでした。また、電子顕微鏡(電顕)による微細構造解析も行われてきましたが、観察範囲が限られ、また、試料を常法の化学薬品で固定する方法では、細胞内物質の流出や細胞構造の変形などが起こり、観察された構造は生きた状態とは程遠いものでした。
研究チームは、シロイヌナズナなどのモデル植物を中心とした生物試料を用いて、さまざまな顕微鏡解析の技術検討・開発を長年にわたり行ってきました。具体的には、試料を高圧下で液体窒素により瞬時に凍結固定することで高い時間分解能で電顕観察する高圧凍結技法や、高解像度で広領域を撮像する電顕システム、蛍光を放つ同一箇所を電顕で観察する光-電子相関顕微鏡法(CLEM法)、3次元の微細構造を捉える電顕撮像法などが挙げられます。
研究手法と成果
研究チームはまず、アブラナ科のシロイヌナズナの芽生えを用いて、高圧凍結技法により調製した根端全体の高解像度広域電顕像を撮影したところ、側部根冠と呼ばれる領域に2~4マイクロメートル(μm、1μmは1,000分の1mm)のERボディが多数存在することを見いだしました(図1A)。ERボディの形態と機能を調べるために、連続断面走査電顕法(連続断面SEM法)[10]により3次元解析したところ、ERボディは細長いソーセージのような構造であることが分かりました(図1B)。また、根端全体の輪切りおよび縦方向の断面の高解像度広域電顕像中のERボディに印を付けたところ、ERボディは側部根冠にのみ存在し、液胞と高頻度で接触していることが分かりました(図1C)。
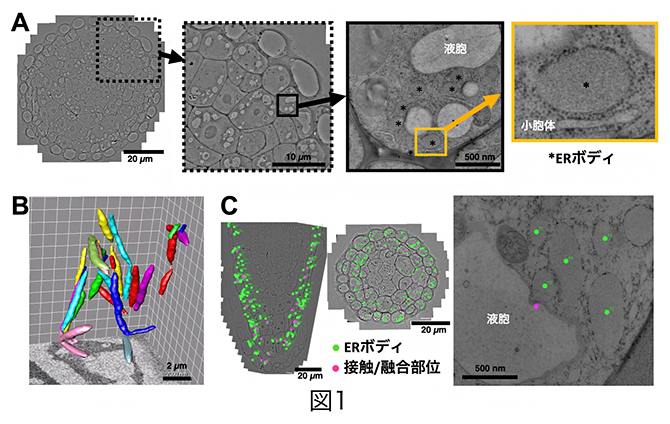
図1 シロイヌナズナ根端のERボディの形態と分布
- A高解像度広域電顕撮像技術により、シロイヌナズナ根端に多数のERボディが存在することを発見した。
- B連続断面走査電顕法によるERボディの3次元再構築像。ソーセージのような構造をしている。
- C根端の縦方向(左)および輪切り(右)断面の高解像度広域電顕像。ERボディ様構造に緑の点で印を付けて分布を調べると、側部根冠組織にのみ多数存在していた。側部根冠組織の中層細胞で、ERボディと液胞が高頻度で接触(ピンクの点)していることを発見した。
次に、葉においてERボディに含まれる主要酵素である小胞体残留シグナル[11]を持つPYK10に、赤色蛍光タンパク質でラベルした形質転換シロイヌナズナを用いて、その根端を高圧凍結技法とCLEM法を組み合わせて解析しました(図2)。その結果、PYK10の赤色蛍光タンパク質は側部根冠内層および中層細胞のERボディに存在し、側部根冠の中層から最外層の細胞にかけてERボディと液胞が高頻度で接触し、液胞内に突出していることが明らかになりました(図2B矢頭)。PYK10はゴルジ体やその他の細胞小器官には局在しないことから、側部根冠のERボディはPYK10を小胞体からゴルジ体を経由せずに、直接液胞へ輸送していることが分かりました。
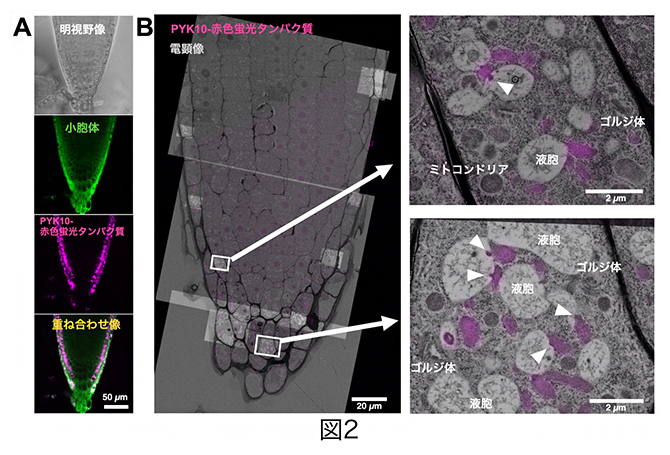
図2 共焦点レーザー顕微鏡とCLEM法によるPYK10の局在解析
- A赤色蛍光タンパク質でラベルしたPYK10形質転換シロイヌナズナの根端の共焦点レーザー顕微鏡像。PYK10は側部根冠にのみドット状で分布していた。
- B光-電子相関顕微鏡法(CLEM法)により、PYK10-赤色蛍光タンパク質を含むERボディが液胞へ接触し、液胞内へ突出する様子を可視化した。
さらに、高圧凍結技法による根端の超微細構造解析の結果、液胞膜の一部が崩壊し、液胞内の物質が細胞質内へ漏れ出る様子を電顕で捉えました(図3)。
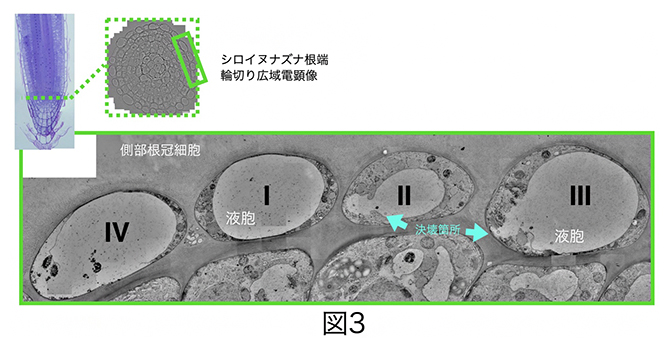
図3 側部根冠最外層細胞の超微細構造
側部根冠最外層において、液胞がI→II→III→IVの順で崩壊する様子を捉えた。
以上の結果から、側部根冠では内層の細胞からPYK10を含むERボディが形成されはじめ、ERボディは中層から最外層の細胞でPYK10の液胞への輸送に恒常的に関与し、そのPYK10と液胞内グルコシノレートが反応し、液胞が崩壊することで、病虫害忌避物質が根圏に放出すると考えられます(図4)。
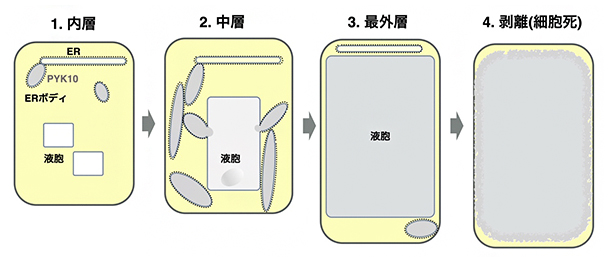
図4 側部根冠ERボディによるPYK10液胞輸送のモデル
側部根冠の内層からPYK10を含むERボディが形成されはじめ(1)、中層でERボディと液胞が融合し(2)、ERボディは液胞が大きくなる最外層ではほとんどなくなる(3)。最終的に液胞が崩壊し、プログラム細胞死を起こす(4)。
これまで、ERボディ内のβ-グルコシダーゼと液胞内のグルコシノレートは物理的損傷などにより会合する、または、高塩濃度などの環境ストレスを受けるとERボディと液胞が融合すると考えられてきましたが、植物の成長過程で恒常的に液胞へ輸送されていることが初めて明らかになりました。
今後の期待
本研究成果は、植物の根の成長、根圏の生体防御や土壌微生物との共生関係などの解明に貢献すると期待できます。例えば、小さいERボディ様の構造体が、シロイヌナズナ以外のアズキやヒマなどの植物においてプログラム細胞死を起こす細胞に存在し、小胞体残留シグナルを持つ分解酵素の存在と関連があることが分かっています。今後は、側部根冠組織のプログラム細胞死を誘導する制御因子とERボディとの関係、ERボディと液胞崩壊の関係性を詳しく調べることで、ERボディと植物の形態形成の過程が解明されると考えられます。
研究チームがこれまで技術開発してきた高圧凍結技法、広域電子顕微鏡撮像法、CLEM法を組み合わせた顕微鏡解析技術は、蛍光タンパク質や蛍光分子の細胞内局在や細胞内輸送の解明に大いに役立つと期待できます。
さらに今回の研究は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)[12]」のうち「2.飢餓をゼロに」と「15.陸の豊かさも守ろう」に大きく貢献する成果です。
補足説明
- 1.側部根冠、根冠
根冠は植物の根の先端を覆うキャップ状の組織で、中央部分のコルメラと周辺部分の側部根冠とから成る。側部根冠の最外層において、上の方からプログラム細胞死が起き、コルメラの最外層とともに剥離する。 - 2.グルコシノレート
主にアブラナ科植物によって生産される特化代謝産物。からし油配糖体とも呼ばれ、β-グルコシダーゼによって加水分解されると、防虫効果や発がん抑制作用を持つイソチオシアネート(からし油)などの揮発性物質に変換される。 - 3.β-グルコシダーゼ
β-グルコシド(糖)結合を切断する酵素。糖が結合した化合物から糖を遊離させる働きがある。例えば、生きているワサビは、糖が結合した状態で辛み成分を保持している。ワサビをすりつぶすと、β-グルコシダーゼの働きにより辛み成分と糖が遊離し、辛み成分が揮発性になる。PYK10(別名:BGLU23)はβ-グルコシダーゼの一種。 - 4.小胞体(ER)、ゴルジ体、液胞
小胞体はタンパク質を合成するための細胞小器官。ゴルジ体は、タンパク質の翻訳後修飾や仕分け、脂質の合成を行う。植物では、積み重なった層板構造をしている。液胞は水分や栄養、特化代謝産物の貯蔵、不要物の分解など多様な機能を果たし、根や葉などの成長と発生に重要な役割を果たす。一般的に植物では、タンパク質は小胞体からゴルジ体を経由して細胞外に分泌、または小胞体からゴルジ体を経由して液胞へ輸送される。ERはEndoplasmic Reticulumの略。 - 5.ERボディ
シロイヌナズナなどアブラナ科に存在する、小胞体から分化した5~10μmほどの楕円形をした細胞小器官で、β-グルコシダーゼを大量に蓄積する。植物細胞では小胞体から派生するERボディ様の細胞小器官が存在することが分かっている。 - 6.高圧凍結技法
高圧下では水の融点が低下し、氷晶形成が常圧下に比べて起こりにくいという現象に基づき開発された方法。高圧凍結装置を使うことで、物理学的に2,100Bars(大気圧の約2,000倍)の高圧下で、組織・細胞内に氷晶を形成させずに液体窒素で凍結できる。植物細胞は、原形質流動により高速で動く細胞小器官や小胞などを含むため、生きた状態に近い電顕像を撮影するには、ミリ秒で凍結できる高圧凍結技法での固定に限られる。 - 7.光-電子相関顕微鏡法(CLEM法)
光学顕微鏡と電子顕微鏡で同一試料の同一箇所を撮像し、その相関を得る方法。研究チームでは、CLEMシステムの開発や試料調製法の技術検討を進めている。CLEMはCorrelative Light and Electron Microscopyの略。 - 8.特化代謝産物
生物体を構成、維持する上で必須で生物種によらず共通の物質を一次代謝産物、生物種に固有で生育に必須ではないが重要な役割を果たしていると考えられている物質を特化代謝産物と呼ぶ。二次代謝産物とも呼ぶ。 - 9.プログラム細胞死
動物や植物の発生過程で、組織や器官を形成する際に特定の細胞が一定のタイミングで自殺する現象。植物では、導管形成や病原菌感染時などに引き起こされる。アポトーシスともいう。 - 10.連続断面走査電顕法(連続断面SEM法)
樹脂に埋めた生物試料を、走査電子顕微鏡内に設置したダイヤモンドナイフを使って自動切削と自動撮像を繰り返し、細胞全体や組織の3次元構造を高い分解能で撮像する方法。SEMはScanning Electron Microscopeの略。 - 11.小胞体残留シグナル
タンパク質の細胞内局在化情報を担うアミノ酸配列のうち、小胞体に局在化するためのシグナル配列。KDELまたはHDEL配列。 - 12.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。
研究チーム
理化学研究所 環境資源科学研究センター 技術基盤部門
質量分析・顕微鏡解析ユニット
上級技師 豊岡 公徳(トヨオカ・キミノリ)
テクニカルスタッフⅡ 後藤 友美(ゴトウ・ユウミ)
テクニカルスタッフⅡ(研究当時)橋本 恵(ハシモト・ケイ)
テクニカルスタッフⅡ 若崎 眞由美(ワカザキ・マユミ)
技師 佐藤 繭子(サトウ・マユコ)
ユニットリーダー 平井 優美(ヒライ・マサミ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業若手研究(A)「生体顕微マルチスケールマッピング:高圧凍結技法の高度化と広域超微形態解析法の開発(研究代表者:豊岡公徳)」、同基盤研究(C)「高圧凍結技法と相関アレイトモグラフィーで植物細胞内膜系の3次元超微形態を捉える(研究代表者:豊岡公徳)」、同新学術領域(研究領域提案型)「植物の生命力を支える多能性幹細胞の基盤原理(領域代表:梅田正明)」、同学術変革領域研究(A)「クロススケール新生物学(領域代表:吉川雅英)」、同学術変革領域研究(学術研究支援基盤形成)「先端バイオイメージング支援プラットフォーム(領域代表:鍋倉淳一)」、科学技術振興機構(JST)戦略的創造研究推進事業ERATO「沼田オルガネラ反応クラスタープロジェクト(研究総括:沼田圭司)」などの助成を受けて行われました。
原論文情報
- Kiminori Toyooka, Yumi Goto, Kei Hashimoto, Mayumi Wakazaki, Mayuko Sato, and Masami Yokota Hirai, "Endoplasmic Reticulum Bodies in the Lateral Root Cap are Involved in the Direct Transport of Beta-Glucosidase to Vacuoles", Plant & Cell Physiology, 10.1093/pcp/pcac177
発表者
理化学研究所
環境資源科学研究センター 技術基盤部門 質量分析・顕微鏡解析ユニット
上級技師 豊岡 公徳(トヨオカ・キミノリ)
テクニカルスタッフⅡ 後藤 友美(ゴトウ・ユウミ)
ユニットリーダー 平井 優美(ヒライ・マサミ)
 豊岡 公徳
豊岡 公徳
 後藤 友美
後藤 友美
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
