理化学研究所(理研)生命機能科学研究センター 動的恒常性研究チームのユ・サガンチームリーダー(開拓研究本部 Yoo生理遺伝学研究室 主任研究員)、シヴァクシ・スレク 研究パートタイマーⅠ(研修生)らの研究チームは、ショウジョウバエ[1]をモデルとして、組織幹細胞[2]が死ににくい原因を突き止めました。
さまざまな生物において組織幹細胞は死ににくいことが知られていましたが、その分子機構は明確ではありませんでした。本研究成果は、この謎に迫るものです。
体のさまざまな組織に存在する組織幹細胞は、組織の維持や再生に重要な役割を担っており、細胞死を起こすような条件下でも死ににくい性質を持つことが知られています。今回、研究チームは、ショウジョウバエの腸をモデルとし、通常の細胞では細胞死を促進するような操作を腸幹細胞に施したところ、腸幹細胞は死ぬどころか、逆に増殖することを見いだしました。その原因として、通常の細胞では細胞死と細胞増殖を促進するシグナルを同時に活性化するフィードバック機構[3]が機能するのに対し、腸幹細胞ではこの機構が働かず、細胞増殖シグナルのみが優位となっていることを発見しました。
本研究は、科学雑誌「Life Science Alliance」オンライン版(1月31日付、日本時間1月31日)に掲載されました。
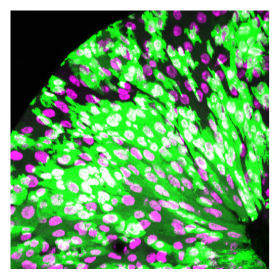
細胞死の誘導に逆らって増殖する腸幹細胞(緑は腸幹細胞、マゼンタは全細胞の核を示す)
背景
組織幹細胞は、体のさまざまな組織に存在する未分化な細胞であり、組織の維持や再生に寄与しています。哺乳類やショウジョウバエなどのさまざまな生物において、組織幹細胞は死ににくいことが知られています。例えば、抗がん剤による化学療法で髪の毛が抜けたり、けがによって皮膚の細胞が死んだりしても、日数が経つと治っていくのは、組織幹細胞が死んでいないからです。組織幹細胞は臓器や組織を作り出す元となる非常に重要な細胞であるため、この死ににくい性質は理にかなっていると考えられます。ただ、どのような分子機構によって組織幹細胞が細胞死に抵抗性を持つことができるのかは不明でした。
研究手法と成果
ユチームリーダーらは以前、ショウジョウバエの翅(はね)を作る細胞において、細胞死を引き起こす働きを持つ「サヨナラ遺伝子」を発見しています注)。今回、腸幹細胞でサヨナラ遺伝子を強制的に発現させたところ、腸幹細胞は細胞死を起こすどころか、細胞増殖することを発見しました(図1)。
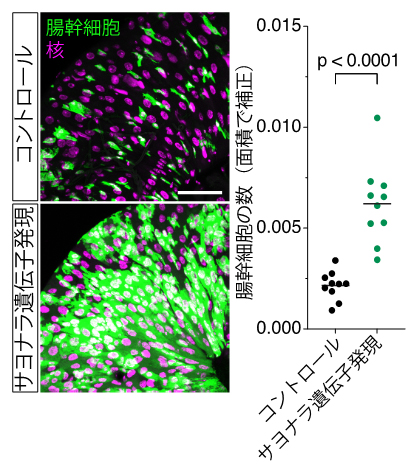
図1 サヨナラ遺伝子の導入による腸幹細胞の増殖
- (左)腸においてサヨナラ遺伝子を強制発現させたときの蛍光顕微鏡観察像。全細胞の数(マゼンタによる核染色)に対して、腸幹細胞(緑)の数が増えていることが分かる。
- (右)腸幹細胞の増殖の定量解析。複数の実験サンプルについて、細胞数を組織面積で割った数で評価した。サヨナラ遺伝子を発現させたサンプルは、コントロール(対照群)に対して腸幹細胞数が有意に増加していた。
他の細胞では細胞死を起こすような操作をしたにもかかわらず、どうして腸幹細胞で細胞増殖が起きたのかを明らかにするために、細胞内の現象を遺伝学的手法で解析しました。その結果、カスパーゼ[4]という酵素とJnk[5]という酵素がお互いに活性化し合う正のフィードバック機構が重要な意味を持つことを見いだしました(図2)。カスパーゼはアポトーシス[6]という細胞死を引き起こす一方で、Jnkは細胞増殖を引き起こします。腸幹細胞以外の細胞では、細胞死を起こすような操作をすると、カスパーゼとJnkが活性化し合い、細胞死を誘導するシグナルと、細胞増殖を誘導するシグナルの両方が高まります。この相反するシグナルのバランスにより細胞が死ぬか増殖するかが決まり、通常の細胞では結果的に細胞死が実行されると考えられます。
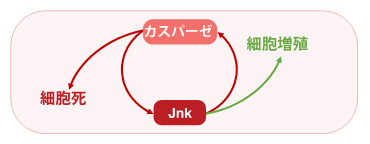
図2 細胞死と細胞増殖を同時に駆動するフィードバック機構
サヨナラ遺伝子の導入など細胞死を引き起こす操作により、細胞死(アポトーシス)を引き起こすカスパーゼが活性化されることが知られている。カスパーゼは細胞増殖を誘導するJnkを活性化し、この両者は正のフィードバックの関係にある。腸幹細胞以外の通常の細胞では、このバランスは結果的に細胞死を引き起こす側に傾いていると考えられる。
そこで研究チームは、腸幹細胞では、このフィードバック機構が正常に働いていないのではないかと考え、解析を行いました。Jnkによるカスパーゼの活性化は、Rpr[7]というタンパク質によって仲介されていることが分かっています。そこで研究チームは、Rprを作る遺伝子(rpr)の発現が腸幹細胞で抑制されている可能性を検討しました。ATAC-seq[8]という手法を用いて染色体のクロマチン構造[8]を解析した結果、腸幹細胞ではrpr遺伝子の転写に必要なクロマチン構造となっていないことを解明しました。さらに、Rprタンパク質がカスパーゼを活性化するには、Rprタンパク質がミトコンドリアで働くことが必要ですが、腸幹細胞ではRprが作られてもミトコンドリアに局在できないことを見いだしました。すなわち、腸幹細胞では、Jnkからカスパーゼへのシグナルが、クロマチン構造異常とRprの局在異常という二段階で抑制されていることが分かりました(図3)。
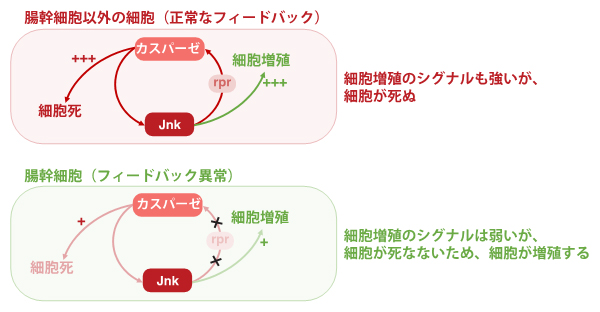
図3 腸幹細胞特異的なフィードバック機構の異常
腸幹細胞以外の細胞では、細胞死を起こすような操作をすると、正常なフィードバックが働き細胞が死ぬ。腸幹細胞では、たとえ細胞死を起こすような操作をしてもこのフィードバックが正常に働かず、細胞があまり死なないため、結果的に細胞増殖が起こる。
- 注)2023年2月2日プレスリリース「細胞死を引き起こすサヨナラ遺伝子」
今後の期待
本研究成果には大きく二つの意義があります。一つは、細胞死と細胞増殖をつなぐフィードバック機構の存在の発見、もう一つは、腸幹細胞におけるフィードバック機構の異常です。本研究ではショウジョウバエの腸幹細胞をモデルとして用いましたが、ヒトなどの哺乳類でも組織幹細胞は非常に死ににくいことが知られています。従って、今回のショウジョウバエで発見した分子機構がヒトの組織幹細胞の細胞死抵抗性にも関わっているのかを明らかにすることが今後の課題です。
補足説明
- 1.ショウジョウバエ
さまざまな研究分野でよく使用されるモデル生物。体長2~3mm前後で、飼育が容易であり、遺伝学的な解析に優れている。 - 2.組織幹細胞
臓器や組織にもともと存在する未分化細胞。臓器や組織の細胞が失われたときに、新しく細胞を補充する能力を持つ。 - 3.フィードバック機構
回路で出力の一部を入力側に戻すことで、出力を増大もしくは減少させること。 - 4.カスパーゼ
アポトーシスの誘導に関わるタンパク質分解酵素。サヨナラ遺伝子は、カスパーゼを活性化する機能を持つ。 - 5.Jnk
細胞内シグナル伝達因子であるMAPキナーゼファミリーに属するタンパク質リン酸化酵素。 - 6.アポトーシス
多細胞生物を構成する細胞には、他の細胞に影響を与えないような死に方をする仕組みが備わっており、これを細胞死と総称する。アポトーシスはその一つで、「プログラムされた細胞死」とも呼ばれ、細胞の除去に重要な役割を果たす。 - 7.Rpr
カスパーゼを活性化するタンパク質。ショウジョウバエの変異体reaperにより発見された。なお、reaperは「死神」の意味を持つ。 - 8.ATAC-seq、クロマチン構造
染色体には、DNAがヒストンタンパク質に絡まったクロマチン構造がある。クロマチン構造が開いていればその領域の遺伝子が発現しやすい。ATAC-seqはクロマチン構造が開いているか閉じているかを判別する手法。
研究チーム
理化学研究所 生命機能科学研究センター
動的恒常性研究チーム
チームリーダー ユ・サガン(Sa Kan Yoo)
(開拓研究本部 Yoo生理遺伝学研究室 主任研究員)
研究パートタイマーⅠ シヴァクシ・スレク(Shivakshi Sulekh)
(研修生、神戸大学大学院 医学研究科)
学院生リサーチ・アソシエイト(研究当時)池川 優子(イケガワ・ユウコ)
(研修生(研究当時)、京都大学大学院 生命科学研究科(研究当時))
研究パートタイマーⅠ 内藤 早紀(ナイトウ・サキ)
(研修生、大阪大学大学院 生命機能研究科)
発生エピジェネティクス研究チーム
研究員 大字 亜沙美(オオジ・アサミ)
チームリーダー 平谷 伊智朗(ヒラタニ・イチロウ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、開拓研究)で実施し、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(PRIME)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域における研究開発課題「老化の遺伝学的・非遺伝学的分子基盤の解明(研究代表者:兪史幹)」、日本学術振興会(JSPS)科学研究費助成事業若手研究(A)「個体レベルでの物理的損傷に対する応答・修復メカニズムの解明(研究代表者:兪史幹)」、同基盤研究(B)「老化中の恒常性破綻機構の解明(研究代表者:兪史幹)」、科学技術振興機構(JST)創発的研究支援事業「エレボーシスを切り口とした腸恒常性維持機構の解明(研究代表者:兪史幹)」による助成を受けて行われました。
原論文情報
- Shivakshi Sulekh, Yuko Ikegawa, Saki Naito, Asami Oji, Ichiro Hiratani, Sa Kan Yoo, "A feedback loop that drives cell death and proliferation and its defect in intestinal stem cells", Life Science Alliance, 10.26508/lsa.202302238
発表者
理化学研究所
生命機能科学研究センター 動的恒常性研究チーム
チームリーダー ユ・サガン(Sa Kan Yoo)
(開拓研究本部 Yoo生理遺伝学研究室 主任研究員)
研究パートタイマーⅠ シヴァクシ・スレク(Shivakshi Sulekh)
(研修生)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
