理化学研究所(理研)生命医科学研究センター 免疫細胞治療研究チームの山﨑 哲 研究員、清水 佳奈子 上級研究員、藤井 眞一郎 チームリーダー(科技ハブ産連本部 創薬・医療技術基盤プログラム 副プログラムディレクター)の研究チームは、「人工アジュバントベクター細胞(aAVC:エーベック)[1]」に複数のがん抗原を発現させて投与すると、誘導されたキラーT細胞[2]によりがん細胞が殺傷されるとともに、がん抗原のエピトープ拡散[3]が効率よく誘導され、複数の抗原に対する免疫応答を同時かつ長期的に増強できることを明らかにしました。
本研究成果により、aAVC療法の臨床での開発拡大に期待できます。
今回、研究チームは、前立腺がんに特有の複数の抗原に対し、一つの抗原に対する治療によって他のがん抗原に対応するT細胞も誘導でき、複数の抗原のエピトープ[3]に応答するキラーT細胞が腫瘍の増大に対する治療効果を持つことを示しました。さらに、複数のがん抗原を発現したaAVC(多価aAVC)を用いた場合は、エピトープ拡散効果が大幅に高まりました。この結果は、多価aAVC療法が有望な治療オプションであり、免疫効果の低い腫瘍を治療するための包括的な治療法となり得ることを示唆しています。
本研究は、科学雑誌『Frontiers in Immunology』オンライン版(2月1日付)に掲載されました。
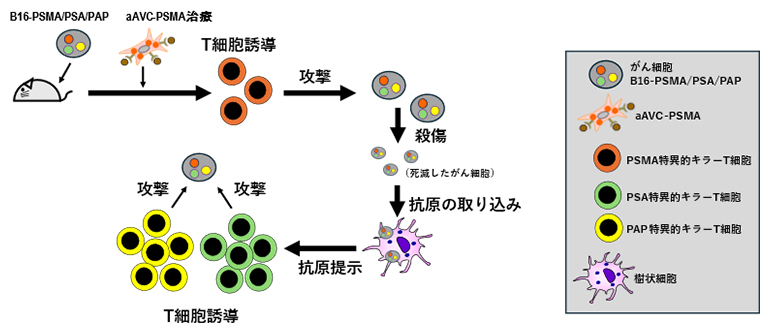
aAVC療法によるがん抗原エピトープ拡散の誘導
背景
前立腺がん(PCa)は免疫細胞による攻撃が効きにくい、いわゆる「cold腫瘍(以下、非炎症性腫瘍)」と見なされています。PCa患者は、いくつかのがん種の治療に革命をもたらした免疫チェックポイント阻害剤[4]の効果が限定的で、これは前立腺腫瘍へのCD8陽性T細胞[2]の浸潤が少ないことに起因すると考えられています。しかし、PCaは通常、前立腺酸性ホスファターゼ(PAP)、前立腺特異的抗原(PSA)、前立腺特異的膜抗原(PSMA)など、いくつかの前立腺特異的抗原を発現しています。これらを標的とするがんワクチンの開発が進んでおり、今後の治療薬開発に向けては前立腺がん抗原特異的CD8陽性T細胞の細胞数と種類の拡大と腫瘍組織への輸送が必要であると考えられています。
藤井チームリーダーらは、がん抗原のmRNAとCD1d[5]mRNAを共導入した細胞(マウスはNIH3T3、ヒトはHEK293)にナチュラルキラーT(NKT)細胞[6]リガンド(α-GalCer[7])を導入した「人工アジュバントベクター細胞(aAVC)」というがんワクチンを開発してきました。aAVC療法は自然免疫[8]と、生体内樹状細胞[9]の獲得免疫[8]を誘導できるため、腫瘍細胞が免疫細胞による攻撃から逃れるのを防ぐのに適した細胞療法です。これまでにマウスモデルでOVA、MART-1、NY-ESO-1、WT1など多くの種類の抗原への有効性を示し、再発・治療抵抗性のあるヒトの急性骨髄性白血病[10]患者に対してWT1抗原を導入したaAVC-WT1の有効性を医師主導治験[11]で明らかにしました注)。
本研究においては、第一に、PCa特異的抗原を導入したaAVCを樹立し、抗腫瘍効果を示すことを試みました。第二に、単一抗原を発現するaAVCが腫瘍抗原特異的応答を誘導し、腫瘍抗原のエピトープ拡散によって他の抗原に対する抗腫瘍効果が生じるかどうかを検討しました。第三に、複数のがん抗原を導入した「多価aAVC」を開発し、複数の抗原に対するCD8陽性T細胞を誘導することで、抗腫瘍効果が高まるかどうかを詳しく調べました。
- 注1)2022年9月24日プレスリリース「人工アジュバントベクター細胞投与による免疫の活性化」
研究手法と成果
aAVCは細胞治療プラットフォームであり、導入するがん抗原を選択することが可能な細胞治療薬です。本研究においては、前立腺がん患者において陽性率・抗原性がともに高く、がん免疫療法の標的として適したPSMA、PSA、PAPの3種類の抗原を導入し、それぞれaAVC-PSMA、aAVC-PSA、aAVC-PAPと名付けました。
これらの抗腫瘍効果を検討するため、前立腺がんと同じく「非炎症性腫瘍」として知られているB16メラノーマ細胞株に、前立腺がん抗原を導入した細胞株(B16-PSMA、B16-PSA、B16-PAP)を樹立しました。B16-PSMAを皮下接種したマウスは、治療をしない群では腫瘍が増大していきました。一方でaAVC-PSMAで治療を行った群では、腫瘍の増大が抑制され、aAVC-PSMAが抗腫瘍効果を有することが示されました。同様の結果がaAVC-PSAおよびaAVC-PAPの試験においても確認でき(図1)、前立腺がん抗原を導入した3種類のaAVCに抗腫瘍効果があることが明らかになりました。
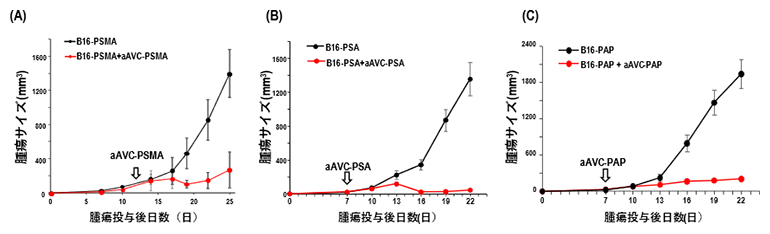
図1 前立腺がん抗原を導入したaAVCの抗腫瘍効果
マウスに前立腺がん抗原を1種類導入したB16細胞を皮下接種し、腫瘍が生着(50~100mm3)したことを確認した後、マウスに同種の抗原を導入したaAVCで治療を行い、抗腫瘍効果を検討した。(A)(B)(C)のグラフは抗腫瘍効果を明確に示している。グラフの黒線は「治療しない群」、赤線は「治療を行った群」。
- (A)PSMA抗原を導入したB16-PSMAを皮下接種したマウスに12日後、aAVC-PSMAによる治療を行った。
- (B)PSA抗原を導入したB16-PSAを皮下接種したマウスに7日後、aAVC-PSAによる治療を行った。
- (C)PAP抗原を導入したB16-PAPを皮下接種したマウスに7日後、aAVC-PAPによる治療を行った。
次に、aAVC療法ががん抗原のエピトープ拡散を誘導できるかどうかを検討するため、B16-PSMA/PSA/PAPを皮下接種したマウスを、7日目にaAVC-PSMA、aAVC-PSA、またはaAVC-PAPで処置し、さらに10日後にCD8陽性T細胞の解析をELISpotアッセイ[12]で行いました。その結果、aAVCに導入した抗原に特異的なCD8陽性T細胞だけでなく、他の2種類の抗原に対する特異的なCD8陽性T細胞が誘導されていることが示唆されました(図2)。この結果から、aAVC療法が腫瘍からCD8陽性T細胞へ抗原エピトープ拡散を誘導する能力を有していることが示されました。
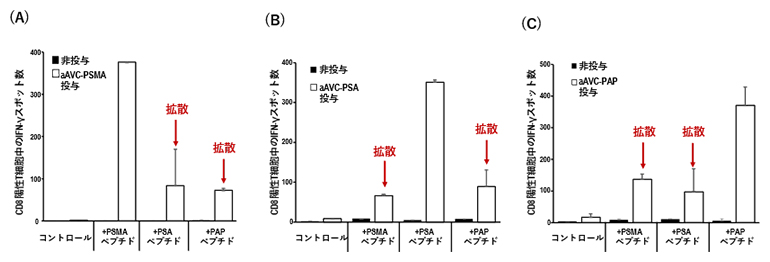
図2 aAVCによる抗原エピトープ拡散
抗原エピトープ拡散を検討する目的で、B16-PSMA/PSA/PAPを皮下接種したマウスに7日目にaAVC-PSMA、aAVC-PSA、またはaAVC-PAPを投与し、投与10日目のマウスから脾臓を摘出して、CD8陽性T細胞を単離した後、ELISpotアッセイにより抗原特異的T細胞の検出を行った。
- (A)aAVC-PSMAを投与したマウス。
- (B)aAVC-PSAを投与したマウス。
- (C)aAVC-PAPを投与したマウス。
さらに、三つの前立腺がん抗原を発現する多価aAVCを作製し、aAVC-PROSと名付けました(図3A)。aAVC-PROSのPSMA、PSA、およびPAP抗原タンパク質の発現量は、PSMAで483±31ナノグラム(ng、1ngは10億分の1グラム)/106細胞、PSAで59.2±5.0ng/106細胞、およびPAPで17.9±1.2ng/106細胞でした(図3B)。aAVC-PROSを投与したマウスでは導入した3種類の抗原全てに対する特異的T細胞が誘導されており、PSA特異的T細胞が優位であることが示されました(図3C)。このことから、aAVCに発現した抗原タンパク質の量は必ずしもT細胞免疫応答と相関せず、それぞれの抗原がどの程度免疫応答を起こしやすいかに依存する可能性が示唆されました。
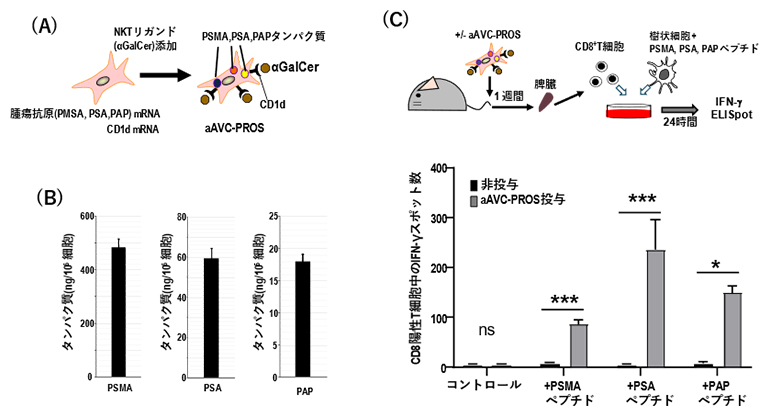
図3 複数の抗原を導入したaAVC-PROSの樹立と各抗原に対するT細胞免疫応答の誘導
- (A)NIH3T3細胞にPSMA、PSA、PAPの3種類のがん抗原を同時に導入した3価のaAVC(aAVC-PROS)の概略。
- (B)aAVC-PROSに発現している抗原タンパク質をウエスタンブロット法(タンパク質の検出手法の一つ)により定量した。
- (C)aAVC-PROSをマウスに投与し、1週間後に摘出した脾臓からCD8陽性T細胞を単離した後、ELISpotアッセイでT細胞解析を行った。
マウスにB16-PSMA/PSA/PAPを皮下投与した7日後、1価aAVC(aAVC-PSMA、aAVC-PSA、aAVC-PAPのいずれか)、2価aAVC(aAVC-PSMA/PSA)、3価aAVC(aAVC-PROS)をそれぞれ静脈内投与したところ、1価、2価、3価のaAVCの全てで腫瘍の増殖が抑制され、抗腫瘍効果が確認されました。そこでさらに、10日目をaAVC治療初期、19日目をaAVC治療後期として1価、2価、3価のaAVCの抗腫瘍効果を比較しました。その結果、治療初期では1価、2価、3価のaAVCの抗腫瘍効果には差が見られませんでした。しかし、治療後期では3価aAVCが1価、2価のaAVCよりも高い治療効果を示しました(図4)。このことから3価aAVC(aAVC-PROS)により複数のがん抗原特異的なT細胞が効率的に誘導され、より長い期間抗腫瘍効果が持続することが示唆されました。
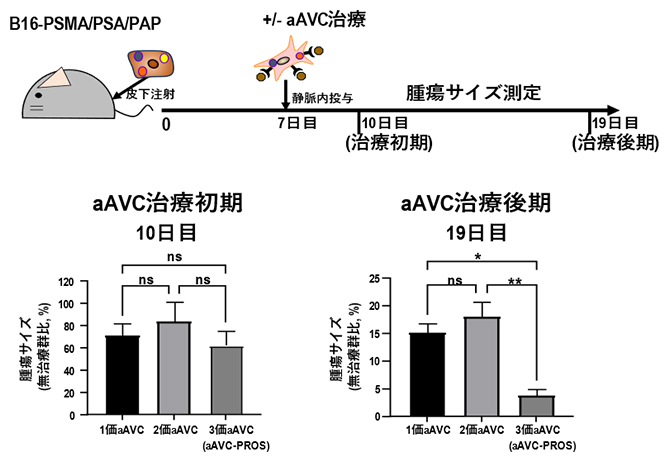
図4 多価aAVCによる抗腫瘍効果の比較
マウスにB16-PSMA/PSA/PAPを皮下投与して、7日後に1価、2価、3価のaAVCで治療を行った。aAVC治療から3日後の10日目をaAVC治療初期、その9日後の19日目をaAVC治療後期として、1価、2価、3価のaAVCの抗腫瘍効果を検討した。1価、2価、3価aAVCをそれぞれ投与したマウスの腫瘍サイズを無治療マウスの腫瘍サイズに対する比で表した。ns:有意差なし、*:有意水準5%以下、**:有意水準1%以下。
以上の結果から、腫瘍に対してaAVCを投与すると、①キラーT細胞が誘導され、がん細胞が殺傷される②殺傷されたがん細胞から複数のがん抗原が放出され、樹状細胞に取り込まれる③がん細胞に含まれていた他のがん抗原に対するキラーT細胞が誘導され、がん抗原を殺傷する という、複数のがん抗原に対するキラーT細胞誘導が連続的に起こるサイクル(がん抗原のエピトープ拡散)ができると考えられます。さらに、複数のがん抗原を標的とする多価aAVC療法は、より長い期間抗腫瘍効果が期待できます。
今後の期待
今回、aAVCの有効性機序において、誘導されたT細胞により、がん抗原エピトープ拡散が効率よく誘導され、複数の抗原に対する免疫応答を増強できることを明らかにしました。この結果は、aAVCががんの免疫回避を阻止し得る有効な免疫療法となる可能性を示唆しています。多価抗原を発現するaAVCが有望な治療オプションであり、免疫効果の低い腫瘍を治療するためのより包括的な治療法となり得ることが期待されます。
補足説明
- 1.人工アジュバントベクター細胞(aAVC:エーベック)
がんの免疫療法で研究が進められている人工細胞。他家細胞(マウス用にはNIH3T3細胞、ヒト用にはHEK293細胞)に、CD1d(下記参照)分子のmRNAと標的がん抗原分子のmRNAを遺伝子導入させ、CD1d上にアルファガラクシトシルセラミド(α-GalCer)を発現させた細胞。アジュバントとは免疫反応を増幅させること、ベクターは運び屋という意味。aAVCはartificial adjuvant vector cellsの略。 - 2.キラーT細胞、CD8陽性T細胞
T細胞は胸腺という組織で分化、成熟したリンパ球の一種。獲得免疫をつかさどり、抗原提示細胞から抗原情報を受け取ることで、さまざまな機能を発揮する。T細胞の中でCD8陽性T細胞は、細胞表面にCD8と呼ばれる特徴的なタンパク質を発現するもので、活性化するとキラーT細胞に分化し、ウイルス感染細胞やがん細胞を殺傷する役割を果たす。 - 3.エピトープ拡散、エピトープ
T細胞、B細胞などが抗原と結合する際には、抗原全体を認識するのではなく、抗原の比較的小さな部位を認識して結合する。この結合部位を抗原のエピトープ(抗原決定基)と呼び、6~20個のアミノ酸や5~8個の単糖の配列から成る。誘導されたキラーT細胞が標的であるがん細胞を攻撃することで二次的に異なるタイプのキラーT細胞が誘導される連鎖免疫反応をエピトープ拡散(epitope spreading)と呼ぶ。 - 4.免疫チェックポイント阻害剤
T細胞の活性化を抑制する負の共刺激分子(PD-1、CTLA-4)およびそのリガンドに結合し、その作用を阻害する抗体の総称で、T細胞の免疫抑制を解除することにより、抗腫瘍免疫応答を増強する。 - 5.CD1d
CD1分子は細胞表面に発現し、抗原として糖脂質を提示する分子。グループ1(CD1a、CD1b、CD1c)とグループ2(CD1d)が存在し、CD1dと糖脂質の複合体はNKT細胞により特異的に認識される。 - 6.ナチュラルキラーT(NKT)細胞
自然免疫リンパ球の一種で、NK細胞のマーカーと1種類のT細胞受容体を発現している。アレルギー疾患、がん、自己免疫疾患を制御する機能を持つ中核的な免疫調節細胞である。 - 7.α-GalCer
アルファガラクトシルセラミド。NKT細胞だけを活性化する糖脂質リガンドの一つであり、CD1d分子上に提示される。沖縄に生息する海綿の一種(Agelas mauritianus)から得られた。 - 8.自然免疫、獲得免疫
自然免疫は先天的な免疫システムで、さまざまな種類の抗原を対象に初期防衛を担う。獲得免疫は、抗体や多様な細胞性免疫応答によって特定の異物を認識し排除する免疫システムである。 - 9.樹状細胞
樹状突起を持つ白血球。未感作T細胞に異物の情報を伝える細胞(抗原提示細胞)として働き、免疫反応の本質的な司令塔としての役割を担っている。 - 10.急性骨髄性白血病
骨髄の中の未熟な細胞(幼若骨髄系細胞)ががん化して増殖し、骨髄を占拠することにより、正常な血液細胞が作られなくなり、貧血症状、出血、感染による症状が現れる疾患。通常は化学療法や移植治療が行われる。 - 11.医師主導治験
医師主導治験とは、医師自らが治験を企画・立案し、治験届を提出し治験を実施するもの。臨床試験のうち第一相試験は、主に治験薬の安全性および薬物の体内動態、薬剤の最大用量を確認するために行われる。 - 12.ELISpotアッセイ
単一細胞レベルで分泌されたサイトカイン産生細胞数などを検出できる方法であり、がんや感染症、自己免疫疾患などの疾患において抗原特異的免疫応答を評価するのに用いられる。
原論文情報
- Satoru Yamasaki, Kanako Shimizu, and Shin-ichiro Fujii, "Tumor epitope spreading by a novel multivalent therapeutic cellular vaccine targeting cancer antigens to invariant NKT-triggered dendritic cells in situ", Frontiers in Immunology, 10.3389/fimmu.2024.1345037
発表者
理化学研究所
生命医科学研究センター 免疫細胞治療研究チーム
研究員 山﨑 哲(ヤマサキ・サトル)
上級研究員 清水 佳奈子(シミズ・カナコ)
チームリーダー 藤井 眞一郎(フジイ・シンイチロウ)
(科技ハブ産連本部 創薬・医療技術基盤プログラム 副プログラムディレクター)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
