理化学研究所(理研)生命機能科学研究センター 生体模倣システム理研白眉研究チームのイサベル・コウ 特別研究員、萩原 将也 理研白眉研究チームリーダーの研究チームは、ヒト細胞に由来する組織を、機能ごとに小さな立方体構造に区分け(モジュール化)する「Tissue-in-a-CUBE」を開発し、その組み合わせによってヒトの体外で組織の相互作用(組織連関)を再構築するためのプラットフォームを確立しました。
本プラットフォームは、薬剤スクリーニング[1]における実験動物とヒトの種差の問題を解決し、非臨床試験における動物代替モデル[2]としての応用が期待できます。
新薬開発の初期段階では、薬の効果や安全性がマウスなどの動物を用いて確認されても、ヒトでは効果が見られないなど種差に起因する問題が課題となっています。今回、研究チームは、ヒト細胞に由来する各組織をCUBE型(立方体型)デバイスを用いてモジュール化し、作製した複数の組織モジュールを組み合わせることで、組織連関が表現可能な臓器チップ[3]プラットフォームを開発しました。本プラットフォームを用いて、血中の薬剤を脳内移行させる機構を再現した血液脳関門(BBB)[4]モジュールと、脳腫瘍モジュールを組み合わせたモデルを構築したところ、血液脳関門を透過して脳腫瘍に作用する薬剤のスクリーニングに使えることが実証できました。
本研究は、オンライン科学雑誌『Communications Biology』(2月28日付:日本時間2月28日)に掲載されました。
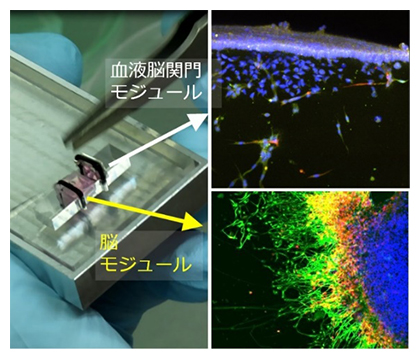
組織モジュール(Tissue-in-a-CUBE)の組み合わせによる組織連関再現プラットフォーム
背景
現在、一つの薬を新たに作るためにおよそ10年、1,000億円以上という莫大な時間とコストがかけられています注1)。この主要因の一つとして、新薬開発の初期段階で薬の効果や安全性がマウスなどの動物を用いて確認されても、ヒトでは効果が見られないなど種差に起因する問題が発生し、開発プロセスの障壁となっていることが挙げられます。さらに、近年の動物実験に対する規制の高まりも併せ、動物の代替実験法として、人工的なヒト臓器を作製して体外で活用できるオルガノイド培養技術[5]と臓器チップの研究開発が実用化に向けて世界中で進められています。
しかし、これら最先端の技術を用いても、複数の組織を同時に再構築し、相互作用を解析することは極めて困難です。体内に投与された薬は、多くの組織を経由して目的地の疾患部位に到達します。そのため、経由地である組織も同時に解析することは、動物の代わりとなる創薬モデルを作る上で必要不可欠です。特に脳の周りには血液脳関門と呼ばれる、血中の異物から脳を守るための血管が存在し、この関門によって薬が脳に届かないといった問題も生じています。そこで、脳疾患に対する薬のスクリーニングとして、対象とする疾患部位単体で試験するのではなく、血液脳関門を適切に通過し脳に届いた上で効果があるかを併せてテストすることが重要です。
複数組織の連関を体外で再構築するのが困難である原因としては、組織ごとに異なる培養条件を同時に満たすなど実験系が複雑になりすぎてしまい、成功率が極端に悪くなるということがあります。萩原理研白眉研究チームリーダーらはこれまでに、細胞培地ゲルを内包できるCUBE型(立方体型)デバイスを開発し、異なる培養条件を与えたデバイスを組み合わせることで、複雑な生体組織の構造を模倣する技術を研究してきました注2、3)。今回は、これまでの研究成果を応用し、各組織をモジュール化することで組織間の連関を表現可能にするプラットフォームの開発に取り組み、脳との相互作用を再現できる新たな血液脳関門モデルの構築を目指しました。
- 注1)『新薬が創る ひろがる未来 てきすとぶっく 製薬産業 2022-2023』(日本製薬工業協会)より
- 注2)2023年1月31日プレスリリース「培養ゲルを適材適所に」
- 注3)2023年3月24日プレスリリース「ミニ臓器に体軸方向を与える技術を開発」
研究手法と成果
血液脳関門は、脳血管内皮細胞と、それを取り巻くアストロサイト[4]とペリサイト[4]により構成されています。血液脳関門モデルを構築するに当たり、まず研究チームは、組織をモジュール化するための5mm角のCUBE型フレームを作成し、内部にマトリゲル[6]を詰めました。この中にヒト脳に由来するアストロサイトとペリサイトを埋め込んだ後、ヒトiPS細胞から分化させた脳血管内皮細胞をマトリゲルの表面にまきました。脳血管内皮細胞は表面張力により、マトリゲル上でシート状になります。こうして3種の細胞を共培養することで、内皮細胞のシートの下でアストロサイト、ペリサイトが内皮細胞に向かって3次元的に伸びていくという、血液脳関門同様の形態が再現できました(図1)。
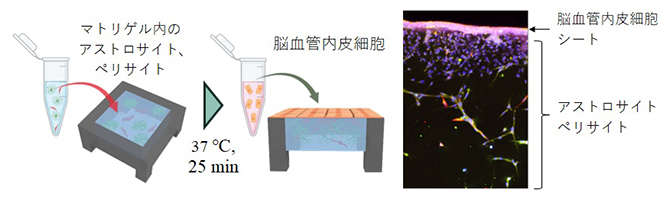
図1 血液脳関門モジュールの作製方法
アルミニウムでできた5mm角のCUBE型フレームにマトリゲルを詰め、ヒト脳由来の初代培養細胞であるアストロサイトとペリサイトを埋め込む(左)。次に、マトリゲルの表面にヒトiPS細胞から分化させた脳血管内皮細胞をまき、シート状に培養する(中)。こうしてできたモジュールの断面を顕微鏡観察したところ、内皮細胞のシートの下でアストロサイト、ペリサイトが内皮細胞に向かって3次元的に伸びていくという、血液脳関門同様の形態が再現できた。
CUBE型フレームを用いて培養した組織モジュール「Tissue-in-a-CUBE」はピンセットでも壊さずつまむことができ、容易に移動できます。これにより、各モジュールの培養は通常の細胞培養と同じプレート内で行い、組織として成熟した段階で、あらかじめ準備した他の組織モジュールと流体チップ[3]内で統合するプラットフォームを確立しました(図2)。流体チップには流路が形成されており、モジュールは流路にはめ込まれています。流路の中で各モジュールを隣接させ、特定の薬剤を流すことで、薬剤を投与したときの組織間相互作用を再現することができます。
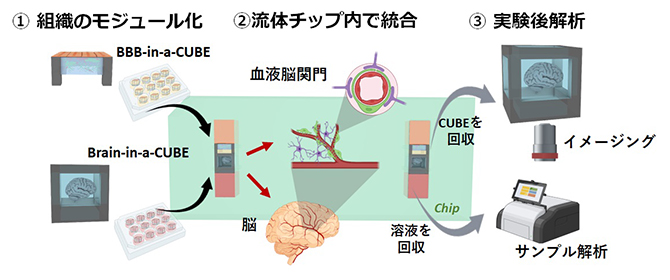
図2 組織モジュール「Tissue-in-a-CUBE」を用いたプラットフォームの概要
簡単なモジュールの組み合わせで複雑な組織連関を再現するプラットフォームである。血液脳関門を介して薬剤を作用させた実験の後に、詳細なサンプル解析を行うことも可能となる。
次に、このプラットフォームによって構築した血液脳関門モデルが、脳関門として必要な機能を持っているかどうかを検証しました。生体内の血液脳関門では、外部から不要なものが脳に入らないよう、脳血管内皮細胞同士を結合するタイトジャンクション[7]が他の血管よりも強いバリアを形成しています。一方、必要なものを通して不要なものは排出する仕組みとして、内皮細胞は物質を選択的に透過させるための各種トランスポーター[8]を有しています。血液脳関門モデルにおいてこれらの機能性を確認したところ、培養日数とともにタイトジャンクションは強固になり、またPGP[8]やGLUT1[8]といった血液脳関門の主要なトランスポーターの発現も確認できました。
生体内の血液脳関門では、トランスポーターによって異物が排出され、脳への侵入を防いでいます。そこで、異物のモデルとして蛍光分子を用いて透過試験を行ったところ、血液脳関門モジュールを透過できたものはごくわずかでしたが、排出トランスポーターであるPGPの阻害剤を一緒に入れると透過率が上がることが確認できました(図3)。このことは、構築した血液脳関門モデルにおいても生体内と同様に、PGPトランスポーターが排出の機能を持ち、外部物質が脳側へ移行することを防いでいることを示唆しています。
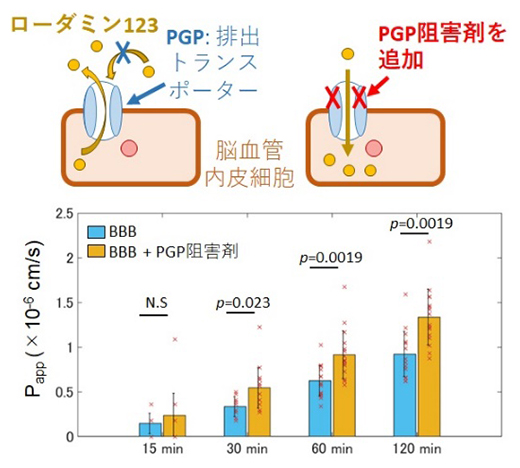
図3 PGP阻害剤を用いたローダミン123透過試験
血液脳関門(BBB)モデルの脳血管内皮細胞側に有機蛍光分子であるローダミン123溶液を加えた後、マトリゲル側で観察されたローダミン123の蛍光強度から透過率を算出した。ローダミン123のみを添加した場合は、排出トランスポーターPGPの作用により内皮細胞への取り込みが抑制されている(青グラフ)。一方、トランスポーター阻害剤の存在下では透過率が上昇した(橙グラフ)。
最後に、創薬への応用可能性を実証するため、この血液脳関門モデルの各モジュールの移動の簡便さを生かして、血液脳関門-脳腫瘍の連関モデルを構築し、薬剤の効果を確かめる実験を行いました。まず血液脳関門モジュールの作製と並行して、脳腫瘍の細胞をCUBE型の容器の中でマトリゲルとともに培養し、脳腫瘍モジュールとして準備します。両組織が十分成熟した段階で、ピンセットで各モジュールを流体チップ内に移して連結させます。これにより、血液脳関門側に滴下した新薬候補化合物がどの程度脳関門を通過し、脳腫瘍にたどり着き、そこで薬としての効果を発揮するかを検証することができます。実際に、抗がん剤として用いられるビンクリスチン[9]をそのまま脳関門側に滴下したところ、血液脳関門に阻まれ、腫瘍細胞を攻撃することができませんでした。しかしPGPの阻害剤を脳関門側に入れることにより、ビンクリスチンの脳側への移行量が大幅に増え、腫瘍細胞をより多く死滅させることができました(図4)。この結果から、本研究で開発した血液脳関門モデルが、脳内移行性を持つ抗がん剤のスクリーニングに応用可能であると考えられます。
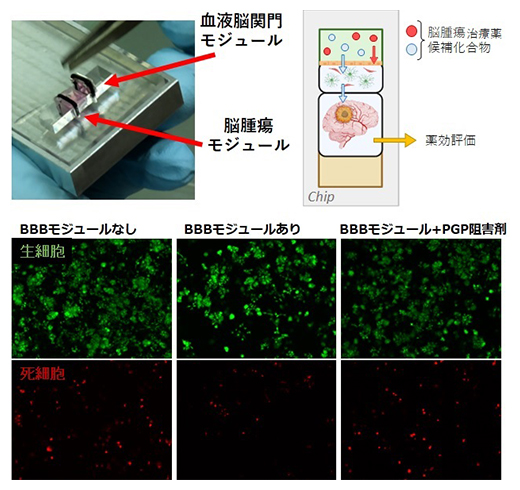
図4 血液脳関門-脳腫瘍の連関モデルによる薬剤試験
- (上左)血液脳関門モジュールと脳腫瘍モジュールを連結した血液脳関門-脳腫瘍連関モデル。
- (上右)血液脳関門モジュール側に脳腫瘍治療薬の候補化合物を滴下すると、血液脳関門を通過できない多くの薬剤(赤丸)から、脳腫瘍モジュールに到達し薬効評価可能な一部の薬剤(青丸)をスクリーニングすることができる。
- (下)ビンクリスチン滴下後の脳腫瘍モジュールの生細胞と死細胞を蛍光顕微鏡で観察した。血液脳関門(BBB)モジュールを介さずに滴下すると、ビンクリスチンが腫瘍細胞を攻撃し、多くの死細胞が観察された(左)。一方、BBBモジュールを介すると腫瘍側へビンクリスチンが移行しないため、観察される死細胞の数が減少した(中央)。PGP阻害剤をビンクリスチンと併せて滴下すると、BBBモジュールを介していても腫瘍側への移行が進み、腫瘍細胞が攻撃された(右)。
今後の期待
今回開発したモジュール型のプラットフォームを用いた血液脳関門モデルは、脳関門の下流に配置するモジュールを交換することで脳腫瘍以外にもさまざまな疾患との連関を表現することが可能です。そのため、薬が脳関門のバリアをいかにして通過し、疾患ターゲットに到達した上で、薬としての効果を果たすことができるのかの検証をヒト細胞由来の組織で従来よりも簡単に行えます。これにより、薬物動態、薬効薬理、安全性といった創薬に必須の試験について、動物実験の有力な代替法となることが期待できます。特に、下流に脳オルガノイドを配置することにより、アルツハイマー病やパーキンソン病といった老化に伴う疾患に対して、疾患由来のヒトiPS細胞を用いた組織を用いてアプローチできるという非常に大きな利点があります。
さらに、モジュール化された組織の利点として、実験手技の簡便さがあります。ピンセットで流体チップ内の所定の位置に入れ込むだけでモデルを構築できるので、複雑な作業は不要であり、薬剤スクリーニング法として製薬・受託企業などで広く使われることが期待できます。また、このプラットフォームは血液脳関門以外の組織にも応用できるため、内臓を構成する各オルガノイドをモジュール化し再構築することも将来的に目指していきます。
補足説明
- 1.薬剤スクリーニング
薬の候補物質について、それぞれの効果や副作用を確認し、有望なものを絞り込むこと。 - 2.動物代替モデル
マウスなどの実験動物の代わりに、生命科学研究や非臨床研究に利用できる実験モデル。 - 3.臓器チップ、流体チップ
臓器チップは、複数の細胞種を入れ込み、臓器機能を模倣したチップ。臓器チップには、手に持てる程度の樹脂やガラス基盤に流路を形成し、流体制御を行うデバイス(流体チップ)を基盤として用いる。 - 4.血液脳関門(BBB)、アストロサイト、ペリサイト
血液脳関門は、脳と血管との間の物質の行き来を制限する、脳周囲の血管(脳血管)が持つ関門。アストロサイトは中枢神経系に存在するグリア細胞。ペリサイトは血管の外側を覆う細胞。BBBはBlood Brain Barrierの略。 - 5.オルガノイド培養技術
ES細胞やiPS細胞、組織幹細胞などの幹細胞を特定の組織の細胞に分化させ、体外でミニ臓器を作製する技術。 - 6.マトリゲル
コーニング社(Corning Incorporated)販売の細胞外マトリックス。 - 7.タイトジャンクション
細胞間結合の一種。隣接する細胞が隙間無く結合し、物質が通り抜けるのを防ぐ。 - 8.トランスポーター、PGP、GLUT1
体内の物質の組織分布や異物の排せつにおいて重要な役割を果たすタンパク質をトランスポーターと呼ぶ。代表的なトランスポーターとしてPGP(P糖タンパク質)、GLUT1(グルコーストランスポーター1)などがあり、いずれも脳への薬物移行を制限している。 - 9.ビンクリスチン
微小管の重合反応を阻害することで細胞分裂を抑制する抗がん剤。白血病治療などに用いられるが、血液脳関門により脳内移行は妨げられる。
研究支援
本研究は科学技術振興機構(JST)大学発新産業創出プログラム(START)「Cube in a Chipシステムによるin vitro創薬モデルの事業化(研究代表者:萩原将也)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「三次元培養環境場の計測・制御プラットフォームによる組織形成ダイナミクス解析(研究代表者:萩原将也)」および若手研究「モジュール化オルガノイドの血管形成制御による多臓器相互作用モデルの構築(研究代表者:Koh Isabel)」による助成を受けて行われました。
原論文情報
- Isabel Koh, Masaya Hagiwara, "Modular Tissue-in-a-CUBE platform to model blood-brain barrier (BBB) and brain interaction", Communications Biology, 10.1038/s42003-024-05857-8
発表者
理化学研究所
生命機能科学研究センター 生体模倣システム理研白眉研究チーム
特別研究員 イサベル・コウ(Isabel Koh)
理研白眉研究チームリーダー 萩原 将也(ハギワラ・マサヤ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
