理化学研究所(理研)生命機能科学研究センター 発生幾何研究チームの森下 喜弘 チームリーダー、川住 愛子 学振特別研究員RPD(研究当時)、李 尚雨 技師らの共同研究グループは、hoxc12/hoxc13遺伝子[1]が、無尾両生類[2](カエル)の四肢再生時に発生プログラムを再起動させる際の重要な制御因子であることを発見しました。
本研究成果は、両生類の再生機構の理解とともに、再生能力が著しく低いヒトを含む哺乳類の再生能力を向上させる手法の探索につながると期待できます。
無尾両生類は、幼生期は手や足が切断されても元通りになるなど高い器官再生能力を有しますが、成体になると低下するというライフステージに依存した再生能力を持ちます。再生能力の経時的変化の仕組みや成体再生能力の回復方法について多くの研究がなされてきましたが、いまだ解明されていません。
今回、共同研究グループは、四肢発生時と再生時の比較トランスクリプトーム解析[3]により再生時特異的に発現変化する遺伝子を特定し、その機能解析を行いました。その結果、(1)hoxc12とhoxc13が幼生の四肢再生時に特異的に発現上昇し、その発現を抑制すると発生や再生初期応答には無影響であるのに対し、四肢の再生が著しく阻害されること、(2)hoxc12またはhoxc13を成体四肢再生芽[4]で過剰発現させることで再生能力を部分的に回復させられることを発見しました。以上の結果から、hoxc12/hoxc13遺伝子が、再生時のみで働く発生プログラムの再起動制御因子であることが示されました。
本研究は、科学雑誌『Nature Communications』オンライン版(4月22日付:日本時間4月22日)に掲載されました。
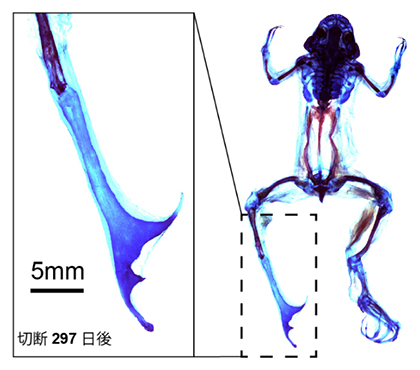
hoxc12の過剰発現により部分的に再生能力が回復したアフリカツメガエルの成体四肢再生
背景
両生類の持つ卓越した器官再生能力は、多くの研究者を引きつける対象として長い間研究されてきました。特にイモリなどの有尾両生類[2]は、生涯にわたって脳や心臓、四肢などさまざまな器官を再生できます。一方、無尾両生類であるカエルは、幼生(オタマジャクシ)時には再生能力が高い一方で、変態してカエルになると四肢を含む再生能力の多くを失います。例えば、カエル成体の四肢を切断すると、傷修復などの初期応答は起こる一方で、指や筋肉を備えた完全な四肢再生はできず、スパイクと呼ばれる皮膚に覆われた棒状の軟骨のみが形成されるにとどまります(図1)。
このライフステージに依存したカエルの四肢再生現象は、両生類と比べて極めて再生能力が低い哺乳類の再生能力亢進(こうしん)を見据えた実験系として多くの研究が行われてきました。特に、組織工学的アプローチによって、幼生時の再生に関わる多能性細胞や、さまざまな成長因子[5]を含む混合溶液をカエル成体の四肢に作用させることで、部分的に再生能力の向上が可能であることが示されました。これらの実験により、適切な入力シグナルがあれば成体でも再生できるポテンシャルがあることが分かってきました。
本研究では、再生能力を回復させるためのより理想的な方法として、人工的な工学的アプローチとは対照的に、実際に生物に内在する再生の仕組みをカエル幼生(オタマジャクシ)時の四肢再生過程から学び、それをカエル成体の再生系に応用するという方法論を取りました。特に、先行研究が主に注目している再生初期応答の脱分化[6]過程ではなく、初期応答後の形が作られる段階で何が起きているのかを調べることにしました。この理由は、スパイクしか形成できないカエル成体の四肢再生過程であっても、傷修復や再生芽形成などの初期応答自体は生じることから、初期応答とは別に、四肢の形を作る発生プログラムが再起動される分子的な仕組みがあるのではないかと考えたからです。
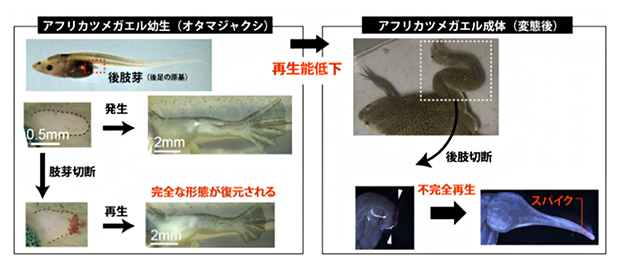
図1 アフリカツメガエルのライフステージに依存した四肢再生能力
カエル幼生(オタマジャクシ)時では、後肢芽(後肢の原基)を切断しても、正常発生と同じ形態を有する完全な後足が再生される(左)。一方、変態後のカエル成体の後肢を切断すると、正常な再生は起きず、棒状の軟骨とそれを覆う皮膚から成る組織(スパイク)のみが形成される。
研究手法と成果
幼生四肢再生時に発生プログラムが再起動される仕組みを解明するため、共同研究グループはアフリカツメガエル[7]およびネッタイツメガエル[7]を用いて以下の3段階で研究を進めました。
(Ⅰ)アフリカツメガエルにおける四肢発生過程と幼生四肢再生時に対する比較トランスクリプトーム解析と再生時特異的に発現変化する遺伝子群の同定
四肢切断初期応答後の形態形成期と、正常発生における四肢発生過程の組織サンプルを用い、遺伝発現の比較解析を行いました。再生時と発生時の発現量に違いのある遺伝子群を抽出し、発現量変化の再生時特異性の強さに従ってそれらを順位付けしました。その結果、最も特異性が高い遺伝子は10個存在し、その中に転写因子であるhoxc12.Lとhoxc13.Lの二つ(以下、それぞれhoxc12、hoxc13と表記)が含まれていました(図2左)。
この二つの転写因子は、再生領域の中でも将来指などが形成される予定自脚域[8]を含む先端部側で発現が強く(図2右)、再生時の発現が発生時よりも数倍から10倍ほど高くなっていました。さらに、正常発生時にはhoxc12とhoxc13遺伝子のどちらも自脚域ではほとんど発現していないこと、またhoxc13遺伝子が魚の尾ひれ再生にも関与するという先行研究があったことから、本研究ではこの二つの転写因子の発現が四肢再生にどのような影響を持つか、その機能を調べることにしました。
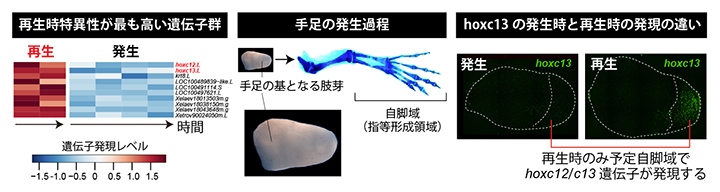
図2 四肢発生過程と幼生四肢再生過程のトランスクリプトーム比較解析
- 中)四肢の原基となる肢芽の形態と、成長した四肢の関係。肢芽の先端部から、将来の手(足)首や指などを含む自脚域が形成される。
- 左)発生時と再生時のそれぞれ対応する二つの時期について、予定自脚域を含む肢芽の先端部側で発現する遺伝子のトランスクリプトーム解析を行った結果。発生時に発現量が低く、再生時に発現量が高い10個の遺伝子を例として並べた。本研究で着目したhoxc12.Lとhoxc13.Lを赤字で示す。
- 右)発生時と再生時におけるhoxc13の発現の比較。hoxc12(データ省略)とhoxc13ともに、予定自脚域での発現は再生時にのみ観察された。
(Ⅱ)幼生四肢再生時において特異的に発現するhoxc12/hoxc13遺伝子の機能阻害実験
hoxc12あるいはhoxc13遺伝子の機能阻害を行ったときに幼生四肢再生過程に与える影響を調べるために、両生類のゲノム編集技術を専門とする広島大学の鈴木賢一特任准教授(実験当時、現基礎生物学研究所特任准教授)との共同研究で、ネッタイツメガエルのノックアウト[9]個体を作製しました。hoxc12あるいはhoxc13のどちらのノックアウト個体でも、四肢発生過程には全く影響がありませんでした(図3左)。一般に、脊椎動物の四肢発生過程ではHoxA[1]とHoxD[1]のクラスターに属する遺伝子のみが重要であることが知られており、例えばHoxC[1]のクラスター全体を取り除いたマウスでは四肢発生に影響がありません。したがって、上記の実験結果はこうした四肢発生に関する先行研究と整合するものでした。
次に、hoxc12あるいはhoxc13のノックアウト個体の幼生再生過程を観察しました。すると、傷害直後から数日以内に起こる傷修復や再生芽形成には影響がなかったのに対して、形態形成が始まると正常個体と大きな差が現れ、ノックアウト個体では特に自脚域の形成が著しく阻害されました(図3右)。野生型とノックアウト個体の幼生四肢再生過程の比較トランスクリプトーム解析を行うと、発生期のパターニングや増殖に働くことが知られている多くの遺伝子群の発現量が減少していました。このことは、hoxc12またはhoxc13という一遺伝子の発現阻害によって特定のシグナル経路が影響を受けたというよりも、発生プログラムと呼ぶべき四肢形成に関連する遺伝子ネットワーク全体が影響を受けたことが示唆されます。発生過程には影響を与えず再生過程のみに影響を与える因子は一部を除いてこれまでほとんど知られておらず注1)、新しい発見です。
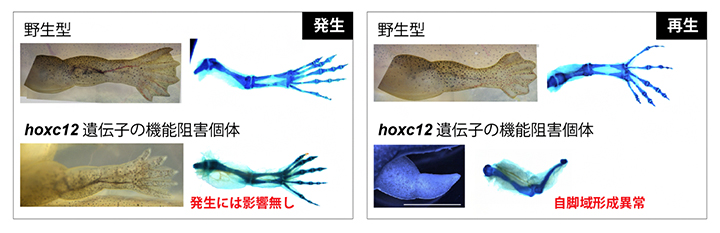
図3 hoxc12の機能阻害による発生・再生への影響
ゲノム編集により作製したhoxc12ノックアウトネッタイツメガエルの表現型。hoxc12遺伝子の機能を阻害しても発生過程での四肢形態形成に影響は見られなかったが(左)、幼生四肢再生過程では自脚域の形成が著しく阻害され、正常な指骨などが再生されなかった。
(Ⅲ)成体四肢再生時におけるhoxc12/hoxc13遺伝子の過剰発現解析
最後に、hoxc12またはhoxc13遺伝子を成体四肢再生芽において過剰発現させることで、これらの遺伝子が成体四肢再生能力に与える影響を評価しました。この解析のために、山形大学の越智陽城准教授との共同研究で、アフリカツメガエルのトランスジェニック[10]個体を作製しました。
トランスジェニック個体の成体四肢再生芽において、通常の初期再生過程では発現量が低いhoxc12またはhoxc13を過剰発現させると、約3分の1の個体に対して、明らかに野生型とは異なる形態が観察されました(図4)。野生型成体の四肢再生におけるスパイク形成では真っすぐな軟骨が形成されるのですが、トランスジェニック個体では再生芽先端で膨らみが見られ、指骨のように分岐した軟骨形成が観察されました。
また再生構造体内部の神経再生量を定量したところ、野生型に比べてトランスジェニック個体では明らかに神経再生量が上昇していました。有尾両生類の研究などから、神経から分泌される神経因子は四肢再生能力と密接に関連することが知られています。そのため、詳細な機構は不明ですが、神経再生量の上昇と再生構造体の形態変化には因果関係があると考えられます。
さらに、再生組織で比較トランスクリプトーム解析を行ったところ、トランスジェニック個体では野生型と比べて相対的に発生期の遺伝子発現パターンに近づいていることが分かりました。以上のことから、hoxc12とhoxc13はカエル成体においても再生能力に影響を与えうることが明らかになりました。しかし、トランスジェニック個体が示した表現型は四肢の完全再生とはいえず、例えば指のような関節構造や筋肉などが全く形成されませんでした。その意味で、hoxc12とhoxc13の過剰発現は成体の再生組織において四肢の発生プログラムを完全に再起動できたわけではありません。
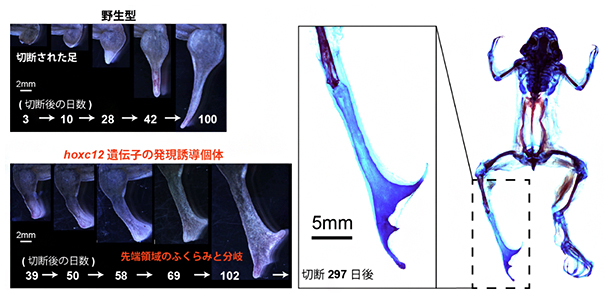
図4 hoxc12/hoxc13遺伝子の過剰発現による成体四肢再生能力への影響
- 左上)野生型のアフリカツメガエル成体の後肢を切断後のスパイク形成過程。
- 左下)hoxc12遺伝子トランスジェニック個体成体における後肢切断後の再生過程。
- 右)hoxc12遺伝子トランスジェニック個体成体の再生組織の硬骨(赤)および軟骨(青)染色像。指のように分岐した軟骨形成が確認できた。ただ、関節などは再生されず、指再生とまではいえない。
- 注1)J. Kang, J. Hu, R. Karra, A.L. Dickson, V.A. Tornini, G. Nachtrab, M. Gemberling, J.A. Goldman, B.L. Black, K.D. Poss, Modulation of tissue repair by regeneration enhancer elements, Nature, 532, 201-206 (2016)
今後の期待
本研究では、無尾両生類の幼生四肢再生過程においてhoxc12あるいはhoxc13遺伝子が再生時特異的に機能し、特に脱分化後の「再分化」ともいえる形態形成を引き起こす発生プログラムの再起動に重要な制御因子であることが明らかになりました。また、部分的にではありますが、両遺伝子は再生能力が著しく低下した成体においても、その能力を向上させる働きを持つことが示されました。
本研究では二つの遺伝子に注目して機能解析を行いましたが、比較トランスクリプトーム解析結果からは、hoxc12やhoxc13以外にも再生時に特異的に発現を変化させる遺伝子群が明らかになっています。それらの遺伝子群は、発生プログラムを再起動させるコア因子の候補であり、複数因子の発現を同時制御することでより完全に近い成体再生能力を獲得できるかもしれません。共同研究グループは既にその可能性を確認するための実験に着手しています。
また、hoxc12あるいはhoxc13の発現変化は一度に多くの遺伝子群の発現量変化を誘発することから、ゲノム全体のエピジェネティック[11]な状態変化により再生組織中の細胞の「モード」がスイッチしている可能性があります。この仮説は、Hox遺伝子群とクロマチンアクセシビリティ[11]の関係性を指摘する最近の報告注2、3)からも支持されます。
最後に、本研究結果の延長上にある展望として、再生能力が著しく低い哺乳類の再生能力制御が挙げられます。両生類のようなモデル動物の再生機構の詳細を明らかにすることで、医療応用にまでつながることが期待されます。
- 注2)I. Desanlis, Y. Kherdjemil, A. Mayran, Y. Bouklouch, C. Gentile, R. Sheth, R. Zeller, J. Drouin, M. Kmita, HOX13-dependent chromatin accessibility underlies the transition towards the digit development program, Nat. Commun., 11: 2491 (2020)
- 注3)S. Ma, B. Zhang, L.M. LaFave, A.S. Earl, Z. Chiang, Y. Hu, J. Ding, A. Brack, V.K. Kartha, T. Tay, T. Law, C. Lareau, Y.-C. Hsu, A. Regev, J.D. Buenrostro, Chromatin Potential Identified by Shared Single-Cell Profiling of RNA and Chromatin, Cell, 183, 1103-1116 (2020)
補足説明
- 1.hoxc12/hoxc13遺伝子、HoxA、HoxD、HoxC
hoxは、動物の前後軸に沿った領域特異的な構造の形成に関わる転写因子群。通常、ホメオボックスと呼ばれるDNA結合ドメインを指定する共通の領域を持つ10個程度の遺伝子が、染色体上に一列に並んでクラスターを形成している。多くの脊椎動物は、二度の全ゲノム重複の結果、A、B、C、Dという四つのクラスターを持ち、クラスターに含まれる個々のhox遺伝子は、クラスター内の位置によって1、2、3…13までの番号が付けられている。すなわち、hoxc12とhoxc13はHoxCクラスターの12と13番目のhox遺伝子を指す。脊椎動物の発生過程における付属肢(ひれや四肢)形成おいては、HoxAとHoxDクラスターが関与していることが知られている。 - 2.無尾両生類、有尾両生類
現生の両生類は三つの目(もく)に分類される。カエルの仲間である無尾目(無尾両生類)が大半を占め、残りが、イモリやサンショウウオを含む有尾目(有尾両生類)とアシナシイモリ目となる。 - 3.トランスクリプトーム解析
一つのゲノム、または特定の細胞・組織・器官で発現する全ての遺伝子の転写産物(トランスクリプトーム)を解析する手法。 - 4.再生芽
再生組織の切断面に、多能性細胞で形成される隆起した構造。 - 5.成長因子
細胞から分泌され、自分自身や他の細胞・組織の成長・増殖を刺激する活性を持つ物質の総称。 - 6.脱分化
一度分化し特定の機能を持った細胞が、より分化状態の低い細胞に変化すること。脱分化した細胞が再生時の組織形成に寄与すると考えられているが、脱分化の仕組みの多くは分かっていない。 - 7.アフリカツメガエル、ネッタイツメガエル
アフリカツメガエル(Xenopus laevis)は卵が大きく(直径約1.1mm)、一度に大量に産卵するため、昔から発生学のモデル動物として使用されている。一方で、そのゲノムは祖先種の異種交配により異なる2種類のゲノムを持つ異質4倍体となっており、特に遺伝子破壊などの遺伝学的解析が困難となっていた。一方、同じツメガエル属のネッタイツメガエル(Xenopus tropicalis)は2倍体のゲノムを持ち、遺伝学的解析が比較的容易である。 - 8.予定自脚域
将来、手(足)首から先の構造となる領域。脊椎動物の四肢は、基部側(肩側)から先端部側にかけて柱脚〔上腕骨〕、軛脚(やっきゃく)〔橈骨(とうこつ)・尺骨〕、自脚〔手根骨・中手骨・指〕から構成されている。 - 9.ノックアウト
遺伝子破壊を意味する用語。本研究では、ゲノム編集技術を用いてhoxc12やhoxc13のノックアウト個体を作製した。 - 10.トランスジェニック
人為的操作により外部から特定の遺伝子を導入すること。 - 11.エピジェネティック、クロマチンアクセシビリティ
細胞内のDNAには、DNAの塩基配列以外にも細胞の個性を記憶する個々の情報が存在しており、それらはDNAやヒストンなどに対する化学修飾として記録されている。このDNAの周辺に記録される塩基配列以外の生命情報やそれらによる遺伝子制御の仕組みをエピジェネティックと呼ぶ。エピジェネティックによる遺伝子制御の仕組みの一つは、転写に関わるタンパク質のクロマチンへの接近しやすさ(クロマチンアクセシビリティ)の制御によるものと考えられている。
共同研究グループ
理化学研究所 生命機能科学研究センター 発生幾何研究チーム
学振特別研究員RPD(研究当時)川住 愛子(カワスミ・アイコ)
技師 李 尚雨(イ・サンウ)
研究員 大塚 大輔(オオツカ・ダイスケ)
特別研究員 浅倉 祥文(アサクラ・ヨシフミ)
大学院生リサーチ・アソシエイト(研究当時)北嶋 慶一(キタジマ・ケイイチ)
(東北大学大学院 生命科学研究科 生態発生適応科学専攻)
チームリーダー 森下 喜弘(モリシタ・ヨシヒロ)
東北大学大学院 生命科学研究科 生態発生適応科学専攻
教授 田村 宏治(タムラ・コウジ)
広島大学大学院 理学研究科
特任助教 坂根 祐人(サカネ・ユウト)
特任准教授 鈴木 賢一(スズキ・ケンイチ)
(研究当時、現基礎生物学研究所 特任准教授)
山形大学 医学部メディカルサイエンス推進研究所
准教授 越智 陽城(オチ・ハルキ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「四肢再生特異的に働く転写因子を起点とした再生駆動機構解明とカエル成体の再生能回復(研究代表者:川住愛子)」および科学技術振興機構(JST)戦略的創造研究推進事業CREST「組織変形動態解析を起点とした種間・器官間で保存された形態形成則の解明(研究代表者:森下喜弘)」による助成を受けて行われました。また、ネッタイツメガエルを用いた機能阻害実験は広島大学の鈴木賢一特任准教授の、アフリカツメガエルを用いた過剰発現実験は山形大学の越智陽城准教授の支援により行われました。
原論文情報
- Aiko Kawasumi-Kita, Sang-Woo Lee, Daisuke Ohtsuka, Kaori Niimi, Yoshifumi Asakura, Keiichi Kitajima, Yuto Sakane, Koji Tamura, Haruki Ochi, Ken-ichi T Suzuki, Yoshihiro Morishita, "hoxc12/c13 as key regulators for rebooting the developmental program in Xenopus limb regeneration.", Nature Communications, 10.1038/s41467-024-47093-y
発表者
理化学研究所
生命機能科学研究センター 発生幾何研究チーム
チームリーダー 森下 喜弘(モリシタ・ヨシヒロ)
学振特別研究員RPD(研究当時)川住 愛子(カワスミ・アイコ)
技師 李 尚雨(イ・サンウ)
 森下 喜弘
森下 喜弘
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
