理化学研究所(理研)生命医科学研究センター 細胞機能変換技術研究チームの鈴木 治和 チームリーダー、国立感染症研究所(感染研)ハンセン病研究センター 感染制御部の吉田 光範 主任研究官、星野 仁彦 室長らの共同研究グループは、肺非結核性抗酸菌(NTM)症[1]の原因の一つであるマイコバクテリウムアビウムコンプレックス(Mycobacterium avium complex:MAC)[2]のマクロファージ細胞[3]感染により、さまざまなロングノンコーディングRNA(lncRNA)[4]が発現変動していることを発見しました。
本研究成果は、MAC感染による宿主[5]免疫反応の理解や肺NTM症の治療法開発に貢献すると期待できます。
共同研究グループは、MACをマクロファージ細胞に感染させ、理研が開発した独自技術であるCAGE法[6]を用いて、遺伝子発現を網羅的に調べました。近年注目されているタンパク質をコードしないlncRNAの発現変動を調べ、発現が上昇および減少するlncRNAを18個および26個同定し、それらの機能推定を行いました。同定したlncRNAはマクロファージ細胞の活性化状態によって多様な発現変動を示し、機能推定の結果と合わせて、それぞれがMAC感染やマクロファージ細胞の活性化において独自の機能を持っていることが示唆されました。
本研究は、科学雑誌『Frontiers in Immunology』オンライン版(4月22日付)に掲載されました。
背景
マイコバクテリウムアビウムコンプレックス(Mycobacterium avium complex:MAC)は土壌や河川など私たちの周りに広く分布する非結核性抗酸菌(NTM)です。通常は無害ですが、免疫が衰えた高齢者、特に閉経後の高齢女性ではNTMが肺に感染すると肺NTM症を発症します。高齢化が進んでいる現代社会において、肺NTM症の患者は日本を含め全世界で増加しています。日本では肺NTM症の約9割はMAC感染によるものです。
肺NTM症の病態は、細菌側の性質のみならず、宿主側要因や環境的要因が複雑に関係していると考えられています。しかしながら、宿主側要因においてMAC感染で宿主細胞の遺伝子発現がどのように変化するのかについて、今まで詳細に解析されていませんでした。とりわけ、ロングノンコーディングRNA(lncRNA)の発現がMAC感染によってどのように変化するかについては、全く調べられていませんでした。lncRNAは、タンパク質をコードしない200ベース以上の長さを持つRNAで、タンパク質をコードする遺伝子RNAと同様に宿主細胞で発現しています。lncRNAは、細胞分化、発がん、個体発生、細菌感染を含む疾患など、多様な生物学的プロセスに関与していることが分かってきています。従って、lncRNAに関する情報は、MAC感染に対する宿主の免疫応答全般を理解する上で必要不可欠と考えられます。
研究手法と成果
MACは宿主の自然免疫[7]をつかさどるマクロファージ細胞に感染します。そこで、培養したマクロファージ細胞をMACに感染させ、理研が開発したCAGE法を用いて感染後4時間、12時間、24時間で、マクロファージ細胞の遺伝子発現がどのように変化するかを解析しました(図1)。
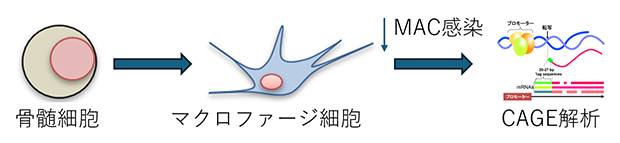
図1 実験方法の概略
マウスの骨髄細胞を大腿骨から取り出し、細胞分化させてマクロファージ細胞を得た。この細胞にMACを感染させ、0、4、12、24時間後に細胞を回収し、CAGE法で解析した。
共同研究グループは、まず、タンパク質をコードする遺伝子の発現変動を調べました。MACに感染したマクロファージ細胞はサイトカインやケモカインと名付けられている免疫や炎症に関わる遺伝子の発現を劇的に上昇させました(図2A、B)。この発現変動は急性炎症に関わるM1[8]と呼ばれる活性化状態とよく似ていました。しかしながら、M1活性化のマーカーであるNos2遺伝子の発現変動は典型的なM1活性化のものとは異なっていました。さらに組織修復に関わるM2[9]と呼ばれる活性化状態のマーカー遺伝子であるArg1遺伝子の発現が持続的に上昇しました(図2C)。
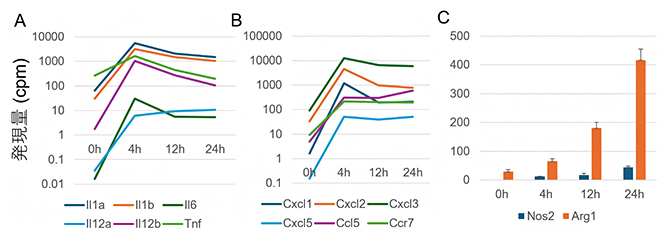
図2 MAC感染で発現変動するタンパクコード遺伝子
- A)サイトカイン遺伝子であるIl1a、Il1b、Il6、Il12a、Il12b、TnfはMAC感染により、いずれも劇的な発現上昇を示した。
- B)ケモカイン遺伝子であるCxcl1、Cxcl2、Cxcl3、Cxcl5、Ccl5、Ccr7も同様にMAC感染により、劇的な発現上昇を示した。
- C)M1マーカー遺伝子Nos2とM2マーカー遺伝子Arg1のMAC感染による発現変動。典型的なM1活性化ではNos2遺伝子は活性化後4時間に発現ピークが観察されるが、MAC感染では観察されなかった。また、M2マーカー遺伝子Arg1はM1活性化では発現上昇がほとんど観察されないが、MAC感染では高い発現上昇を示した。
共同研究グループは、MAC感染によって発現上昇する18個のlncRNAと発現減少する26個のlncRNAを同定しました。発現上昇するlncRNAの発現動態をクラスター解析[10]してみると、早期に上昇するグループと後期に上昇するグループの二つに分類することができました(図3)。そこでこの二つのグループに属するlncRNAの機能を調べたところ、早期上昇グループは免疫活性化に、後期上昇グループは感染に対する免疫反応に関与することが推定されました。
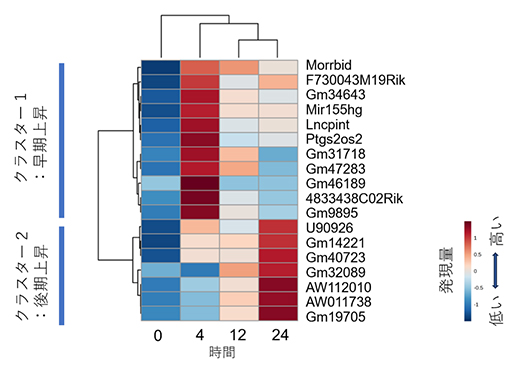
図3 MAC感染によって発現上昇するlncRNAのクラスター解析
MAC感染によって発現上昇するlncRNAについて発現変動パターンをクラスター解析したところ、感染後4時間に発現ピークを持つ早期上昇グループと、感染後24時間に発現ピークを持つ後期上昇グループに分かれた。
共同研究グループは、発現変動するlncRNAから代表的なlncRNAを選び出して、マクロファージ細胞のM1とM2活性化に対する影響を調べました(図4)。いくつかのlncRNAはM1あるいはM2活性化によって発現が変動することが分かりました。さらに、あらかじめM1あるいはM2活性化したマクロファージ細胞にMAC感染させると、活性化なしでMAC感染した場合と比較して発現変動が異なるlncRNAが見つかってくるなど、これらlncRNAがマクロファージ細胞の活性化やMAC感染において多様に発現変動することが明らかとなりました。
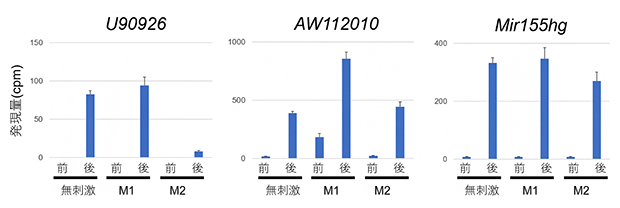
図4 マクロファージ細胞のM1やM2活性化に対するlncRNA発現変動の影響
MAC感染前(「前」と表示)と感染後24時間(「後」と表示)を比較すると三つのlncRNA U90926、AW112010、Mir155hgはいずれも発現上昇する。あらかじめM2活性化したマクロファージ細胞(「M2」と表示)ではU90926の発現上昇は抑えられた。あらかじめM1活性化したマクロファージ細胞(「M1」と表示)ではAW112010の発現がMAC感染前でも上昇し、MAC感染によってさらに上昇した。Mir155hgはM1やM2活性化の影響を受けないことが分かった。
マクロファージ細胞がMACに感染したことを感知するにはtoll様受容体(TLR)[11]、特にTLR2[11]が重要であると報告されています。そこでTLR2遺伝子をノックアウト[12]したマクロファージ細胞にMACを感染させてみました。その結果、多くのlncRNAにおいて、TLR2をノックアウトしたマクロファージ細胞ではMAC感染による発現変動が弱まりました。この結果から、MAC感染におけるlncRNAの発現変化はTLR2を介したものであることが明らかとなりました(図5)。
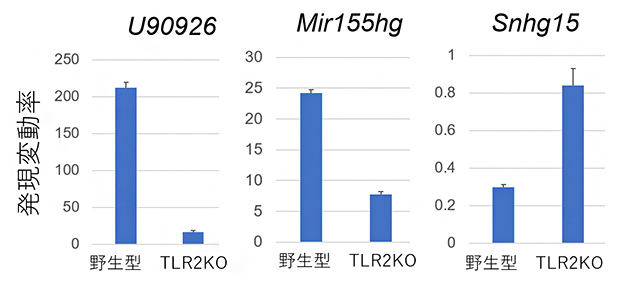
図5 TLR2をノックアウトしたマクロファージ細胞を用いたMAC感染実験
野生型、およびTLR2をノックアウト(TLR2KO)したマクロファージ細胞にMACを感染させ、lncRNAの発現変動率を調べた。lncRNA U90926やMir155hgでは、MAC感染によって野生型マクロファージ細胞では発現が劇的に上昇するが、TLR2をノックアウトしたマクロファージ細胞では発現上昇が抑えられた。lncRNA Snhg15では、MAC感染によって野生型マクロファージ細胞では発現が減少するが、TLR2をノックアウトしたマクロファージ細胞では発現の減少が抑えられた。
今後の期待
肺NTM症の患者は免疫不全の患者や免疫が衰えた高齢者、特に閉経後の女性に多いことが分かっています。高齢化社会を迎えた日本では現状、肺NTM症に感染する患者数が増加しています。今回得られたデータや結果は、MAC感染に対する宿主の免疫反応を理解する上で非常に貴重です。データや結果を基に研究をさらに発展させることによって、肺NTM症の病態の理解や診断が進むことが望まれます。さらに肺NTM症の新たな治療法の開発に貢献することが期待されます。
補足説明
- 1.肺非結核性抗酸菌(NTM)症
結核菌(Mycobacterium tuberculosis)とらい菌を除いた抗酸菌(Mycobacterium)を非結核性抗酸菌(NTM)と呼び、NTMによって生じた肺疾患を肺NTM症と呼ぶ。 - 2.マイコバクテリウムアビウムコンプレックス(Mycobacterium avium complex:MAC)
Mycobacterium属に含まれる細菌のうち、Mycobacterium aviumとMycobacterium intracellulareの二つの細菌を合わせた名称。 - 3.マクロファージ細胞
白血球の一つで、炎症反応や免疫応答をつかさどる細胞。細菌や異物を取り込んで消化する役割を持つとともに、その情報をT細胞に伝える役割を担う。MACや結核菌などいくつかの微生物が増殖するための標的細胞でもある。 - 4.ロングノンコーディングRNA(lncRNA)
タンパク質をコードしない200ベース以上の長さを持つRNAで、タンパク質をコードする遺伝子RNAと同様に、宿主細胞で発現する。lncRNAは、細胞分化、発がん、個体発生、細菌感染を含む疾患など、多様な生物学的プロセスに関与していることが分かってきており、近年注目されている。lncRNAはlong non coding RNAの略。 - 5.宿主
MACなどの感染症において、病原体が感染する対象のこと。 - 6.CAGE法
理研が独自に開発した遺伝子解析技術で、転写開始点と呼ばれるRNAが書き写される領域の先頭(5'端)だけを次世代シーケンサーで解析する方法。読み取った配列をゲノム上にマッピングして数えることで、転写開始点を同定するとともに、各転写開始点から書き出されているRNAの数を定量することができる。CAGEはCap Analysis of Gene Expressionの略。 - 7.自然免疫
人間を含む多くの生物に備わっている仕組みで、病原体を認識して攻撃することで病原菌を排除する役割を持つ。 - 8.M1
マクロファージ細胞の活性化の一つ。T細胞から放出されるインターフェロンガンマ(IFNγ)によって引き起こされ、炎症反応や細菌破壊作用を示す。M1活性化するときは、M2活性化は起こらない。 - 9.M2
M1とは異なるマクロファージ細胞の活性化の一つ。サイトカインのインターロイキン4(IL4)やインターロイキン13(IL13)によって引き起こされ、組織修復に関わる。M2活性化するときは、M1活性化は起こらない。 - 10.クラスター解析
異なる性質が混じり合った集団から、互いに似た性質を持つものをまとめる解析。 - 11.toll様受容体(TLR)、TLR2
動物の細胞表面にあるタンパク質で、病原体を感知する機能がある。TLR2はTLRの一つであり、病原体のリポタンパク質を感知する自然免疫受容体の一つ。TLRはtall-like receptorの略。 - 12.ノックアウト
遺伝子を破壊して標的タンパク質を発現する機能をなくすこと。
共同研究グループ
理化学研究所 生命医科学研究センター 細胞機能変換技術研究チーム
チームリーダー 鈴木 治和(スズキ・ハルカズ)
研究員(研究当時)アンドリュー・クオン(Andrew T. Kwon)
研究員 秦 咸陽(シン・カンヨウ/Qin Xian-Yang)
人材派遣 西村 創(ニシムラ・ハジメ)
テクニカルスタッフⅠ 前田 紫緒里(マエダ・シオリ)
国立感染症研究所 ハンセン病研究センター 感染制御部
室長 星野 仁彦(ホシノ・ヨシヒコ)
主任研究官 吉田 光範(ヨシダ・ミツノリ)
主任研究官 宮本 友司(ミヤモト・ユウジ)
産業医科大学 医学部 免疫学・寄生虫学講座
准教授 吉田 安宏(ヨシダ・ヤスヒロ)
研究支援
本研究は、日本医療研究開発機構(AMED)新興・再興感染症に対する革新的医薬品等開発推進研究事業「活性型・抑制型自然免疫受容体解析による抗酸菌潜伏および持続感染の成立、維持と再活性化機序解明に基づく新規治療法開発(研究代表者:星野仁彦)」「抗酸菌潜伏感染・再活性化の疫学とその機序に基づいた新規治療法開発(研究代表者:星野仁彦)」による助成を受けて行われました。
原論文情報
- Yoshida M, Kwon AT, Qin XY, Nishimura H, Maeda S, Miyamoto Y, Yoshida Y, Hoshino Y, Suzuki H, "Transcriptome analysis of long non-coding RNAs in Mycobacterium avium complex-infected macrophages", Frontiers in Immunology, 10.3389/fimmu.2024.1374437
発表者
理化学研究所
生命医科学研究センター 細胞機能変換技術研究チーム
チームリーダー 鈴木 治和(スズキ・ハルカズ)
国立感染症研究所 ハンセン病研究センター 感染制御部
室長 星野 仁彦(ホシノ・ヨシヒコ)
主任研究官 吉田 光範(ヨシダ・ミツノリ)
 鈴木 治和
鈴木 治和
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
国立感染症研究所
Tel: 03-5285-1111
Email: info [at] nih.go.jp
※[at]は@に置き換えてください。
