理化学研究所(理研)生命機能科学研究センター 染色体分配研究チームの浅井 皓平 研究パートタイマーⅠ、シュウ・エンタク 大学院生リサーチ・アソシエイト、竹之内 修 基礎科学特別研究員、北島 智也 チームリーダーの研究チームは、分裂中の細胞で染色体[1]のように振る舞う人工動原体[2]ビーズを開発しました。
本研究成果は、染色体分配に中心的な役割を果たす構造体である動原体の作用機序について研究する新規アプローチを提供し、染色体分配の人為的な操作による染色体分配異常の抑制に向けた研究などへの展開が期待できます。
細胞分裂の際に染色体を均等に分配するための必要条件となるのが、紡錘体(ぼうすいたい)[3]の両極から伸びた微小管が染色体に両方向から接続する「両方向性の確立」です。微小管[4]と染色体をつなぐ接続点である動原体は、両方向性の確立のために、微小管の正しい接続を感知して安定化させる機能を持ちます。しかし動原体を構成する100種類を超えるタンパク質の中に、両方向性の確立に必要十分といえるものが存在するかどうかは分かっていませんでした。
今回、研究チームは、人工物であるビーズを土台にして動原体を構築する試みに挑戦しました。生細胞内に注入した微小ビーズに2種類の動原体タンパク質[5]を集積させたところ、それだけで両方向性が確立し、これまで動原体機能に重要であると考えられてきたタンパク質の多くはビーズの両方向性確立に不要であることが分かりました。さらに、大きさの異なる人工動原体ビーズの比較から、両方向性確立の効率は土台サイズに依存するという新しい知見を得ました。
本研究は、科学雑誌『Science』電子版に9月19日付(日本時間9月20日)で公開され、印刷版の9月20日号に掲載されます。
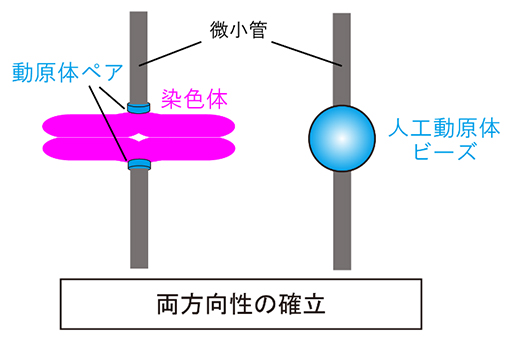
動原体ペアにより両方向に引っ張られる染色体と、今回開発した人工動原体ビーズの模式図
背景
染色体は細胞分裂の際、娘細胞へ均等に分配されます。細胞分裂における染色体分配は、細胞が遺伝情報を正しく継承するための根本的なプロセスです。細胞は分裂期に入ると、微小管で構成される二極性の紡錘体を形成します。紡錘体の微小管は、複製された染色体のセントロメアDNA[6]上に構築される動原体と呼ばれる構造体に接続します。このとき、微小管が正しく動原体に接続することによって、続いて起こる染色体分配を正しく行うことができます。すなわち、それぞれの染色体にある動原体ペアを、紡錘体の両極へ向け、両方向にバランスよく引っ張るように接続しなくてはなりません(図1)。このように、染色体を両方向に引っ張る正しい接続が安定になった状態は、染色体の「両方向性の確立」と呼ばれ、染色体分配のために最も重要な必要条件です。
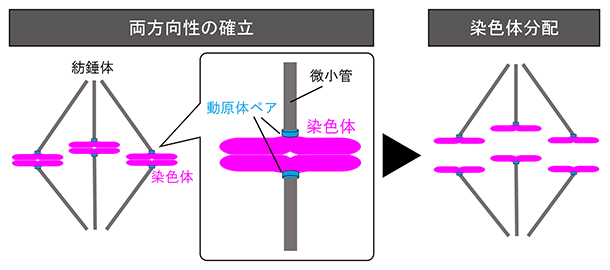
図1 染色体の両方向性の確立
正しい染色体分配のためには、紡錘体の両極から伸びた微小管が、それぞれの染色体上にある動原体ペアに両方向から接続して、それらをバランスよく引っ張る必要がある。動原体は正しく引っ張られる力を感知することで、正しい微小管の接続を選択的に安定化し、一方で間違った接続を不安定化して修正する。これにより、染色体の両方向性を確立し、続いて起こる正しい染色体分配が可能となる。
両方向性の確立を担うのが、微小管が接続する構造体である動原体です。動原体は、染色体のセントロメアDNAを土台として、100種類を超えるタンパク質から構成される巨大な複合体です(図2)。動原体は単なる構造体ではなく、正しい微小管接続を感知して選択的に安定化し、間違った接続を修正する機能を持つ、自律的な機械です。これまでの遺伝子ノックダウン[7]など、既存のアプローチを用いた研究からは、動原体を構成するタンパク質を細胞から除去すると、動原体の構造に異常を来し、両方向性確立の機能が失われることが示されてきました。これらのことから、動原体に含まれる多くのタンパク質が協調的に働くことで、両方向性確立の機能が発揮されると考えられていました。しかし、両方向性を確立する機能を有する動原体の再構成はいまだに達成されておらず、両方向性確立の機能に必要十分な中核機構を担う部品が動原体の巨大構造の中に存在するかどうかも分かっていませんでした。
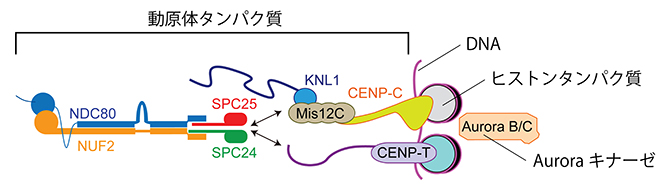
図2 動原体の模式図
動原体は、100種類を超えるタンパク質で構成される巨大な複合体である。この模式図では、本研究に関わる主なものを記載した。
研究手法と成果
研究チームは、生きた細胞の中で微小ビーズを土台にして人工動原体を構築するという大胆な試みに挑戦しました。微小ビーズを顕微注入するための細胞としては、通常の体細胞の数十~数百倍の体積があり、巨大な細胞質を持つマウス卵母細胞を用いました。まず、微小管結合ドメインを持つ動原体タンパク質(NDC80)と緑色蛍光タンパク質(GFP)との融合タンパク質(NDC80-GFP)をコードするmRNAと、NDC80とヘテロ2量体を形成する動原体タンパク質(NUF2)をコードするmRNAを、生きた卵母細胞に顕微注入し、これらを細胞内で発現させました。続いて、抗GFP抗体[8]が表面に吸着した直径約2マイクロメートル(μm、1μmは100万分の1メートル)の微小ビーズを顕微注入しました(図3)。すると、2種類の動原体タンパク質(NDC80-GFPとNUF2)を共に微小ビーズの表面上に集積させることができました。以降、このビーズをNDC80-NUF2ビーズと呼ぶことにします。
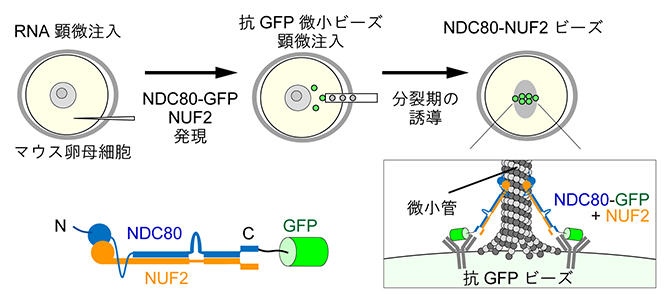
図3 人工動原体ビーズの作製
- 上)マウス卵母細胞に微小ビーズを顕微注入し、微小ビーズの表面に蛍光タンパク質GFPを融合させた動原体タンパク質NDC80-GFPとNUF2のヘテロ2量体を集積させて、NDC80-NUF2ビーズを作製した。細胞を分裂期に進行させ、ライブイメージングでビーズの挙動を解析することができる。
- 下)NDC80-GFPとNUF2のヘテロ2量体、および人工動原体ビーズ表面の模式図。微小ビーズの表面には抗GFP抗体が吸着しており、ヘテロ2量体はNDC80-GFPのGFP領域と抗GFP抗体の結合によりビーズ表面に集積する。
ライブイメージング[9]により、分裂期を通してNDC80-NUF2ビーズの挙動を追跡したところ、NDC80-NUF2ビーズはあたかも染色体のように振る舞って紡錘体の赤道面上に整列し、その状態が安定に保たれることが分かりました(図4)。一方で、微小管結合ドメインを持つ別のタンパク質をビーズに集積させても、それらは整列しませんでした。NDC80-NUF2ビーズが紡錘体の赤道面に整列するということは、両方向からバランスよく微小管に引っ張られた状態、すなわち両方向性が確立したことを示唆します。
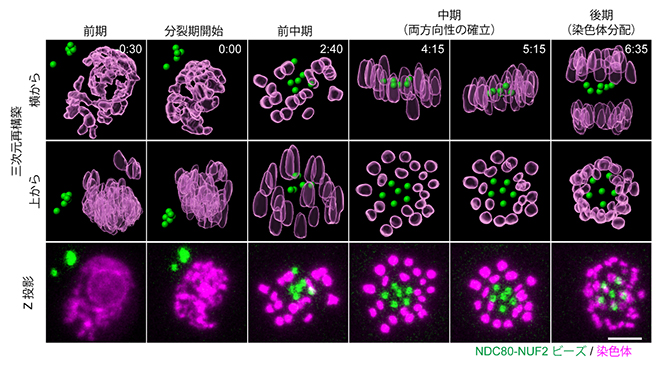
図4 染色体と同様に整列する人工動原体ビーズ
NDC80-NUF2ビーズ(緑)は、染色体(マゼンタ)と同様に、分裂期中期までに紡錘体の赤道面で整列する。後期では染色体が分離して染色体分配が起こるが、ビーズは分離しないため、中央部に取り残される。数字は分裂開始時を起点にした経過時間(分)。
そこで、NDC80-NUF2ビーズが確かに微小管と接続しているかを調べるため、安定微小管のマーカー(HURPタンパク質とアセチル化チューブリン[4])を用いた免疫染色[10]を行いました。その結果、紡錘体赤道面に整列したNDC80-NUF2ビーズに、微小管が両方向から接続していることが分かりました(図5)。従って、NDC80-NUF2ビーズは両方向性を確立する機能を有していると結論しました。
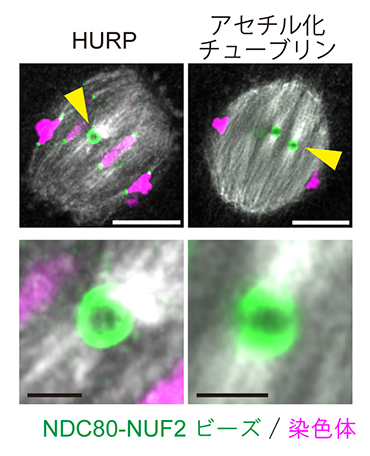
図5 人工動原体ビーズの両方向性の確立
紡錘体の赤道面に整列したNDC80-NUF2ビーズの免疫染色画像。安定微小管のマーカーとしてHURPおよびアセチル化チューブリンを用いた。いずれの免疫染色画像でも、NDC80-NUF2ビーズに両方向から微小管が接続していることが観察された。スケールバーは10μm(上)と2μm(下)。
天然の動原体では、その土台であるセントロメアDNAとNDC80-NUF2の間に多種多様な動原体タンパク質が存在し、その多くは、染色体が両方向性を確立するために必要です。従って、ビーズにNDC80-NUF2を集積させるだけで両方向性を確立する能力を付与できたことは、全く予想外の結果でした。ただし細胞内にはさまざまなタンパク質が発現しているため、ビーズにはNDC80-NUF2のみを人為的に集積させたものの、NDC80-NUF2と相互作用する他の動原体タンパク質が細胞内プールから追加でリクルートされたことで、ビーズが両方向性を確立できるようになった可能性も考えられます。天然の動原体では、NDC80-NUF2はSPC24-SPC25タンパク質と直接結合し、SPC24-SPC25は他の動原体タンパク質と相互作用することでセントロメアDNAとNDC80-NUF2の間を橋渡して、染色体の両方向性確立を可能にしています。同様に、ビーズにもNDC80-NUF2がSPC24-SPC25を介して他の動原体タンパク質と相互作用することで、両方向性を確立できるようになった可能性が考えられました。
そこで研究チームは、SPC24-SPC25との結合ドメインを欠損したNDC80ΔSPC-NUF2を細胞に発現させ、ビーズに集積させました。すると、NDC80ΔSPC-NUF2ビーズも、NDC80-NUF2ビーズや染色体と同様に、紡錘体赤道面に整列できることが分かりました(図6)。さらにこれらのビーズへの動原体タンパク質のリクルートの有無を調べていった結果、染色体の両方向性確立に必要であるKNL1、Mis12複合体、CENP-T、CENP-Cといった動原体タンパク質のいずれもが、ビーズが両方向性を確立するためには必要ないことが分かりました。また同様に、染色体の両方向性確立に必要であるAuroraキナーゼ[11]も、ビーズには必要ないことが分かりました。
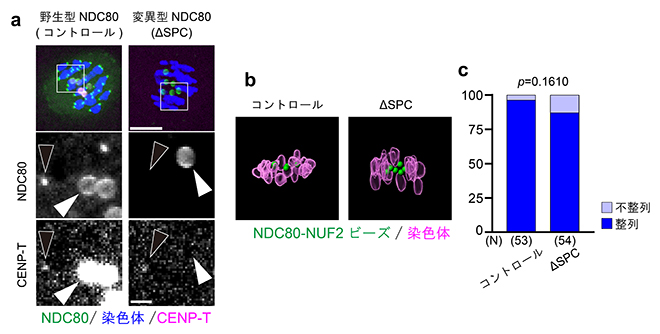
図6 細胞内の動原体タンパク質に依存しない人工動原体ビーズの両方向性の確立
- a)NDC80-NUF2ビーズは、細胞内の動原体タンパク質(ここではCENP-T)をリクルートする(白矢頭)。一方、結合ドメインを欠失したNDC80ΔSPC-NUF2ビーズはCENP-Tをリクルートしない。黒矢頭は染色体上の動原体シグナル。スケールバーは10μm(上)と2μm(下)。
- b)NDC80ΔSPC-NUF2ビーズはCENP-Tをリクルートしないにもかかわらず、NDC80-NUF2ビーズや染色体と同様に赤道面に整列する。
- c)整列したNDC80-NUF2ビーズの頻度。コントロール群とNDC80ΔSPC-NUF2ビーズ(ΔSPC)群で統計的な有意差はなかった。グラフ下の数字は解析したビーズの数を示す。
では、NDC80-NUF2ビーズは一体どのように両方向性を確立しているのでしょうか。研究チームは、染色体上に構築される本来の動原体が直径約250ナノメートル(nm、1nmは10億分の1メートル)の円盤状の構造であるのに対し、NDC80-NUF2ビーズは直径約2μmの球であり、両者のサイズは著しく異なることに着目しました。そこで、直径約1μmと直径約2μmの大きさの異なるNDC80-NUF2ビーズを細胞内に導入し、その挙動に違いがあるかを調べました。その結果、小さいサイズのものは大きいサイズのものに比べて、紡錘体赤道面への整列が遅れることが分かりました(図7)。この結果は、NDC80-NUF2ビーズの大きな土台サイズが、両方向性の確立を促進することを示しています。動原体機能が土台サイズに依存することは、染色体上の土台であるセントロメアDNAが、数十万~数百万塩基対という巨大なサイズに進化していった理由に説明を与えるものと考えられます。
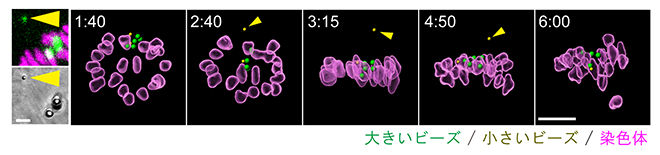
図7 サイズの影響を受ける人工動原体ビーズの挙動
サイズの異なるNDC80-NUF2ビーズを導入し、整列の速度を比較した。小さいビーズは大きいビーズに比べ、整列するタイミングが遅い傾向が見られた(黄矢頭)。スケールバーは2μm(左)と10μm(右)。
今後の期待
本研究では、生きた細胞内で動原体タンパク質NDC80-NUF2を微小ビーズに集積させることによって、両方向性確立の機能を有する人工動原体ビーズの開発に成功しました。このことは、ビーズに両方向性を確立させるにはNDC80-NUF2の2種類のタンパク質を集積させれば十分であることを示しており、NDC80-NUF2を起点とする機構が動原体機能の中核にあることを示唆しています。また、NDC80-NUF2とセントロメアDNAの間をつなぐ多種多様な動原体タンパク質は、無機質なビーズと代替可能であることが示されました。今後は、人工動原体の土台にあるビーズを磁気ピンセット[12]で操作し、動原体と微小管の接続の力学的な特性を細胞内で測定するなど、これまでにはない研究アプローチが可能になります。また、人工動原体ビーズの開発と同様の手法を用いることで、動原体に限らず、マイクロマシンや疑似細胞小器官などさまざまな細胞内構造体を人工的に構築する研究への展開が期待されます。
人工動原体ビーズは、染色体分配を操作する研究のためのツールとしても強力です。研究チームは最近、人工動原体ビーズを用いて、老化したマウス卵母細胞における染色体の早期分離の頻度を減少させたことを報告しました注1)。染色体の早期分離は、流産や先天性疾患を引き起こす卵子の染色体数異常の主要な原因です。人工動原体のデザインを改良していくことで、生殖補助医療などへの貢献に向けた研究の展開も期待されます。
- 注1)2024年7月19日プレスリリース「卵子の老化で小さな染色体が正しく分配されない原因」
補足説明
- 1.染色体
真核生物のDNAはヒストンタンパク質と結合して存在しており、細胞分裂時に凝縮して特徴的な形態をとったものを染色体と呼ぶ(ただし、間期の染色質も染色体と呼ぶことも多い)。減数分裂は、真核生物の生殖器官(精巣や卵巣)にある生殖細胞で見られ、配偶子(精子や卵子)を作るため、二つの分裂が連続して起きる特別な様式の細胞分裂。生殖細胞である卵母細胞の中の染色体は減数第一分裂に入ると凝集し、マウスにおいては20本の染色体になる。個々の染色体は4本の染色分体から成る二価染色体を形成する。分裂期中期になると、染色体の動原体に微小管が接合し、染色体は両極から張力を受ける。分裂期終期になると、二価染色体は分配され、一価染色体になる。20本の染色体は、19本の常染色体と1本の性染色体(X染色体)を含む。常染色体は、そのサイズに応じて番号が割り振られる(マウスの常染色体は、1番染色体~19番染色体、番号が大きいほど染色体のサイズは小さい)。ヒト卵母細胞は、22本の常染色体と1本の性染色体を含む。 - 2.動原体
動原体は染色体のくびれ部分の上に形成されるタンパク質複合体で、NDC80はその構成タンパク質の一つ。染色体分配の際に、微小管が染色体を動かすためのけん引部位となる。体細胞分裂では姉妹染色分体のそれぞれに動原体が一つずつ形成され、減数第一分裂では相同染色体のそれぞれに動原体が一つずつ形成される。 - 3.紡錘体(ぼうすいたい)
細胞分裂の際に染色体を分配するための細胞内構造で、主に微小管([4]参照)から構成される。 - 4.微小管、チューブリン
微小管は細胞内で繊維状の構造をとる細胞骨格の一つ。αチューブリンとβチューブリンと呼ばれるタンパク質のヘテロ2量体が重合し、円筒状の繊維を形成して、重合・脱重合を可逆的に行うことで形態を変化させる。微小管には方向性があり、重合・脱重合が起きやすい末端をプラス端、反対側をマイナス端と呼ぶ。また、チューブリン重合の核となる構造を「微小管形成中心」と呼び、多くの動物の体細胞分裂では、主に中心体がその役割を果たすが、哺乳類の卵母細胞は中心体を持たない。哺乳類卵母細胞の紡錘体形成では、マイナス端が紡錘体の両極へ、プラス端が中央へ向かって配向し、これにより紡錘体は両極へ伸長した形をとり、微小管のマイナス端に存在する構造体である微小管形成中心は紡錘体の両極へ配置される。 - 5.動原体タンパク質
動原体を構成する100種類以上のタンパク質の総称。紡錘体微小管との接続を担うもの(outer kinetochore proteins)と、outer kinetochore proteinsとセントロメアDNAとの結合を担うもの(inner kinetochore proteins)に大別される。本リリースで記載したNDC80、NUF2、KNL1、Mis12複合体、SPC24-SPC25はouter kinetochore proteinに属し、CENP-T、CENP-Cはinner kinetochore proteinに属する。 - 6.セントロメアDNA
染色体([1]参照)上で動原体([2]参照)が形成される土台となる配列を含むDNA領域。多数のリピート配列から成り、配列のパターンやサイズは種間で多様である。ヒトでは、セントロメアDNAを構成するリピート配列が全ゲノムの約6%の長さに及ぶ。セントロメアDNAに特異的なヒストンがヌクレオソームを構成することにより、特殊なクロマチン構造をとる。このクロマチン構造を土台に、動原体タンパク質が集積する。 - 7.ノックダウン
mRNAの分解や翻訳抑制などの操作により、遺伝子機能の発現を大幅に低下させること。 - 8.抗GFP抗体
GFPタンパク質を抗原として認識する抗体。 - 9.ライブイメージング
試料を固定せず、生きた状態の細胞や組織を観察することをライブイメージングと呼ぶ。4Dイメージングは、4次元(空間3次元+時間1次元)データを取得できるライブイメージング技術。 - 10.免疫染色
細胞内のある特定のタンパク質の局在を可視化する手法。標的タンパク質を特異的に認識する1次抗体と、1次抗体を抗原として蛍光物質などが結合した2次抗体を用いることで、抗原の局在を顕微鏡で可視化する。 - 11.Auroraキナーゼ
細胞分裂に関わるキナーゼ(タンパク質リン酸化酵素)の一種。動原体タンパク質をリン酸化して微小管と動原体の接続を制御する。 - 12.磁気ピンセット
磁力を用いて微小ビーズを捕捉・操作する技術。
研究チーム
理化学研究所 生命機能科学研究センター 染色体分配研究チーム
研究パートタイマーⅠ 浅井 皓平(アサイ・コウヘイ)
(京都大学大学院生命科学研究科 大学院生(研究当時))
大学院生リサーチ・アソシエイト シュウ・エンタク(Zhou Yuanzhuo)
(京都大学大学院生命科学研究科 大学院生)
基礎科学特別研究員 竹之内 修(タケノウチ・オサム)
チームリーダー 北島 智也(キタジマ・トモヤ)
(生命機能科学研究センター 副センター長)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(A)「動的な生殖ライフスパン:変動する生殖細胞の機能と次世代へのリスク(領域代表者:北島智也)」、同新学術領域研究(研究領域提案型)「染色体イメージングによる卵子インテグリティの予見(研究代表者:北島智也)」、同基盤研究(B)「哺乳類卵母細胞における紡錘体二極化の機構の解明(研究代表者:北島智也)」、三菱財団研究助成金、および理研新領域開拓課題「長時間分子生物学(領域代表者:北島智也)」による助成を受けて行われました。また、竹之内修は、理化学研究所の基礎科学特別研究員制度の支援を受け、研究を遂行しました。
原論文情報
- Kohei Asai, Zhou Yuanzhuo, Osamu Takenouchi, Tomoya S. Kitajima, "Artificial kinetochore beads establish a biorientation-like state in the spindle", Science, 10.1126/science.adn5428
発表者
理化学研究所
生命機能科学研究センター 染色体分配研究チーム
研究パートタイマーⅠ 浅井 皓平(アサイ・コウヘイ)
大学院生リサーチ・アソシエイト シュウ・エンタク(Zhou Yuanzhuo)
基礎特別科学研究員 竹之内 修(タケノウチ・オサム)
チームリーダー 北島 智也(キタジマ・トモヤ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
