理化学研究所(理研)生命機能科学研究センター 転写制御構造生物学研究チームの関根 俊一 チームリーダー、永沼 政広 研究員、江原 晴彦 上級研究員、東京大学定量生命科学研究所 先端定量生命科学研究部門 クロマチン構造機能研究分野の胡桃坂 仁志 教授、鯨井 智也 助教らの共同研究グループは、遺伝情報を読み取るタンパク質の巨大複合体「RNAポリメラーゼII(RNAPII)[1]」がDNAの配列を読み取って、RNAをつくる転写[1]を始めた直後に、転写を抑制する転写伸長因子[2]やヌクレオソーム[3]という構造体との相互作用によって転写を一時停止する仕組みを、分子レベルで明らかにしました。
本研究成果は、遺伝子が発現する際の複雑な制御メカニズムへの理解を深め、がんやウイルス感染症といった疾患の仕組みの解明に貢献すると期待されます。
ヒトを含む動物細胞の核内では、転写を開始したRNAPIIは、DNA上を少し進んだところで一時停止することが知られています。これは、それ以降の転写を進める準備の整ったRNAPIIだけを通過させるチェックポイントと考えられており、適切なタイミングで転写を再開させることで、遺伝子の発現を制御する主要な機構の一つとしても機能しています。
今回、共同研究グループは、タンパク質の巨大複合体を観察できるクライオ電子顕微鏡[4]を用いて、負の転写伸長因子NELF[5]と結合したRNAPIIがヌクレオソームと衝突し、転写が一時停止する様子を観察しました。その結果、NELFは、衝突後のRNAPIIをヌクレオソーム内部に侵入させ、ブレーキのようにRNAPIIの進行を停止させる強固な複合体の確立に寄与することを明らかにしました。
本研究は、科学雑誌『Science Advances』オンライン版(3月5日付:日本時間3月6日)に掲載されました。
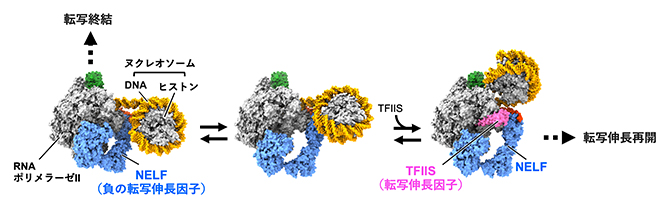
転写開始直後のRNAポリメラーゼII(RNAPII)が一時停止するメカニズム
背景
ヒトを含む真核生物では、DNAはヒストン[3]というタンパク質に巻き付いて、ヌクレオソームと呼ばれる構造をつくり、クロマチン[3]構造を取って核の中にコンパクトに収納されています(図1)。このDNAには、生物の設計図となる遺伝情報が含まれています。RNAポリメラーゼII(RNAPII)は、この設計図を読み取ってRNAをつくり出す役割を持っています。このプロセスは「転写」と呼ばれ、遺伝情報が発現するための最初のステップです。
転写は、①転写開始、②転写伸長、③転写終結の三つの段階に分けられ、それぞれの段階は、RNAPIIに結合するさまざまな因子によって制御されながら進行します。転写はまず、RNAPIIがDNA上の「転写開始点」と呼ばれる特定の場所から遺伝子を読み取ることで始まります。ヒトを含む動物細胞では、RNAPIIは転写を開始して20~60塩基対ほど進んだ位置で一時停止することが知られています(図2A)。この現象はpromoter-proximal pausing(プロモーター近傍での一時停止)と呼ばれ、転写の準備を整えつつ、適切なタイミングで転写を再開できるようにする制御機構です。一時停止は、その後の転写伸長がスムーズに進むためのチェックポイントとなっており、幹細胞の分化や胚発生において重要な役割を果たしています。
転写の一時停止には、RNAPIIに結合するNELFやDSIF[6]と呼ばれる負の転写伸長因子とともに、転写されているDNAのヌクレオソーム構造(特に転写開始点に最も近い+1ヌクレオソーム)が関与していることが報告されています(図1)。NELFとDSIFが結合したRNAPIIの複合体構造を解析した先行研究注1)により、NELFによる転写伸長抑制の仕組みの一端は解明されていますが、これにヌクレオソームがどのように関わっているのかは今日までよく分かっていません。
本研究では、実際の細胞内により近い状況での複合体構造を調べるため、ヌクレオソームDNAを転写中のRNAPIIが一時停止した状態の構造を、クライオ電子顕微鏡で解析しました。
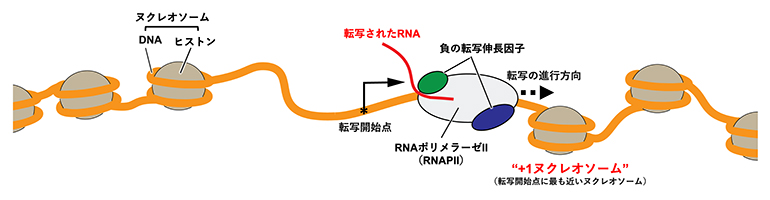
図1 転写開始直後のクロマチン構造の模式図
転写開始点付近では、クロマチン構造が緩んで(ヌクレオソームの密度が低くなって)RNAポリメラーゼIIがDNAにアクセスしやすくなり、転写が始まる。このとき、進行方向に存在する転写開始点に最も近いヌクレオソームを+1ヌクレオソームと呼び、転写開始直後の一時停止に関与することが示唆されている。
- 注1)S. M. Vos, L. Farnung, H. Urlaub, P. Cramer, Structure of paused transcription complex Pol II-DSIF-NELF. Nature 560, 601-606 (2018).
研究手法と成果
共同研究グループは、まず哺乳類のRNAPIIを用いた転写系を確立しました。次に、その系を用いて、NELFとDSIFの存在下でRNAPIIによるヌクレオソームDNAの転写反応を行い、一時停止の様子をクライオ電子顕微鏡で観察し、データ測定および構造解析を実施しました(図2)。
構造解析の結果、NELFとDSIFが結合したRNAPII複合体は、ヌクレオソームの手前まで転写を進めて停止していました(図2A)。RNAPIIは、進行中に障害物と衝突するなど転写が妨げられるとDNA上を後退することがあり、RNAPII複合体はヌクレオソームにぶつかって後退したことによって形成されたと考えられます。
さらに解析を進めていくと、NELFにはRNAPIIに対する結合様式(モード)が2種類あることが分かりました(図2B、C)。一つ目の「モード1」は、以前に報告された構造と同様の構造で注1)、NELFはヌクレオソームDNAから離れた位置に存在していました(図2B)。一方、二つ目の「モード2」では、NELFはこれまで報告されたことのない新規の様式で結合していました(図2C)。このときNELFは、ヌクレオソームDNAに直接接触しており、生化学的実験の結果、この接触は転写を停止するためのブレーキのように働いていることが明らかになりました。
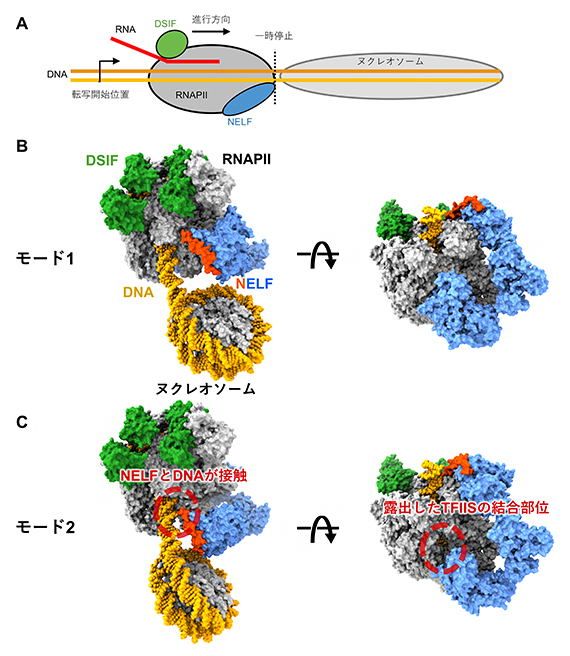
図2 ヌクレオソームDNAを転写時に一時停止するRNAPII-DSIF-NELF複合体の構造
- A) ヌクレオソームDNAを転写し一時停止するRNAPII-DSIF-NELF複合体の模式図。転写開始点からDNAの読み取りを始めたRNAPIIが、転写開始点に最も近いヌクレオソーム(+1ヌクレオソーム)の手前で一時停止している。
- B、C) RNAPII-DSIF-NELF複合体の構造を二つの方向から見た図。複合体の表面を見やすくするため、右図ではヌクレオソームを省略している。ヌクレオソームDNAを転写するRNAPIIにDSIFと、モード1のNELF(B)またはモード2のNELF(C)が結合している。モード2ではNELFとDNAが接触し、転写伸長因子TFIISの結合部位は露出している。NELFのDNAに接近する領域をオレンジ色にしている。
前述のように、障害物にぶつかったRNAPIIは、DNA上を後退して停止する性質があります。この一時停止を解除する因子として、転写伸長因子TFIIS[7]が知られています。モード1とモード2の複合体構造の大きな違いの一つは、TFIISが結合するRNAPII上の領域が、NELFでふさがれているか(モード1)、ふさがれていないか(モード2)にあります(図2C)。
そこでTFIISの存在下で転写を行い、形成された一時停止複合体の構造をクライオ電子顕微鏡によって決定しました(図3)。予想通り、モード2のNELFとともに、TFIISはRNAPIIに結合していました(図3B)。このときのRNAPIIは、モード2での停止位置からさらに転写を進めてヌクレオソームに到達し、新たな一時停止複合体を形成していました(図3A、B)。ヌクレオソームに到達したRNAPIIの先端は、ヒストンからDNAを部分的に引き剥がした状態で停止しており(図3C)、この停止位置は、転写伸長中のRNAPIIがヌクレオソーム内で停止しやすい位置と一致していました注2)。さらにNELFの一部分は、ヌクレオソームDNAとも直接結合していました。従って+1ヌクレオソームでは、ヌクレオソームが転写の障壁となるだけでなく、モード2のNELFがDNAと相互作用することでブレーキをかけ、障壁がさらに強化され、RNAPIIの前進を妨げていると考えられます。このようにNELFとヌクレオソームが協調してRNAPIIに対する高い障壁を形成し、ヌクレオソームを乗り越えてそれ以上転写が進むのを強く制限していることが明らかになりました。
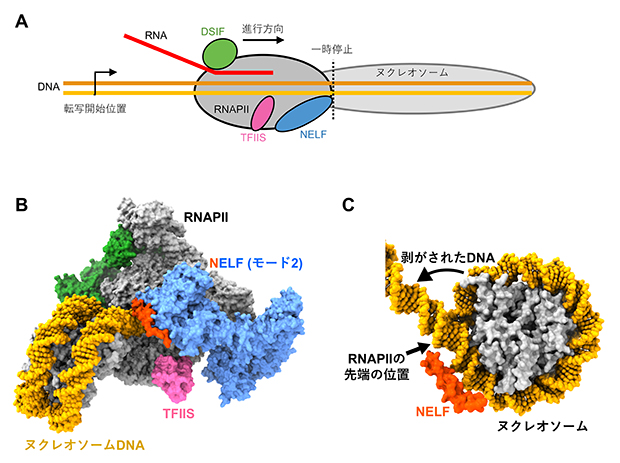
図3 ヌクレオソームDNA上で一時停止するRNAPII-DSIF-NELF-TFIIS複合体の構造
- A)ヌクレオソームDNAに到達して一時停止するRNAPII-DSIF-NELF-TFIIS複合体の模式図。RNAPIIがヌクレオソームに部分的に侵入して一時停止している。
- B)ヌクレオソームDNAを転写し一時停止するRNAPII-DSIF-NELF-TFIIS複合体の構造。TFIISは、RNA合成の材料となるリボヌクレオシド3リン酸のRNAPIIへの入口(セカンダリーチャネル)に結合している。
- C)RNAPIIによって剥がされたヌクレオソームDNA。NELFの先端がヌクレオソームDNAに接触して、それ以上のRNAPIIの進行を抑えている。このときのRNAPIIの停止位置は、ヌクレオソームDNAが約20塩基対ほどけた状態で止まりやすい位置に一致していた。
以上の結果をまとめると、プロモーター近傍で転写が一時停止するメカニズムは以下のように説明できると考えられます(図4)。
- ①転写開始点直下の+1ヌクレオソームは転写の障壁を形成しており、NELFとDSIFが結合したRNAPII複合体は+1ヌクレオソームに衝突すると後退し、転写が一時停止する。
- ②一時停止時のRNAPII複合体において、NELFの結合様式はモード1とモード2の平衡状態にある。モード2の状態でRNAPII複合体にTFIISが結合すると転写が再開されるが、RNAPIIがヌクレオソームに部分的に侵入することで結果的にその状態で停止した強固な複合体が形成される。
(ここからの転写の再開には、抑制を解除する正の転写伸長因子(P-TEFb)を必要とする) - ③一方、一時停止したRNAPIIの一部は転写を再開せず、DNAを解離して転写を終結する。
(RNAPIIとDNAの解離には、転写終結を制御する因子とモード1のNELFとの結合が関与する)
すなわち、今回新たに見いだしたNELFの2種類のモードは、転写を終結させるか(モード1)、転写を伸長させるか(モード2)の運命決定に関わる、重要な転写制御機構の一つであることが示唆されます。
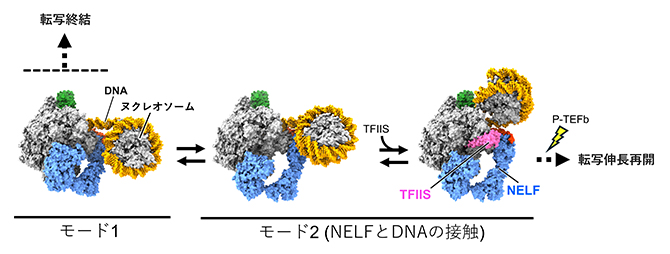
図4 転写開始直後のRNAPIIが一時停止するメカニズムのモデル
モード1とモード2は平衡状態にあり、モード1は転写終結へ向かう。一方、モード2で転写伸長因子TFIISがRNAPIIに結合すると、後退による一時停止が解除されて転写が再開し、RNAPIIが先へ進む。しかしRNAPIIは、NELFとDNAの接触(NELFの赤部分と接触する黄色の二重らせん)によって乗り越えにくくなったヌクレオソームの構造的障壁によって再び停止する。P-TEFbによって抑制が解除されると、NELFを解離してその先に転写を進められるようになる。
- 注2)2019年2月8日プレスリリース「コンパクトなDNAをスムーズに転写する仕組み」
今後の期待
転写の一時停止現象は、幹細胞の分化や胚発生との関連が示唆されている他、ストレス関連遺伝子やがん遺伝子、ウイルス遺伝子の転写でも確認されています。本研究で得られた成果は、動物の発生や細胞のストレス応答などを理解するための重要な基盤となり、がんやウイルス感染症など、転写制御の異常・破綻によって起こる疾患のメカニズムの解明や、治療法の研究に寄与することが期待されます。
補足説明
- 1.RNAポリメラーゼII(RNAPII)、転写
DNA配列を鋳型にしてRNAが合成されることを転写と呼び、細胞内ではDNA依存性RNAポリメラーゼ(RNAP)により行われる。真核生物は3種のRNAポリメラーゼを持ち、RNAポリメラーゼII(RNAPII)はmRNAの合成を担当する。複数のタンパク質(サブユニット)が集合してできた巨大な複合体(分子量約40万~50万)で、細菌からヒトまで共通した"カニのはさみ"のような形をしている。およそ10塩基対のDNAをほどいて「転写バブル」を形成し、一方のDNA鎖を鋳型にしてRNAを合成する。 - 2.転写伸長因子
RNAポリメラーゼに結合し、転写反応を制御するタンパク質を転写因子と総称し、その内RNAの伸長ステップを制御する因子が転写伸長因子。本研究では、転写反応を抑制する負の転写伸長因子としてNELFとDSIFを、転写伸長を促進する正の転写伸長因子としてTFIISを用いて構造解析を行った。 - 3.ヌクレオソーム、ヒストン、クロマチン
DNAを巻き付けることで、長大なDNAを核内に納めるタンパク質をヒストンという。H2A、H2B、H3、H4の4種類のコアヒストンが存在し、それらが二つずつ集まってヒストン8量体を形成する。ヒストン8量体の周りにDNAが巻き付いた構造をヌクレオソームと呼び、真核生物においてヌクレオソームを基本単位とするゲノムDNAとタンパク質の高次複合体をクロマチンと呼ぶ。 - 4.クライオ電子顕微鏡
タンパク質などの生体試料を観察するために開発された電子顕微鏡。タンパク質などの試料を含んだ溶液を薄く展開し、液体エタン(-183~-160℃)中で急速凍結して試料をごく薄い氷の層に閉じ込めた上、液体窒素温度(-196℃)で電子顕微鏡により観察する。タンパク質試料を生理的な(細胞の状態に近い)条件で観察できる、低温のため電子線による試料の損傷が軽減される、といった利点がある。近年著しい発展を見せている構造解析技術であり、2017年のノーベル化学賞の対象ともなった。本研究では、理化学研究所(横浜地区)と東京大学定量生命科学研究所に設置されているクライオ電子顕微鏡を用いて解析を行った。 - 5.NELF
ショウジョウバエからヒトまで多くの動物に共通した転写伸長因子の一つで、四つのサブユニットから成る大型のタンパク質複合体。NELFはnegative elongation factorの略。 - 6.DSIF
SPT4とSPT5の二つのサブユニットから成るタンパク質複合体。SPT4は真核生物と古細菌に、SPT5は真核生物と古細菌だけでなくバクテリアにも保存されている。NELFをRNAPIIに呼び込む他、一時停止が解除され、NELFが解離した後は正の転写伸長因子として働く。DSIFはDRB-sensitivity inducing factorの略。 - 7.TFIIS
転写伸長因子の一つ。障害物によって後退し停止したRNAPIIの転写を再開させる役割を担う。ヌクレオソームを乗り越えて転写するために重要なことが知られている。TFはtranscription factorの略。
共同研究グループ
理化学研究所 生命機能科学研究センター
転写制御構造生物学研究チーム
チームリーダー 関根 俊一(セキネ・シュンイチ)
研究員 永沼 政広(ナガヌマ・マサヒロ)
上級研究員 江原 晴彦(エハラ・ハルヒコ)
研究員(研究当時)上島 珠美(ウエジマ・タマミ)
テクニカルスタッフⅠ 五島 美絵(ゴトウ・ミエ)
テクニカルスタッフⅠ 青木 真理(アオキ・マリ)
テクニカルスタッフⅠ 邉見 真生(ヘンミ・マサミ)
タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(シロウズ・ミカコ)
創薬タンパク質解析基盤ユニット
テクニカルスタッフⅡ 髙野 清子(コウノ・サヤコ)
東京大学定量生命科学研究所 先端定量生命科学研究部門
クロマチン構造機能研究分野
教授 胡桃坂 仁志(クルミザカ・ヒトシ)
助教 鯨井 智也(クジライ・トモヤ)
学術専門職員 伊藤 友子(イトウ・トモコ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業基盤研究(S)「クロマチンを背景とした転写の構造基盤(研究代表者:関根俊一)」「転写と中核的な生命機能を結びつける高次複合体の構造基盤(研究代表者:関根俊一)」「クロマチンにおけるDNA修復機構の構造基盤の解明(研究代表者:胡桃坂仁志)」、同基盤研究(B)「転写と共役したヌクレオソーム再構築の分子メカニズムの解明(研究代表者:江原晴彦)」、同学術変革領域研究(A)「エピコードを規定するクロマチンの基盤構造とその動作原理の解明(研究代表者:胡桃坂仁志)」、同若手研究「クロマチン構造における自然免疫制御機構の解明(研究代表者:鯨井智也)」、同挑戦的研究(開拓)「細胞内のクロマチンにおける多様な転写機構の構造基盤(研究代表者:鯨井智也)」、科学技術振興機構(JST)戦略的創造研究推進事業(ERATO)「胡桃坂クロマチンアトラスプロジェクト(研究総括:胡桃坂仁志)」、同戦略的創造研究推進事業(CREST)「核内環境による生命力維持機構の解明(研究代表者:胡桃坂仁志)」、日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業「創薬等先端技術支援基盤プラットフォーム(BINDS)」の「エピジェネティクスの基盤原理解明と創薬のためのヒストンおよび再構成クロマチンの生産(代表者:胡桃坂仁志)」、および第一三共生命科学研究振興財団「クライオ電子顕微鏡をもちいたネガティブ転写伸長因子NELFの構造解析(助成対象:関根俊一)」による助成を受けて行われました。
原論文情報
- Masahiro Naganuma, Tomoya Kujirai, Haruhiko Ehara, Tamami Uejima, Tomoko Ito, Mie Goto, Mari Aoki, Masami Henmi, Sayako Miyamoto-Kohno, Mikako Shirouzu, Hitoshi Kurumizaka and Shun-ichi Sekine, "Structural insights into promoter-proximal pausing of RNA polymerase II at +1 nucleosome", Science Advances, 10.1126/sciadv.adu0577
発表者
理化学研究所
生命機能科学研究センター 転写制御構造生物学研究チーム
チームリーダー 関根 俊一(セキネ・シュンイチ)
研究員 永沼 政広(ナガヌマ・マサヒロ)
上級研究員 江原 晴彦(エハラ・ハルヒコ)
東京大学定量生命科学研究所
先端定量生命科学研究部門 クロマチン構造機能研究分野
教授 胡桃坂 仁志(クルミザカ・ヒトシ)
助教 鯨井 智也(クジライ・トモヤ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
東京大学定量生命科学研究所 総務チーム
Tel: 03-5841-7813
Email: soumu [at] iqb.u-tokyo.ac.jp
※[at]は@に置き換えてください。
