理化学研究所(理研)生命機能科学研究センター 染色体分配研究チームの北島 智也 チームディレクター、九州大学 大学院農学研究院の三品 達平 助教(理研生命機能科学研究センター 染色体分配研究チーム 客員研究員)らの共同研究グループは、卵母細胞[1]の減数分裂[2]において、染色体の適切な分配に重要な役割を果たすモータータンパク質KIF11[3]の必要量が、紡錘体[4]内の位置によって異なることを発見しました。
本研究成果は、卵子[1]の染色体数異常の原因解明や、不妊症の診断・治療法の開発に向けた新たな知見を提供するものとして期待されます。
細胞分裂の際に染色体を均等に分配するために重要なのが、「紡錘体の二極化」と両極から伸びた微小管[5]が染色体に両方向から接続する「両方向性の確立」です。今回、共同研究グループは、紡錘体の二極化を駆動するKIF11の発現量を段階的に制御できるマウスモデルを用いて、卵母細胞における紡錘体形成と染色体の両方向性の確立過程を詳細に解析しました。その結果、KIF11の発現量が半分以下になると紡錘体の伸長が妨げられ、特に紡錘体内の外側に位置する染色体が両方向性を確立できなくなることが明らかになりました。また、紡錘体内の外側では染色体の動原体[6]と微小管との誤った接続が起こりやすく、KIF11がそれを補う役割を果たしていることも示されました。これらの結果から、染色体の両方向性の確立におけるKIF11の空間的な必要量の違いが初めて明らかになりました。
本研究は、科学雑誌『EMBO Reports』オンライン版(8月20日付:日本時間8月20日)に掲載されました。

マウス卵母細胞における染色体の両方向性の確立におけるKIF11の空間的な必要量の違い
背景
卵子が正しく形成されるためには、その前駆細胞である卵母細胞において、減数分裂を通じて染色体が正確に分配されることが不可欠です。この分配に失敗すると、卵子の染色体数に異常が生じ、不妊や流産、さらにはダウン症[7]などの先天性疾患の原因となります。
染色体の分配において重要なのが、微小管から成る「紡錘体」が二つの極を持ち、染色体の移動方向が決まる「紡錘体の二極化」です。多くの動物の体細胞分裂では、中心体[8]という構造が紡錘体の形成と二極化を助けますが、哺乳類などの卵母細胞にはこの中心体が存在しません。そのため、卵母細胞の減数分裂ではまず、極性を持たない球状の紡錘体が形成されます。
この後、紡錘体が楕円形に変形して二極化する過程で中心的な役割を果たすのが、KIF11というモータータンパク質です。KIF11は微小管を架橋して滑らせる働きを持ち、これにより微小管が二つの極に並び、紡錘体が引き伸ばされていきます。こうして形成された二極性の紡錘体の赤道面に、染色体が整列します。そして、両極から伸びた微小管が染色体に両方向から接続し、KIF11が微小管を滑らせる力により両極へと均等に引っ張られることで染色体が伸長するとともに「両方向性」が確立して、正しく分配される準備が整います(図1)。
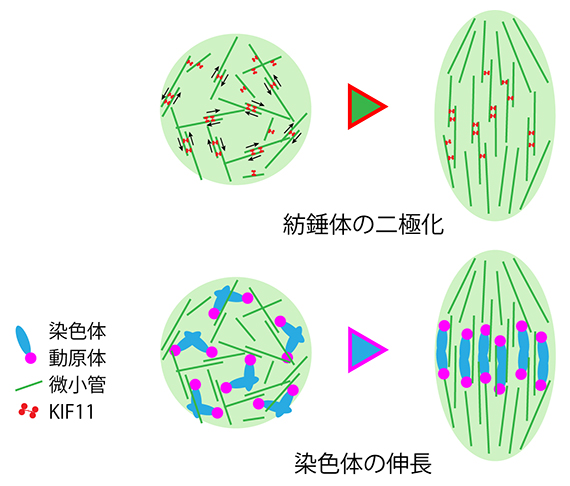
図1 紡錘体の二極化と染色体の両方向性
中心体を持たない卵母細胞減数第一分裂の模式図。上図は、微小管同士を架橋して滑らせるモータータンパク質KIF11による紡錘体の二極化を示す(染色体・動原体は省略)。下図は、染色体が二つの極から伸びる微小管に引っ張られて伸長し両方向性が確立する過程を示す(KIF11は省略)。
染色体分配研究チームは先行研究で、染色体を両極に引っ張る力は紡錘体内の外側よりも内側の方が強く、このため紡錘体の内側に位置する染色体は分配異常の頻度がより高いことを明らかにしました注1)。しかし、染色体の適切な分配にとってKIF11がどの程度必要なのか、また紡錘体のどの領域で特に重要なのかといった「量的・空間的な要件」については、これまで明らかになっていませんでした。
- 注1)2024年7月19日プレスリリース「卵子の老化で小さな染色体が正しく分配されない原因」
研究手法と成果
共同研究グループは、KIF11が卵母細胞における紡錘体の形成にどの程度必要かを調べるため、卵母細胞でKIF11の発現を段階的に欠失させたコンディショナルノックアウトマウス[9]を作製し、高解像度のライブイメージング[10]で紡錘体の形成過程を観察しました。
その結果、KIF11の発現量が半分以下になると紡錘体が正常に引き伸ばされず、染色体の分配へと進まないことが明らかになりました(図2)。
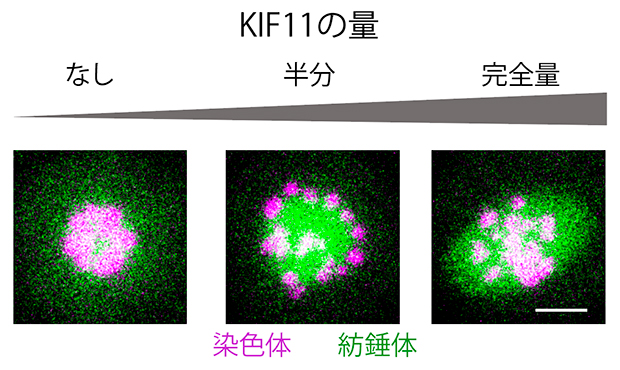
図2 マウス卵母細胞の減数第一分裂中期のライブイメージング
紡錘体は微小管結合タンパク質と緑色蛍光タンパク質の融合により、染色体はヒストンと赤色蛍光タンパク質の融合により、それぞれ可視化し、蛍光顕微鏡で観察した。KIF11の発現量を減らした卵母細胞では、減数第一分裂時に紡錘体が正常に二極に伸長せず、染色体分配へ進まなかった。スケールバーは10マイクロメートル(μm、1μmは1,000分の1ミリメートル)。
さらに、紡錘体の極に集まる微小管重合中心(MTOC)[8]の動きを可視化したところ、KIF11が半分量しか発現しない卵母細胞では、紡錘体が完全には伸長しないものの、両極にMTOCの集まる様子が見られ、二極性は形成されることが分かりました。またKIF11の発現量がさらに減ると、二極性そのものが失われることも判明しました(図3)。
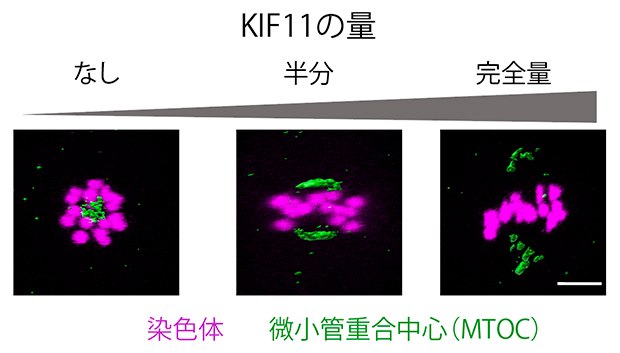
図3 マウス卵母細胞の減数第一分裂中期の紡錘体極のライブイメージング
紡錘体極は微小管重合中心タンパク質と緑色蛍光タンパク質の融合により、染色体はヒストンと赤色蛍光タンパク質の融合により、それぞれ可視化し、蛍光顕微鏡で観察した。KIF11の発現量を半分に減らした卵母細胞では、紡錘体が完全に伸長しないものの二極性は確立していた。KIF11がないと、二極性が失われた。スケールバーは10μm。
次に、KIF11の不足が、染色体の両方向性の確立に与える影響を調べたところ、KIF11の発現が半分量となった紡錘体内では、内側に位置する染色体は引き伸ばされて両方向性を確立できる一方で、外側の染色体は両方向性を確立できないことが明らかになりました(図4)。
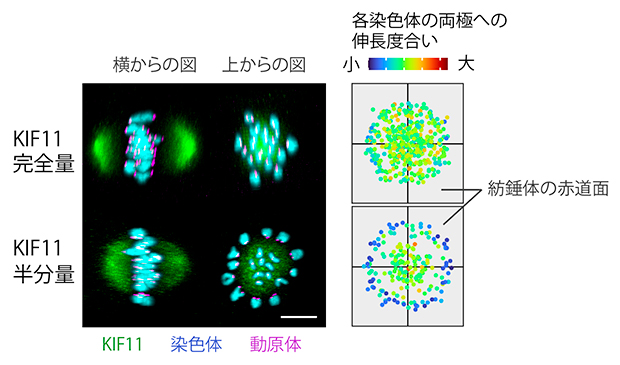
図4 紡錘体内の空間分布で異なるKIF11に依存した染色体の伸長度
KIF11が完全量の卵母細胞では、染色体が紡錘体空間で一様にそれぞれの紡錘体極へ引っ張られて伸長し、両方向性を確立する。一方、KIF11の発現量を半分に減らした卵母細胞では、紡錘体内の内側に分布する染色体のみが両方向性を確立した。右側の図の点一つが紡錘体の赤道面における染色体の位置を表し、その色が両極への伸長度合いを表す。この図では、複数の卵母細胞のデータをまとめて示している。スケールバーは10μm。
マウスの卵母細胞では、紡錘体が二極化しないうちに、さまざまな方向から伸びてきた微小管が染色体上の動原体と接続することがあります。その結果、正常な卵母細胞でも、一つの動原体に微小管が両側から捕捉するという誤った接続(メロテリック接続)が観察されます。卵母細胞にはメロテリック接続を修正する仕組みが備わっていますが、メロテリック接続が過剰になると染色体の分配異常のリスクは高まると考えられます。そこで、染色体の位置とメロテリック接続の頻度を調べたところ、KIF11が正常な卵母細胞でもKIF11が不足している卵母細胞でも、紡錘体内の外側に位置する染色体で誤った接続が多く発生していることが分かりました(図5)。
以上の結果から、染色体の正常な分配に対するKIF11の必要量は紡錘体内の外側と内側で異なり、KIF11減少の影響は外側に強く現れることが分かりました。メロテリック接続は紡錘体内の外側で高頻度に生じますが、正常な卵母細胞ではKIF11が外側にも十分に存在することで、こうした誤った接続を乗り越えて染色体の両方向性が確立されると推察されます。
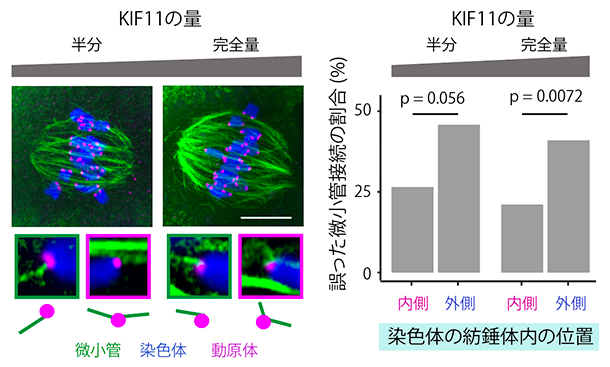
図5 マウス卵母細胞の減数第一分裂中期における動原体と微小管の接続状態
- (左)超高解像度の蛍光染色像。下の画像は動原体と微小管の接続を拡大したもの。緑の枠の画像は正しい接続、マゼンタの枠の画像は、一つの動原体に微小管が両側から捕捉する誤った接続(メロテリック接続)を示す。メロテリック接続は、KF11の発現量にかかわらず正常な卵母細胞でも観察される。スケールバーは10μm。
- (右)紡錘体内の染色体の分布とメロテリック接続の割合。染色体の紡錘体内赤道面上での位置ごとにメロテリック接続の割合を集計した結果。KIF11の発現量の違いによらず、誤った微小管接続の割合は紡錘体の外側で多かった。pは偶然にそのようなことが起こる確率のことで統計学的有意差を示す指標。数値が低いほど有意水準が高いことを表す。p=0.056、p=0.0072は十分な有意差があることを示している。
今後の期待
本研究により、モータータンパク質KIF11が卵母細胞における染色体分配に不可欠であり、特に紡錘体内の外側でその必要量が高いことが明らかになりました。これは、染色体の両方向性の確立に必要なKIF11の量に「空間的な違い」が存在することを初めて示した重要な発見です。ヒトでは、KIF11の機能低下が不妊の原因となる可能性が示されており注2)、KIF11の量や、変異による機能変化を調べることが、将来的に不妊診断や生殖補助医療の改善に役立つ可能性があります。
共同研究グループは最近、紡錘体内の内側と外側で、微小管が染色体を紡錘体の両極に引っ張る力に違いがあり、これが老化したマウス卵母細胞における染色体の分配異常のリスクとなることを報告しました注1)。今後は、こうした「空間的な張力の違い」がどのように生じるのか、またそれが加齢や不妊とどう関係しているのかを明らかにすることで、卵子の染色体異常や不妊症の新たな理解と治療法の開発につながることが期待されます。
- 注2)Wu T, Luo Y, Zhang M, Chen B, Du X, Gu H, Xie S, Pan Z, Yu R, Hai R, et al. Mechanisms of minor pole-mediated spindle bipolarization in human oocytes. Science. 2024 Aug 23;385(6711)
補足説明
- 1.卵母細胞、卵子
雌由来の受精可能な生殖細胞である卵子の前駆細胞を卵母細胞と呼ぶ。卵母細胞は胎児期に形成され、長期の休眠期を経て排卵直前に卵子になる。 - 2.減数分裂
真核生物において配偶子を形成するために2回の分裂が連続して起こる、配偶子形成特異的な細胞分裂。本研究では、減数第一分裂を対象としている。 - 3.モータータンパク質KIF11
細胞内でアデノシン三リン酸(ATP)の分解で生じる化学エネルギーなどを用いて、力学的な仕事をするタンパク質をモータータンパク質と総称する。KIF11は、キネシンスーパーファミリータンパク質(kinesin superfamily proteins、KIF)に属するモータータンパク質であり、細胞骨格である微小管の上を移動し細胞分裂に重要な働きをしている。 - 4.紡錘体
分裂期に形成される染色体を分配するための細胞内構造体。主に微小管([5]参照)によって構成される。 - 5.微小管
微小管は、チューブリンと呼ばれるタンパク質が重合して環状構造の長い円筒を形成したもの。 - 6.動原体
染色体上に形成されるタンパク質複合体。染色体分配の際に、微小管が染色体を動かすための牽引(けんいん)部位となる。体細胞分裂では姉妹染色分体のそれぞれに動原体が一つずつ形成され、これらを姉妹動原体と呼ぶ。減数第一分裂では相同染色体のそれぞれに動原体が一つずつ形成され、これらを相同動原体と呼ぶ。 - 7.ダウン症
21番染色体が1本余分に存在し3本となる(トリソミー)ために引き起こされる先天性疾患。約9割が卵母細胞の減数分裂における染色体分配の誤りに起因している。 - 8.中心体、微小管重合中心(MTOC)
チューブリンが重合する際に核となる構造を「微小管重合中心」と呼び、多くの動物の体細胞分裂では、細胞小器官である「中心体」が主にその役割を果たす。MTOCはmicrotubule organizing centerの略。 - 9.コンディショナルノックアウトマウス
特定の遺伝子の機能を、特定の時期と特定の細胞種で、あるいはそのどちらかのみで喪失させた遺伝子改変マウス。本研究では、減数分裂特異的にKif11遺伝子を破壊できる組換え遺伝子を用いて、卵母細胞でのKIF11タンパク質の発現量を段階的に操作できるコンディショナルノックアウトマウスを作製した。 - 10.ライブイメージング
生きた細胞や組織、個体の生命活動を経時観察すること。特に、緑色蛍光タンパク質(GFP)などの蛍光タンパク質を用いて特定のタンパク質や細胞を標識し、蛍光顕微鏡でその動きや変化を詳細に観察する手法は、生命科学に欠かせない手法となっている。
共同研究グループ
理化学研究所 生命機能科学研究センター
染色体分配研究チーム
研究員(研究当時)オレリアン・クートワ(Aurélien Courtois)
技師 吉田 周平(ヨシダ・シュウヘイ)
研究パートタイマーⅠ 浅井 皓平(アサイ・コウヘイ)
チームディレクター 北島 智也(キタジマ・トモヤ)
(生命機能科学研究センター 副センター長)
生体モデル開発チーム
チームディレクター 清成 寛(キヨナリ・ヒロシ)
九州大学 大学院農学研究院
助教 三品 達平(ミシナ・タッペイ)
(理研 生命機能科学研究センター 染色体分配研究チーム 客員研究員)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(A)「動的な生殖ライフスパン:変動する生殖細胞の機能と次世代へのリスク(領域代表者:北島智也)」、同基盤研究(B)「哺乳類卵母細胞における紡錘体二極化の機構の解明(領域代表者:北島智也)」、同基盤研究(A)「人工動原体の構築による染色体分配の機構の解明(研究代表者:北島智也)」、および理研新領域開拓課題「長時間分子生物学(領域代表者:北島智也)」による助成を受けて行われました。また、三品達平は、理化学研究所の基礎科学特別研究員制度の支援を受け、研究を遂行しました。
原論文情報
- Tappei Mishina, Aurélien Courtois, Shuhei Yoshida, Kohei Asai, Hiroshi Kiyonari, Tomoya S. Kitajima, "Kif11-haploinsufficient oocytes reveal spatially differential requirements for chromosome biorientation in the spindle", EMBO Reports, 10.1038/s44319-025-00539-w
発表者
理化学研究所
生命機能科学研究センター 染色体分配研究チーム
チームディレクター 北島 智也(キタジマ・トモヤ)
九州大学 大学院農学研究院
助教 三品 達平(ミシナ・タッペイ)
(理研 生命機能科学研究センター 染色体分配研究チーム 客員研究員)
 北島 智也
北島 智也
 三品 達平
三品 達平
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
九州大学 広報課
Tel: 092-802-2130、Email: koho@jimu.kyushu-u.ac.jp
