ポイント
- 遺伝型ALSの新しいモデルマウスを用いてALS病態の進行メカニズムを解明
- シュワン細胞での活性酸素除去が、ALSの進行を遅らせる
- シュワン細胞が神経栄養因子IGF-1の産生で運動神経を保護
要旨
独立行政法人理化学研究所(野依良治理事長)と独立行政法人科学技術振興機構(JST:北澤宏一理事長)は、神経変性疾患の一つで、全身の運動麻痺を起こす神経難病である筋萎縮性側索硬化症(ALS)のモデルマウスを用い、運動神経の軸索※1を取り囲むグリア細胞のシュワン細胞※1が病気進行に関与することを発見しました。理研脳科学総合研究センター(田中啓治センター長代行)山中研究ユニットの山中宏二ユニットリーダーらと、米国・カリフォルニア大学サンディエゴ校、仏・国立保健医学研究所(INSERM)などの国際共同研究による成果です。
筋萎縮性側索硬化症(ALS)は、全身の筋肉を支配する大脳と脊髄にある運動神経細胞が徐々に死んでいく原因不明の神経難病です。発症すると、認知や思考の能力が保たれたまま、全身の筋肉の麻痺が進行し、寝たきりとなります。通常は、発症から2年ないし5年で、呼吸をつかさどる筋肉が麻痺し、人工呼吸器なしでは生存できなくなる重篤な疾患です。
研究グループはこれまでに、ヒトの遺伝型ALSで発見されたSOD1遺伝子※2の変異を、特定の細胞群から除去できるモデルマウスを開発し、ALSに関与する細胞群の働きを検討してきました。今回、このモデルマウスを用い、シュワン細胞から酵素SOD1の活性酸素を除去する活性が保たれた活性型変異SOD1を取り除くと、ALSの進行が顕著に加速することを発見しました。また、シュワン細胞は、神経栄養因子であるIGF-1(Insulin-like Growth Factor 1:インスリン様成長因子)※3を産生しており、この産生が活性型変異SOD1の発現に依存していることを突き止めました。つまり、シュワン細胞では、SOD1の酵素活性が保たれていることが運動神経の保護に重要で、神経栄養因子IGF-1の産生とともに、シュワン細胞での活性酸素の除去が、ALSの進行を遅延させる治療の可能性として期待されます。運動神経の軸索の維持や再生に重要な役割を果たすことが知られているシュワン細胞が、ALSの病態に積極的に関与することを世界で初めて発見したことになりました。
さらに、この成果は、シュワン細胞を正常化するなどの方法で、ALSの治療法の開発に大きく寄与することが期待されます。この研究成果は、JST戦略的創造研究推進事業チーム型研究(CREST)の研究領域「精神・神経疾患の分子病態理解に基づく診断・治療に向けた新技術の創出」における研究課題「孤発性ALSのモデル動物作成を通じた分子標的治療開発」(研究代表者:祖父江元、名古屋大学教授)によって得られ、米国科学アカデミー紀要『Proceedings of the National Academy of Sciences』(3月17日号)の掲載に先立ち、2月27日にオンライン掲載されました。
背景
ALSは、全身の筋肉を支配する運動神経細胞を選択的、かつ進行的に障害し、呼吸筋を含む全身の筋肉麻痺を引き起こす原因不明の神経変性疾患です。現在のところ、有効な治療法は見つかっておらず、日本では約6,000人がALS患者と推定されています。患者の苦痛に加え、介護者も長期にわたる重度の介護が強いられるため、その原因の解明と治療法の開発が強く求められている疾患です。ALSの最も特徴的な病変は、運動神経に起こる細胞死ですが、その周囲に存在するグリア細胞でも病的変化が見られます。
ALSの約1割は遺伝性です。遺伝性ALSでは、原因遺伝子を手がかりとしてモデル動物を作製するなど、遺伝子工学的手法を用いて研究を行うことが可能なため、遺伝性ALSをターゲットとして病態解明に向けた研究が進んでいます。これまでの研究から、ヒトの遺伝性ALSでは、SOD1遺伝子の優性変異が最も多く、遺伝性のうち約2割の患者で見られることが分かっています。SOD1は、活性酸素を除去する働き(酵素活性)を持ちますが、ALS患者由来の変異型SOD1には、その活性が保持されているもの(活性型)となくしたもの(不活性型)があります。
変異型ヒトSOD1遺伝子を導入したマウスは、ヒトALSの病態をよく再現していることから、モデル動物として広く研究に利用されています。この変異型SOD1は、活性型、不活性型ともに、神経細胞やグリア細胞をはじめとした全身のいたるところの細胞に発現しているにもかかわらず、運動神経に選択的に細胞死を引き起こすことが知られています。
研究グループはこれまでに、特定の細胞群から選択的に変異型SOD1を除去することができる新たなモデルマウス「LoxSOD1G37R」を作製し、ALSに関与するすべての細胞群の関与を明らかにする研究を進めてきました。その結果、アストロサイト※4とミクログリア※5の2種類のグリア細胞が、ALS進行に関与する細胞群であることを明らかにしました(2008年2月4日プレス発表)。しかし、運動神経にとってもう一種類の重要なグリア細胞であるシュワン細胞に関しては検討がされていませんでした。運動神経の細胞体から骨格筋に情報を伝える神経繊維からなる軸索は、運動神経の体積の約99%を占めており、その周りを取り囲むシュワン細胞が、軸索の維持や再生に重要な役割を果たします。しかし、このシュワン細胞が、ALSの病態に関与しているかどうかは不明なままでした。
研究手法と成果
モデルマウスLoxSOD1G37Rは、SOD1遺伝子に活性型の遺伝子変異(SOD1G37R)を持ち、SOD1酵素活性が保たれています。研究グループは、このLoxSOD1G37Rと、シュワン細胞だけに選択的にCreタンパク質※6を発現するマウス(P0-Cre)を交配し、活性型変異SOD1(SOD1G37R)をシュワン細胞だけから除去したモデルマウスを作製しました。このマウス(LoxSOD1G37R / P0-Cre+)を使って、疾患の発症時期、生存期間、罹病期間(疾患の進行)※7を調べました。罹病期間については、活性型変異SOD1(SOD1G37R)をシュワン細胞から除去したマウスと、LoxSOD1G37Rマウス、SOD1酵素活性を持たない(不活性型)遺伝子変異のSOD1G85Rマウスとを比較検討しました。さらに、シュワン細胞から活性型変異SOD1(SOD1G37R)を除去したマウスを用いて、さまざまな神経栄養因子の遺伝子発現の増減を調べました。
- 1.シュワン細胞から活性型変異SOD1(活性型SOD1G37R)を除去したマウスの生存期間
シュワン細胞から活性型変異SOD1(SOD1G37R)を除去したマウスは、SOD1酵素活性を持つLoxSOD1G37Rと比べ、ALSの発症時期にほとんど違いがみられませんでしたが、生存期間が約42日短縮しました。その結果、罹病期間は活性型変異SOD1未除去群(LoxSOD1G37R)が約61日に対し、除去群では約21日と、約3分の1になりました。これは病気の進行が著しく加速したことを意味しています(図1)。 - 2.シュワン細胞から活性型変異SOD1(SOD1G37R)を除去したマウスの罹病期間
シュワン細胞から活性型変異SOD1(SOD1G37R)を除去すると、ALSモデルマウスLoxSOD1G37Rに比べて罹病期間が著しく短縮し、不活性型の変異を持つSOD1G85Rマウスとほぼ同程度となりました(図2)。シュワン細胞から変異型SOD1(活性型SOD1G37R)を除去したマウスとSOD1G85Rマウスの平均生存期間はほぼ等しく約13カ月でした。 - 3.シュワン細胞から活性型変異SOD1(SOD1G37R)を除去したマウスでの神経栄養因子の発現
シュワン細胞から活性型変異SOD1(SOD1G37R)を除去すると、神経栄養因子であるIGF-1の産生が50%程度低下し、ALSの進行は加速することが示されました(図3)。
以上の結果から、シュワン細胞におけるSOD1活性は、ALSの進行に強く関与していることが分かりました。アストロサイトやミクログリアでは、活性型変異SOD1(SOD1G37R)を除去するとALSの進行が遅くなったのに対し、シュワン細胞では逆に、活性型変異SOD1(SOD1G37R)を除去するとALSの進行は速くなりました。これはまったく予想外の結果でしたが、シュワン細胞は変異型SOD1の毒性※8にはさほど影響をうけず、むしろシュワン細胞において活性酸素を除去するSOD1の酵素活性が失われることで、ALSの疾患進行が加速すると考えられました。これまで治療の標的としてあまり注目されてこなかったシュワン細胞を正常化することで、ALSを治療できる可能性が実験的に明らかになりました。
今後の期待
本研究で得た知見は、ALSの進行を遅らせる標的として、アストロサイトやミクログリアに加えて、末梢のグリア細胞であるシュワン細胞も有望であることを示す画期的なものです。運動神経の細胞体から骨格筋に情報を伝える神経繊維からなる軸索は、運動神経の体積の約99%を占めており、その周りを取り囲むシュワン細胞は、軸索の維持や再生に重要な役割を果たすことが知られていましたが、本研究成果によりシュワン細胞のALSの病態への関与を、モデル動物を用いて証明できたことになります。
今後の研究の方向性としては、シュワン細胞における活性酸素の除去や神経栄養因子の産生を増加させることで、運動神経を保護する治療法開発の可能性が考えられます。ALSでは、運動神経の軸索から骨格筋へのシグナル伝達や軸索の機能は早期に障害されることが知られています。シュワン細胞はその軸索に最も近接し、軸索の維持や再生に寄与する細胞として非常に有望であり、シュワン細胞を正常化する方法の研究を通じて、ALSの進行を遅らせる有効な治療法の開発につながると期待されます。
発表者
理化学研究所
脳科学総合研究センター 山中研究ユニット
ユニットリーダー 山中 宏二(やまなか こうじ)
Tel : 048-467-9677 / Fax : 048-462-4796
お問い合わせ先
脳科学研究推進部 鈴木 一郎(すずき いちろう)Tel : 048-467-9654 / Fax : 048-462-4914
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.シュワン細胞、軸索
シュワン細胞は末梢神経系に特異的に存在するグリア細胞。神経細胞の細胞体からは、神経情報を出力するための神経繊維からなる軸索(Axon)が伸びており、ヒトの運動神経の軸索は最長で1mに及ぶものがある。軸索の周囲には髄鞘(ミエリン)という絶縁体が何重にも巻きついており、神経伝達の効率を高めているが、このミエリンは末梢神経ではシュワン細胞、中枢神経ではオリゴデンドロサイトによって作られている。一本の軸索につき、約1,000個のシュワン細胞がその周囲を取り巻いている。また、シュワン細胞は神経栄養因子を産生したり、神経損傷時に軸索再生を促進したりする働きがある。 - 2.SOD1遺伝子
生物の細胞内で発生する、有害な活性酸素であるスーパーオキシドを解毒する反応系を触媒する酵素「スーパーオキシドジスムターゼ」をコードする遺伝子。遺伝型のALSでは、この遺伝子に変異が見られる。 - 3.IGF-1(Insulin-like Growth Factor 1:インスリン様成長因子)
成長ホルモンの刺激により分泌されるペプチドで、全身のほとんどの細胞がその影響を受ける。神経細胞では、その生存や機能維持への効果が知られ、ALSモデルマウスにおける運動神経保護効果も示されている。ALS患者を対象とした臨床治験が長年行われてきたが、最近の研究結果ではその有効性に関して否定的である。 - 4.アストロサイト
神経細胞の数の10倍存在するといわれ、中枢神経系において最も主要なグリア細胞。神経細胞への神経栄養因子の供給や、神経損傷の修復、シナプス活動の調節など多岐にわたる機能を持つことが知られている。 - 5.ミクログリア
中枢神経系に存在するグリア細胞。病原体による感染や、神経損傷の際に生じる死細胞や病原体を除去する働きを持つ。 - 6.Creタンパク質
大腸菌に由来する酵素。特定のDNA配列(Lox配列と呼ばれる)を認識し、その間にあるDNAを除去する。特定の細胞群における遺伝子の働きを調べる目的で、Creタンパク質を細胞群選択的に発現するマウスが研究によく使われている。 - 7.発症時期、生存期間、罹病期間(疾患の進行)
発症時期は、ALSの症状を示し始めた時期(本研究では体重減少の開始点)を指し、生存期間は、モデルマウスの誕生から死亡までの期間をいう。罹病期間は、発症時期から死亡までの期間(=生存期間―発症時期)にあたる。罹病期間が延長すると、病気の進行が遅延したと考えられる。 - 8.変異型SOD1による毒性
遺伝型のALSではSOD1遺伝子に変異が見られるが、この酵素の活性が失われるために運動神経の細胞死が起こるのではなく、変異型SOD1が酵素活性とは無関係の毒性を発揮することが神経細胞死の原因と考えられている。毒性に関しては多くの学説があるが、現時点でその詳細は不明である。
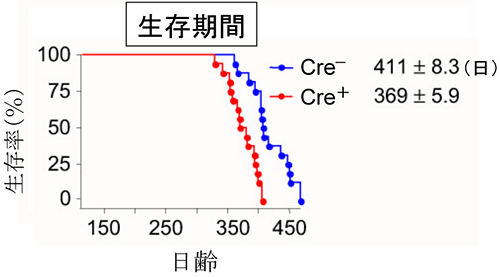
図1 シュワン細胞から活性型変異SOD1(SOD1G37R)を除去したマウスの生存期間
シュワン細胞から活性型変異SOD1(SOD1G37R)を除去したマウス(Cre+R:赤)では、除去しないマウス(Cre-:青)と比較して、発症時期にほとんど変化は見られないが、進行を著明に加速させることでその生存期間を約42日短縮した。

図2 シュワン細胞から活性型変異SOD1(SOD1G37R)を除去したマウスの罹病期間
ALSモデルマウスLoxSOD1G37Rのシュワン細胞から活性型変異SOD1(SOD1G37R)を除去した場合の罹病期間(LoxSOD1G37R/ Cre+: 赤、平均20.9日)は、除去しないマウス(LoxSOD1G37R:青、平均61.7日)に比べて著しく短縮し、不活性型の変異を持つSOD1G85Rマウス(灰色、平均23.8日)とほぼ同程度となった。
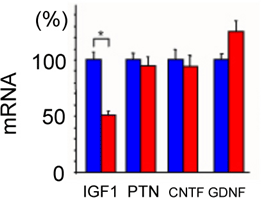
図3 シュワン細胞における神経栄養因子の遺伝子発現(mRNA)の比較
IGF1:インスリン様成長因子、PTN:プレイオトロフィン
CNTF:毛様体筋神経栄養因子、GDNF:グリア細胞由来神経栄養因子
疾患進行期のALSモデルマウスのシュワン細胞から活性型変異SOD1(SOD1G37R)を除去したマウス(赤)と除去しないマウス(青)の、シュワン細胞における神経栄養因子の遺伝子発現(mRNA)を比較した。シュワン細胞における活性型変異SOD1(SOD1G37R)の除去により、IGF-1の遺伝子発現が、選択的に低下している。
