2009年4月22日
独立行政法人 理化学研究所
ポリグルタミン病の発症は、タンパク質の線維化加速で進行
-線維構造がさまざまなタンパク質でドミノ倒しのように伝播する新メカニズムを提唱-
ポイント
- 異常に伸びたグルタミン鎖を含むタンパク質が、不溶性の線維を構成
- 不溶性線維が神経細胞に蓄積し、細胞が障害を受ける
- 細胞の機能をつかさどるさまざまなタンパク質を巻き込み、線維化を促進
要旨
独立行政法人理化学研究所(野依良治理事長)は、不随意運動などを引き起こす神経変性疾患の一種「ポリグルタミン病※1」の発症は、グルタミン鎖の異常伸長で生じる線維構造がさまざまなタンパク質へと伝播し、あたかもドミノ倒しのようにタンパク質の生理機能が喪失するという、新たな分子メカニズムによる病状の進行を提唱しました。これは、理研脳科学総合研究センター(利根川進センター長)構造神経病理研究チームの貫名信行チームリーダー、古川良明基礎科学特別研究員らによる成果です。
ハンチントン病※2を代表とするポリグルタミン病は、遺伝性の病気として知られ、不随意運動や認知症(ハンチントン病)、歩行障害(遺伝性脊髄小脳変性症)などの症状を生じます。ポリグルタミン病は、グルタミンをコードするCAG塩基配列の繰り返しが、原因遺伝子で異常に伸長することで引き起こされます。このため、異常に伸びたグルタミン鎖(ポリグルタミン)を含む原因遺伝子産物が不溶性の線維構造を形成し、これらが神経細胞に蓄積することで細胞が傷害を受けます。この際、原因遺伝子産物以外にも、細胞の機能をつかさどるさまざまなタンパク質が線維に巻き込まれ、それらの生理機能の低下が病気進行に強く関連していると考えられています。
研究グループは、異常伸長したグルタミン鎖を持つハンチンチン(ハンチントン病の原因遺伝子産物)を用いて、その線維化機構を研究してきました。その結果、翻訳を制御するタンパク質「TIA-1」が、ハンチンチン線維と強く結合していることを発見しました。また、ハンチンチン線維が鋳型として働くことで、通常では見られないTIA-1の線維化が加速度的に進行し、それに伴って翻訳制御の機能を低下させることも明らかにしました。つまり、グルタミン鎖の異常伸長(ポリグルタミン)によって生じる線維構造は、異種タンパク質へと伝播することがあり、あたかもドミノ倒しのようにさまざまなタンパク質の生理機能が喪失していくことで、ポリグルタミン病が進行するものと考えられます。
本研究成果は、タンパク質間での線維構造の伝播を制御できると、ポリグルタミン病の症状を遅らせうることを示唆するもので、神経変性疾患の治療法開発のための新たな手法を提供するものと期待できます。
本研究の成果は、米国の神経科学会誌『The Journal of Neuroscience』オンライン版(4月22日号)に掲載されます。
背景
ハンチントン病や遺伝性の脊髄小脳変性症※3の多くは、その病気の原因遺伝子に、正常では見られない変化を生じています。具体的には、原因遺伝子を構成するDNA配列の一部で、C(シトシン)・A(アデニン)・G(グアニン)と並ぶ塩基配列の繰り返しが、通常では20回程度であるのに対し、40回以上にも増加しています。その結果、異常伸長したグルタミン鎖を含む原因遺伝子産物が神経細胞に大量に蓄積し、神経細胞死や機能異常を引き起こしています。これらの疾患は、異常伸長したグルタミン鎖が病気の発症に強くかかわっていることから、まとめて「ポリグルタミン病」と呼ばれています。
ハンチントン病は、日本国内では100万人に5人が罹患しており(出典:難病情報センター)、一般に中高年で発症します。しかし、ポリグルタミン鎖が長くなるほど若年で発症することから、伸長したポリグルタミン鎖の細胞毒性がどのように発揮されるのかが、病態を考える上で重要となります。これまでさまざまなモデルマウスの解析から、ポリグルタミン鎖を含むタンパク質凝集体が、神経細胞にできることが明らかとなり、病気を引き起こす大きな要因であると示唆されています。また、ポリグルタミン病におけるもう一つの特徴は、遺伝子発現の異常です。この遺伝子発現の異常は、転写や翻訳を制御するタンパク質が凝集体に結合し、その機能を失うために引き起こされるという説が一般的です。しかし、転写や翻訳を制御するタンパク質がポリグルタミン鎖を含む凝集体になぜ、どのように結合するのかは明らかとなっていませんでした。
研究手法と成果
研究チームは、異常伸長したポリグルタミン鎖を発現する細胞モデルを作製し、そこからポリグルタミン鎖の凝集体と結合するタンパク質の同定を進めてきました。その過程で、RNAと結合し、その翻訳を調節するタンパク質のTIA-1が、凝集体に取り込まれていることを発見しました。そこで、ハンチントン病モデルマウスの海馬をTIA-1に対する抗体で染色すると、TIA-1がハンチントン病に特異的に観察される凝集体と同じ場所に存在することが分かりました(図1)。
ハンチントン病の原因遺伝子産物は、ハンチンチンと呼ばれるタンパク質です。研究チームは、異常伸長したポリグルタミン鎖を持つハンチンチンを精製し、試験管内でその線維化過程を再現することに成功しました。一般にタンパク質の線維は、同じ種類のタンパク質が、線維化する際に鋳型として働き、その反応を促進すること(シーディング反応)が知られています。
このシーディング反応が、異なる種類のタンパク質間でも起こりうるのではないかと考え、ハンチンチン線維をTIA-1に加え、その線維化の過程を再現してみました。するとTIA-1だけの時よりも、ハンチンチン線維を加えたときの方が、線維化が促進されることが分かりました(図2)。このシーディング反応によって得た線維を蛍光顕微鏡で観察すると、ハンチンチン線維の種が鋳型となって、そこからTIA-1の線維が成長していることが分かりました(図2)。さらに、異常伸長したポリグルタミン鎖を発現する細胞モデルを用いて、生きたままの細胞を連続して観察すると、ポリグルタミン鎖が凝集体を形成し、そこを起点としてTIA-1が巻き込まれていく様子もとらえることができました(図3)。
TIA-1がハンチンチン線維の作用によって線維化すると、その生理機能が失われることも確認しました(図4)。TIA-1は、シトクロムcと呼ばれる呼吸などに関与するタンパク質をコードするRNAに結合し、そのタンパク質への翻訳を抑制します。しかし、TIA-1がハンチンチン線維の形成に伴って線維化すると、正常に機能するTIA-1の量が減少するため、シトクロムcの翻訳抑制がはずれ、そのタンパク質量が増加していることが分かります。
これらの結果から、ポリグルタミン鎖の異常伸長によって生じる線維構造は、異種タンパク質を線維化させる能力を有していることが明らかとなりました。ポリグルタミン線維は、ほかのさまざまなタンパク質を線維化し、それらの生理機能を喪失させる「ハブ」として働いている可能性があり(図5)、ポリグルタミン病を考える上で新たな病理メカニズムとなります。
今後の期待
本研究は、タンパク質間での線維構造の伝播を制御できると、ポリグルタミン病の症状を遅らせる可能性を示唆しました。従って、ポリグルタミン鎖から線維構造が伝播し、機能が喪失するタンパク質の同定や、それを抑制する薬剤などを開発することで、神経変性疾患の治療に新たな手法を提供するものと期待できます。
発表者
理化学研究所
脳科学総合研究センター
構造神経病理研究チーム
チームリーダー 貫名 信行(ぬきな のぶゆき)
基礎科学特別研究員 古川 良明(ふるかわ よしあき)
Tel: 048-467-9702 / Fax: 048-467-4796
お問い合わせ先
脳科学研究推進部 鈴木 一郎(すずき いちろう)Tel: 048-467-9654 / Fax: 048-462-4914
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.ポリグルタミン病
核酸のC(シトシン)・A(アデニン)・G(グアニン)リピートが翻訳領域に存在すると、C・A・Gがグルタミンに翻訳されるため、グルタミン鎖(ポリグルタミン)が遺伝子産物に含まれる。ポリグルタミン病は、この遺伝子産物の伸長したポリグルタミンの毒性によって発症する。ハンチントン病、球脊髄性筋萎縮症、遺伝性の脊髄小脳失調症(SCA1、2、3、6、7、17)、DRPLA(歯状核赤核淡蒼球ルイ体萎縮症)が、現在知られているポリグルタミン病である。 - 2.ハンチントン病
ハンチントン病は、主に中年以降に発症する常染色体優性遺伝の遺伝性慢性進行性の疾患。その臨床症状は、主に不随意運動であり、知能障害、精神症状を伴う。1983年にハンチントン病遺伝子が、第4染色体短腕(4p16.3)に存在することが示され、1993年にその原因遺伝子(ハンチンチン遺伝子)が同定された。この原因遺伝子のエクソン1に存在する塩基のC・A・Gリピートの伸長が、発病の直接の原因とされる。 - 3.脊髄小脳変性症
小脳や脳幹から脊髄にかけての神経細胞に変性が起き、身体の細かな調整ができなくなり、次第に思うように動かせなくなる神経難病。
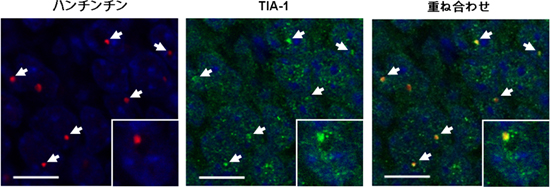
図1 ハンチントン病モデルマウスの海馬におけるTIA-1とハンチンチン凝集体との共局在
(左)ハンチントン病モデルマウスの海馬にある凝集体をハンチンチン抗体で染色(赤)
(中)ハンチントン病モデルマウスの海馬をTIA-1に対する抗体で染色(緑)
(右)左と中の融合画像。
TIA-1は、ハンチンチンから構成される凝集体と同じ場所に存在する。
(青色は核を示す。)
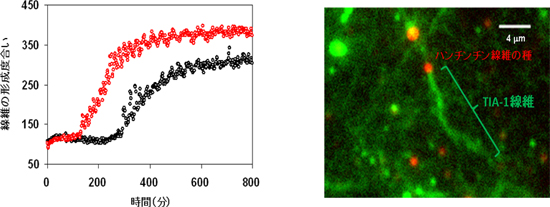
図2 ハンチンチン線維が鋳型となってTIA-1の線維化を促進する
(左)TIA-1の線維化過程(黒色)は、ハンチンチン線維を加えることで促進する(赤色)。
(右)ハンチンチン線維を種にしてTIA-1の線維が成長している様子を蛍光顕微鏡でとらえたもの。
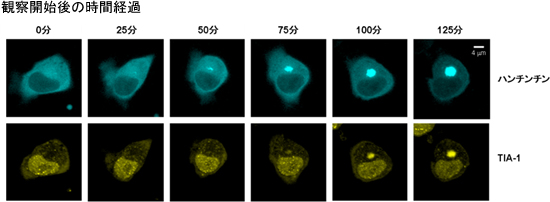
図3 一つの細胞でハンチンチン凝集とTIA-1の経時変化を同時に追跡した様子
(上)青色で示されたハンチンチンが時間経過に伴い凝集している。
(下)同じ細胞で観察したTIA-1(黄色)の挙動。観察開始後、25~50分でハンチンチンの凝集が始まるが、TIA-1が凝集体に巻き込まれるのはそれより遅く、約75分後から始まる。
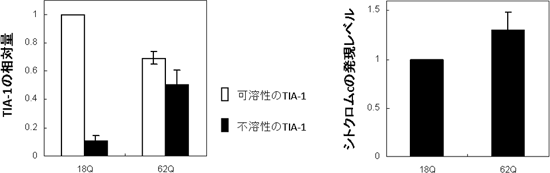
図4 TIA-1がハンチンチン凝集体に巻き込まれることによる機能の低下
(左)グルタミンが18個繰り返している、凝集しないハンチンチン(18Q)を発現させた細胞モデルでは、ほとんどのTIA-1は可溶性であるが、グルタミンが62個繰り返しているハンチンチン(62Q)を発現させた細胞では、ハンチンチンが凝集するため、それにともない約半分ほどのTIA-1が不溶性の凝集体となる。
(右)TIA-1はシトクロムcの発現を抑制する機能を持つが、62Qを発現させた細胞モデルではシトクロムcの発現が増加しており、TIA-1の機能が低下していることを示す。
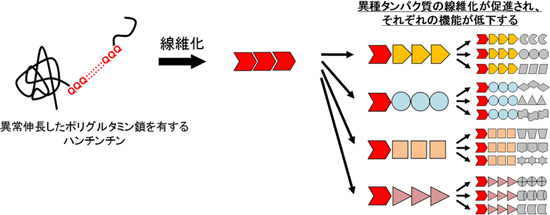
図5 ポリグルタミン病の発症に関わる新たな分子メカニズム
ハンチンチンのポリグルタミン鎖が異常伸長すると(左側)、線維構造へと変化する。このポリグルタミン線維(中央)が鋳型となって異なる種類のタンパク質の線維化を促し(右側)、個々の生理機能を低下させる。
