2009年12月21日
独立行政法人 理化学研究所
公立大学法人横浜市立大学
植物が持つ2つのイソプレノイド生合成経路の制御機構を発見
―ミトコンドリアで働くタンパク質が、葉緑体と細胞質における生合成を制御―
ポイント
- ミトコンドリアの呼吸鎖が葉緑体と細胞質に存在する2つの生合成経路に影響
- 植物が進化を経て発達させた細胞質と細胞内小器官同士の相互作用を解明
- 人の健康にも役立つイソプレノイド生合成の個別活性化の可能性を見いだす
要旨
独立行政法人理化学研究所(野依良治理事長)と公立大学法人横浜市立大学(本多常高理事長)は、植物の生体成分として重要な化合物「イソプレノイド※1」が、細胞質と細胞内小器官の1つ葉緑体の中で生合成される際に、別の細胞内小器官であるミトコンドリアに局在する呼吸鎖複合体※2が重要な役割を果たしていることを明らかにしました。理研植物科学研究センター代謝機能研究グループの村中俊哉客員主管研究員(横浜市立大学木原生物学研究所教授)、鈴木優志研究員、小林啓子客員研究員(国立大学法人九州大学農学研究院特任助教)、基幹研究所の松本正吾主任研究員(国立大学法人埼玉大学理工学研究科連携教授)、公立大学法人横浜市立大学木原生物学研究所の唐建偉特任助教による共同研究の成果です。
イソプレノイドとは、植物ホルモンやステロール※3、さらには薬理活性を示すさまざまな二次代謝産物※4を含めた多様な化合物の総称であり、生体成分としてだけでなく、医薬品原体や天然ゴムなど有用二次代謝産物としても重要な化合物群です。植物が産生するイソプレノイドの生合成経路には、細胞質で生合成されるメバロン酸(MVA)経路と、葉緑体で生合成される非メバロン酸(MEP)経路が知られています。これまで研究グループは、これら2つの経路によるイソプレノイド生合成が、ミトコンドリア内に局在するPPRタンパク質※5の1つ「LOI1タンパク質」により制御されていることを突き止めましたが、その詳細なメカニズムは分かっていませんでした。
今回、このLOI1タンパク質が、ミトコンドリアにある呼吸鎖複合体の調節に作用する結果、2つの経路で生じる多様なイソプレノイド生合成を制御していることを見いだしました。
MVA経路とMEP経路は、それぞれステロールやカロテノイドなど異なるイソプレノイド化合物を生合成しています。今回の発見は、人の健康にも役に立つさまざまな化合物の生合成を、必要に応じて個別に活性化できる可能性に道を拓くものです。同時に、独立した細胞内小器官であるミトコンドリアと葉緑体が、代謝産物を制御するレベルで細胞質と密接なつながりがあることを示しており、細胞の真核化・植物化※6を考える上で非常に重要な知見となります。
本研究成果は、英国の科学雑誌『Plant Journal』オンライン版に近く掲載されます。
背景
イソプレノイドは、自然界に23,000種以上も存在する化合物で、ステロールやホルモンといった生体成分としてだけでなく、医薬品原体や天然ゴムなど有用二次代謝産物としても重要な化合物群です。植物が産出するイソプレノイドは、細胞質のメバロン酸(MVA)経路と葉緑体の非メバロン酸(MEP)経路の2つの経路で生合成されます(図1)。MVA経路は動植物に共通した経路ですが、MVA経路の鍵酵素であるHMG-CoA還元酵素(HMGR)※7は、動植物によって異なる調節機構で制御されていると考えられていました。つまり、動物の場合には血中コレステロールに応答した複数の調節機構が存在しますが、植物の場合にはこれらの調節機構が存在しないため、植物に特異的なHMGR制御メカニズムが存在すると考えられていました。このメカニズムの解明のため、世界中の研究者は、HMGR阻害剤耐性変異体を単離し、その原因遺伝子を探索するという遺伝学的な戦略をとっています。2007年には、理研の研究グループが、核ゲノムにコードされているLOI1遺伝子を欠損したloi1(lovastatin insensitive 1)という変異体の単離に成功しました(Plant & Cell Physiology, 48: 322-331)。このloi1変異体は、HMGR阻害剤存在下で野生型より高いHMGR活性を持つとともに、MEP経路の阻害剤に対しても耐性を示しました。そこでloi1変異体の原因遺伝子であるLOI1遺伝子を単離して解析したところ、ミトコンドリアで機能するPPRタンパク質(pentatricopeptide repeat protein)をコードしていることが分かりました。PPRタンパク質とは、高等植物で高度に発達したタンパク質ファミリーの総称で、RNAと結合する能力を持ち、ミトコンドリアや葉緑体に移動して転写後調節※8に機能することが予測されています。つまり、loi1変異体では、このミトコンドリアゲノムコード遺伝子の転写後調節が異常となっていることが予測されました。しかし、この転写後調節がMVA経路の鍵酵素であるHMGRにどのように影響しているのかはまったく分かっていませんでした。そこで、研究グループは、LOI1タンパク質がミトコンドリアゲノムにコードされているどの遺伝子から発現するRNAと相互作用しているかを調べることにより、このメカニズムの解明に挑みました。
研究手法と成果
まず、LOI1遺伝子を過剰発現した植物から RNAやタンパク質を含んだ抽出液を得ます。この抽出液を抗LOI1抗体で免疫沈降※9させ、細胞内でLOI1タンパク質と相互作用するRNAを単離しました。その結果、cox3遺伝子とatp1遺伝子から発現するRNAを得ることができました。cox3とatp1のRNAを野生型とloi1変異体で比較した結果、野生型では起きるがloi1変異体では起きないRNA編集※8の場所がcox3遺伝子に1個所存在することを見いだしました。cox3タンパク質は、呼吸鎖複合体IV※2の構成要素で、その活性は、loi1変異体では野生型に比べて下がっていました。
さらに、ほかのミトコンドリア遺伝子のRNA編集に異常がないかを網羅的に調べたところ、loi1変異体ではnad4遺伝子とccb203遺伝子にそれぞれ野生型では起きるRNA編集が起きない個所が1個所ずつ存在することを見いだしました。nad4タンパク質は、呼吸鎖複合体I※2の構成要素で、ccb203タンパク質はチトクロームC※2の成熟因子です。loi1変異体に野生型LOI1遺伝子を導入するとRNA編集が回復したことから、RNA編集にLOI1がかかわっていることが分かりました。
loi1変異体で観察した呼吸鎖複合体でのRNA編集の異常の意味を明らかにするために、野生型に呼吸鎖複合体Iや複合体III※2の阻害剤を処理し、HMGR阻害剤やMEP経路の阻害剤に対する感受性を調べました。その結果、呼吸鎖複合体Iを阻害するとMEP経路阻害剤耐性を示す一方で、複合体IIIを阻害するとHMGR阻害剤耐性を示し(図2)、HMGR活性の上昇が観察されました。このHMGR活性の上昇は、HMGRタンパク質の蓄積量の上昇を伴わないことが確認できたことから、HMGR活性の上昇した原因は、HMGR酵素が活性化したためと想定できます。つまり、ミトコンドリアの呼吸鎖複合体Iが、葉緑体のMEP経路の制御にかかわり、複合体IIIと(または)複合体IVが細胞質のMVA経路の鍵酵素であるHMGRの制御にかかわるという、細胞内小器官同士や細胞内小器官と細胞質の間の巧妙な制御機構の存在を示しています(図3)。バクテリア由来のミトコンドリアや葉緑体が細胞内で共生を始めたのは10億年以上前の太古ですが、細胞内で共生してきた長い歴史の中で細胞内小器官の壁を越えた円滑な代謝制御を進めるために、植物はPPRタンパク質というタンパク質ファミリーを高度に発達させ、RNA編集を行ってイソプレノイドの生合成を制御してきたと考えることができます。これは、植物の進化の観点からも非常に興味深い知見となります。
今後の期待
今回の研究で、驚くべきことにミトコンドリアで機能する呼吸鎖複合体が、葉緑体のMEP経路の制御や細胞質のHMGRの活性制御にかかわることが分かってきました。ミトコンドリアの呼吸鎖がイソプレノイド生合成制御にかかわるという知見を得たことは、動植物を通じて初めてです。しかし、どのように制御しているかという、具体的なメカニズムはいまだ解明できていません。酸化ストレス※10などの関与が可能性として考えられますが、両者をつなぐためにはさらなる研究が必要です。
植物は、MVA経路でステロールなどを生成し、MEP経路ではカロテノイドなどを生成しており、それぞれの経路で人の健康にも役立つ異なるイソプレノイド化合物を生産しています。ミトコンドリアの呼吸鎖複合体は、MVA経路とMEP経路の活性化のオン/オフを制御しているかもしれません。今回の発見は、必要に応じて各経路を個別に調節する新たな植物調節薬の開発など、さまざまな有用化合物の生合成を、必要に応じて個別に活性化させる可能性に道を拓くものです。
発表者
理化学研究所
植物科学研究センター 代謝機能研究グループ
代謝機能研究チーム 客員主管研究員
公立大学法人横浜市立大学 木原生物学研究所 教授
村中 俊哉(むらなか としや)
Tel: 045-820-2445 / Fax: 045-820-1901
お問い合わせ先
独立行政法人理化学研究所 横浜研究推進部企画課Tel: 045-503-9117 / Fax: 045-503-9113
公立大学法人横浜市立大学 研究推進センター
Tel: 045-787-2063 / Fax: 045-787-2025
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.イソプレノイド
「イソプレン」と呼ばれるC5化合物を基本骨格とする化合物群を、総称してイソプレノイドと呼ぶ。植物ホルモンやステロールなどの細胞膜脂質、クロロフィルやカロテノイドなどの色素といった植物細胞にとって必須な多くの成分がイソプレノイド化合物である。また生体成分としてだけでなく、さまざまな医薬原体や天然ゴムなど、有用な二次代謝産物が多くある。 - 2.呼吸鎖複合体、呼吸鎖複合体I、III、IV、チトクロームC
電子伝達系は細胞呼吸の最終ステップであり、呼吸鎖複合体は複合体Iから複合体Vの5種類の複合体からなる。複合体I、II、III、IVが電子を受け渡して行く過程で生じる膜電位差を利用して、複合体Vが高エネルギー化合物であるATPを合成する。チトクロームCは複合体IIIから複合体IVへの電子伝達をつかさどるタンパク質である。(図3参照) - 3.ステロール
イソプレノイドの1種。真核細胞の細胞膜の構成要素であり、また、ステロイドホルモンの前駆体でもある。生物が持つ主なステロールは種によって異なり、動物ではコレステロール、酵母ではエルゴステロール、植物ではシトステロールが主である。 - 4.二次代謝産物
生物は、自らの成長や分化に直接的に機能していないと考えられる多様な有機化合物を生合成している。これらを総称して二次代謝産物という。植物は非常に多種多様な二次代謝産物を生合成しており、その中には人の生活にとって毒や薬になる成分も多い。 - 5.PPRタンパク質
pentatricopeptide repeat protein の略。35個のアミノ酸の繰り返しという特徴的な構造に着目されて見いだされたタンパク質ファミリー。陸上高等植物で特に高度に発達し、シロイヌナズナやイネのゲノム中からは約500個の遺伝子が見つかっている一方、ヒトなどの動物では10個以内しか見つかっていない。約500個の遺伝子の多くがミトコンドリアや葉緑体などの細胞内小器官に局在すると考えられている。PPRタンパク質は、細胞内小器官のゲノムにコードされている遺伝子から発現するRNAを配列特異的に認識して結合し、多岐にわたる転写後の修飾過程(RNA編集、プロセシングなど)にかかわることで、核から細胞内小器官を制御する因子として機能すると考えられ、注目を集めている。 - 6.植物化
植物細胞は10億年以上前に真核細胞にラン藻(シアノバクテリア)が共生したことによって生じた。共生を始めた時にはただの同居であったが、その後、ラン藻のゲノムにコードされた遺伝子の多くは細胞核に移動し、ラン藻自身はやがて分裂同調や協調的な代謝反応など細胞の制御を受ける細胞内小器官の1つとして葉緑体に進化していった。この複合的な進化の過程を植物化と呼ぶ。 - 7.HMG-CoA還元酵素(HMGR)
HMG-CoAをメバロン酸(MVA)に還元する酵素で、メバロン酸経路の鍵酵素である。動物ではコレステロール生合成の鍵酵素でもあるので、抗高コレステロール薬のターゲット酵素となっている。 - 8.転写後調節、RNA編集
遺伝子はゲノムDNAからRNAに転写された後にさまざまな修飾を受ける。RNAの配列や安定性を制御するこれらの修飾を転写後調節と呼ぶ。
RNA編集はさまざまな転写後調節の中の一つである。陸上植物において、ミトコンドリアや葉緑体などの細胞内小器官のゲノムにコードされている遺伝子では、転写後に特定の塩基がほかの塩基に変換され、遺伝情報が編集される現象が多数見つかっている。この修飾のことをRNA編集という。シロイヌナズナでは葉緑体で約30個所、ミトコンドリアで約400個所見つかっている。主にシチジン(C)からウリジン(U)への変換が見られる。 - 9.免疫沈降
調べたいタンパク質(抗原)を認識する抗体を準備し、この抗体を固相物質に結合させておく。抗原を含むタンパク質溶液と抗体を混ぜて抗原抗体複合体を形成させ、沈殿分離させる。この時、抗原タンパク質がほかの物質(タンパク質やDNAまたはRNA)と強く結合しているなら、これらも一緒に沈降してくる。この方法は調べたいタンパク質と相互作用する物質を探索したい時や、候補となる物質が本当に相互作用しているかどうかを調べる時に用いられる。 - 10.酸化ストレス
生体内ではさまざまな活性酸素(過酸化水素やスーパーオキサイド、ヒドロキシラジカルなど)が生じる。活性酸素は生体内の免疫・防御システムや細胞内情報伝達などに機能するが、過剰な活性酸素は細胞にとって重要な生体構成成分を酸化損傷していく。過剰な酸化力から自らを守るために、生物は抗酸化システムを持つ。活性酸素の酸化力と抗酸化システムの抗酸化力との差を酸化ストレスという。
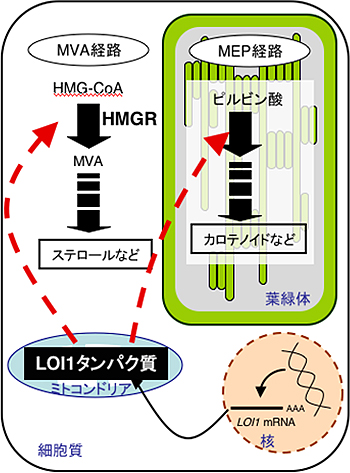
図1 植物細胞内におけるイソプレノイド生合成の概念図
細胞質のMVA経路では、ステロールなどが、葉緑体のMEP経路ではカロテノイドなどが生合成される(黒太矢印)。核で転写されたLOI1遺伝子はタンパク質に翻訳された後にミトコンドリアに輸送される(黒細矢印)。ミトコンドリアで呼吸鎖複合体にかかわる遺伝子を転写後調節(RNA編集)することで細胞質のMVA経路と葉緑体のMEP経路の制御にかかわる(赤点線矢印)。
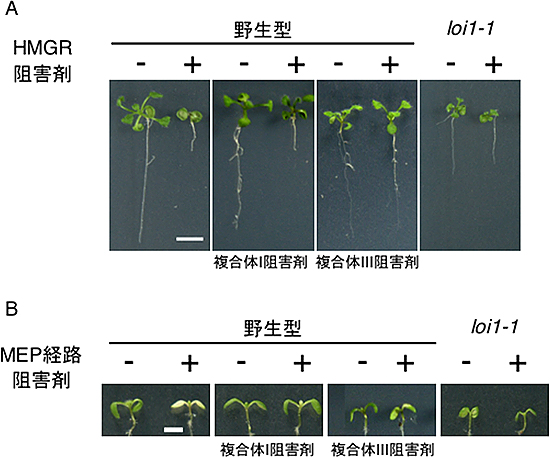
図2 呼吸鎖阻害剤がイソプレノイド生合成阻害剤感受性に与える効果
A:HMGR阻害剤存在下で育てられた野生型は著しく矮(わい)化するが、loi1変異体はHMGR阻害剤に対して耐性を示す。呼吸鎖複合体III阻害剤を同時に与えることにより、野生型でもloi1変異体のような形質を示すが、この効果は呼吸鎖複合体I阻害剤では見られない。
B:MEP経路阻害剤存在下で育てられた野生型は著しく薄緑化するが、loi1変異体はMEP経路阻害剤に対して耐性を示す。呼吸鎖複合体I阻害剤を同時に与えることにより、野生型でもloi1変異体のような形質を示すが、この効果は呼吸鎖複合体III阻害剤では弱い。
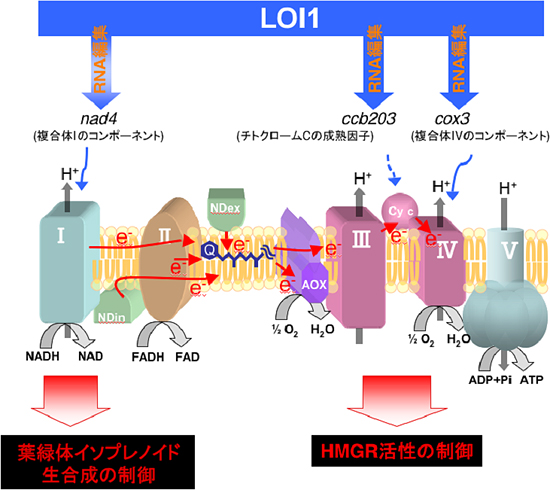
図3 LOI1がかかわるミトコンドリア呼吸鎖を介したイソプレノイド生合成制御機構
LOI1タンパク質は、nad4遺伝子, ccb203遺伝子, cox3遺伝子のRNA編集にかかわっている。loi1変異体や呼吸鎖複合体の阻害剤を用いた実験から、複合体Iが葉緑体でのイソプレノイド生合成(MEP)経路を制御し、チトクロームCや複合体IIIと(または)複合体IVがHMGRの酵素活性を制御することで、細胞質でのイソプレノイド生合成(MVA)経路の制御にかかわっていることを明らかにした。
