2010年3月30日
独立行政法人 理化学研究所
母性染色体異常が引き起こす神経発達障害の原因遺伝子の働きを解明
-アンジェルマン症候群の原因遺伝子Ube3aが大脳皮質機能の成熟に必須-
ポイント
- Ube3a遺伝子の働きが、大脳皮質回路の臨界期可塑性に欠かせないと判明
- Ube3a遺伝子の機能は、大脳皮質回路の臨界期終了後の成熟にも必須
- アンジェルマン症候群の主症状である精神発達遅滞の解明に貢献
要旨
独立行政法人理化学研究所(野依良治理事長)は、母性染色体※1の異常が引き起こす神経発達障害アンジェルマン症候群※2の原因遺伝子Ube3aが、大脳皮質※3機能の可塑性※4とその後の成熟に必須であることを、Ube3a遺伝子を欠損したアンジェルマン症候群のモデルマウスを用いた研究で明らかにしました。これは、カリフォルニア大学サンフランシスコ校のマイケル・ストライカー(Michael Stryker)教授と脳科学総合研究センター(利根川進センター長)シナプス機能研究チーム(林康紀チームリーダー)の佐藤正晃研究員(前カリフォルニア大学サンフランシスコ校博士研究員)との共同研究による成果です。
研究チームは、母性染色体上のUbe3a遺伝子を欠損したマウスを用いて、大脳皮質にある視覚野※3の可塑性を、神経活動に伴う脳の代謝変化を画像化する「内因性シグナル光学イメージング※5」という手法で調べました。その結果、生後4週目の発達時期(臨界期※6)に片目からの視覚経験を短期的に遮へいすると、野生型マウスは、遮へい眼の視覚野の活動が顕著に弱まるという可塑性を示す一方で、Ube3a母性欠損マウスは、活動の弱まる程度が低く(可塑性の度合いが小さく)なることを見いだしました。また、臨界期が終了する生後6週目では、長期的に視覚経験を遮へいすると、野生型マウスは非遮へい眼の視覚野の活動が強くなるという特徴的な可塑性を示しますが、Ube3a母性欠損マウスは、野生型マウスが臨界期で示したように遮へい眼の視覚野の活動が弱まることが分かりました。これらの結果から、母性染色体上のUbe3a遺伝子の機能が、大脳皮質の神経機能の成熟に必須であることが判明しました。アンジェルマン症候群の主な症状である精神発達遅滞の病態解明と、その治療法の開発に役立つことが期待できます。
本研究成果は、米国科学アカデミー紀要『Proceedings of the National Academy of Sciences of the United States of America(PNAS)』2010年3月23日号に掲載されました。
背景
Ube3a遺伝子は、細胞内で不要になったタンパク質に目印を付加する機能(ユビキチンリカーゼ活性)を持つタンパク質の1つをコードします。この遺伝子をヒトで欠損すると、アンジェルマン症候群という遺伝性の神経発達障害を引き起こします。Ube3a遺伝子は、ヒトの場合15番染色体に存在し、興味深いことに、父母からそれぞれ受けついだ2本の染色体のうち、「ゲノム刷り込み※7による母性発現」と呼ぶ機構により、脳では母方由来のものだけが発現します。そのため、比較的まれな母性15番染色体の異常により、アンジェルマン症候群は発症します。アンジェルマン症候群の患者は日本でも少なくなく、精神発達遅滞、言語障害、歩行失調、痙攣(けいれん)、頻繁に笑うなどの独特の行動をはじめとした、多様な症状を特徴とします。
研究チームは、こうしたアンジェルマン症候群の病態の一部に、Ube3a遺伝子の欠損による神経回路の発達異常がかかわっているのではないかと考え、Ube3a遺伝子が大脳皮質の生後の発達に果たす役割を、マウスの大脳皮質にある視覚野の神経回路をモデルにして調べました。マウスの視覚野の生後発達とその後の成熟は、視覚中枢同士の規則正しい神経細胞の結合の形成や、視覚経験が回路の精緻(せいち)化に大きな影響を及ぼす臨界期の開始と終了など、複数の過程が生後1週から6週にかけて一定の順番で進みます。また、これら一連の過程が、遺伝的プログラムと視覚経験の相互作用によって起こるために、視覚野の神経回路は、脳の生後発達を詳細に調べるために極めて有用なモデルとなっています。
研究手法と成果
研究チームは、まずアンジェルマン症候群のモデルとなるマウスを得るために、遺伝子改変によって2本の染色体のどちらか一方のUbe3a遺伝子を欠損(ヘテロ接合体)した雌マウスと、野生型の雄マウスを交配して、母方からの染色体上のUbe3a遺伝子だけが欠損したUbe3a母性欠損マウスを得ました(図1A)。
マウスは生後4週目になると、視覚野が顕著な感受性を示して発達する臨界期という時期を迎えます。このときの視覚野のUbe3aタンパク質の発現を調べると、野生型マウスの神経細胞では主に細胞核に強い局在が見られましたが、Ube3a母性欠損マウスの神経細胞では、父性染色体上のUbe3a遺伝子は正常であるにもかかわらず、Ube3aタンパク質の発現がほぼ完全に消失していました(図1B)。この結果は、ヒトの脳で報告されているのと同様に、マウスの視覚野でも、Ube3a遺伝子が母性染色体から発現していることを示しています。
また、このUbe3a母性欠損マウスの視覚野の機能が臨界期にどう発達するかを調べました。具体的には、生後4週目に片目を数日間閉じて、視覚経験を遮へいしたときの可塑性の度合いを、マウスの小さな脳部位の神経活動を画像化することのできる、高解像度の内因性シグナル光学イメージングを用いて調べました(図2)。野生型マウスの視覚野は、臨界期に片眼からの視覚経験を短期間(4日間)遮へいすると、遮へい眼に対する視覚野の活動が弱くなる「眼優位可塑性※8」という可塑性を容易に引き起こすことが知られています。しかし、Ube3a母性欠損マウスでは、この眼優位可塑性の度合いが野生型マウスに比べて約28%と著しく減少していました(図3)。このことは、母性染色体のUbe3a遺伝子欠損によって、視覚野の神経回路の適応性を大幅に失ったことを示しています。
次に、臨界期終了後の視覚野の発達の様子を調べました。研究チームはすでに、野生型マウスが臨界期を終了する生後6週に、より長期間(7日間)片眼を遮へいすることによって、非遮へい眼に対する視覚野の活動が増強するという「成体眼優位可塑性※8」を報告しています。しかし、Ube3a母性欠損マウスではこの成体眼優位可塑性が見られず、むしろ臨界期に見られる眼優位可塑性のような遮へい眼の視覚野の活動の減弱がゆるやかに起こりました(図4)。このことは、母性染色体のUbe3a遺伝子が欠損すると、臨界期終了後の視覚野の発達の段階でも、その可塑性が臨界期終了以前の未熟な状態にとどまってしまうことを示します。つまり、母性由来のUbe3a遺伝子が、大脳皮質視覚野の機能の成熟に必須な役割を持つと結論づけることができました。
さらに、Ube3a母性欠損マウスの視覚にかかわる脳領域間の結合の様子を調べると、生後1週目に形成される眼から視床への神経結合と、視床から大脳皮質視覚野への神経結合はほぼ正常でした。しかし、視覚野内の神経回路の構造に着目し、生後4週目のマウス視覚野を緑色蛍光タンパク質でラベルして、第5層の神経細胞の棘(きょく)突起※9の密度を調べると、Ube3a母性欠損マウスの神経細胞では、細胞体から上方向に伸びる樹状突起上の棘突起密度は正常でしたが、水平方向へ伸びる樹状突起上の棘突起密度が野生型マウスに比べ減少していました(図5)。これは、Ube3a母性欠損マウスでは、脳の領域間の回路の大まかな配線は保たれているものの、視覚野内の局所的な神経回路の結合に異常があることを示しています。
今後の期待
大脳機能の生後成熟において、Ube3a遺伝子の必須な役割を明らかにした今回の研究成果は、アンジェルマン症候群の主症状である精神発達遅滞の病態解明と、新たな治療法の開発につながると期待できます。今後は、以下の2つの方向性に基づき研究を進めていきます。
第1の方向性は、Ube3aがそのユビキチンリガーゼ活性によって目印を付加する標的タンパク質を同定するとともに、神経細胞内で、このシグナル経路がどういう機能を担っているかを明らかにすることです。Ube3aの標的タンパク質には、神経活動によってその発現が制御されるArcと呼ばれるタンパク質を含め、現在までにいくつかの報告があります。また今回の研究で、野生型マウスの生後4週目の視覚野の神経細胞では、細胞核にUbe3aタンパク質が局在していたことから、Ube3aタンパク質は核で遺伝子発現の調節にかかわっている可能性があります。今後、Ube3a母性欠損マウスの大脳皮質の遺伝子発現パターンをゲノム規模で網羅的に調べ、細胞外マトリックスタンパク質※10など神経回路の成熟にかかわる遺伝子の発現に変化があるかどうかを調べると、Ube3aタンパク質の欠損によってなぜ神経回路の発達に影響が及ぶのかを理解するための有効なアプローチになると考えられます。
第二の方向性は、今回分かったUbe3a遺伝子の欠損による可塑性障害の程度を指標として、その障害を回復させる働きをもつ薬物や遺伝子を探索することです。特に、アンジェルマン症候群のほとんどは、父性染色体のUbe3a遺伝子の構造は正常に保たれていると考えられるため、父性染色体のUbe3a遺伝子の機能の抑制を解除する薬物や遺伝子を見つけることができると、アンジェルマン症候群の治療は大きく進歩する可能性があります。
発表者
理化学研究所
脳科学総合研究センター 記憶メカニズム研究チーム
研究員 佐藤 正晃(さとう まさあき)
Tel: 048-462-1111 内線7445
Fax: 048-467-6946
お問い合わせ先
脳科学研究推進部Tel: 048-467-9757 / Fax: 048-462-4914
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.母性染色体
受精時に父親と母親からそれぞれ受けつぐ1対の染色体のうち、母親由来のものをここでは母性染色体(maternal chromosome)と呼ぶ。同様に父性染色体(paternal chromosome)は父親由来の染色体を指す。 - 2.アンジェルマン症候群
1965年に英国の医師ハリー・アンジェルマン(Harry Angelman)によって最初に報告された神経発達障害のこと。ヒトの脳の場合、父母からそれぞれ受けついだ2本の15番染色体上の Ube3a遺伝子のうち、母方由来のものだけが発現するため、母方由来の染色体に存在する Ube3a遺伝子を欠損すると、アンジェルマン症候群(Angelman syndrome)が発症する。精神発達遅滞、言語障害、歩行失調、痙攣(けいれん)、頻繁に笑うなどの独特の行動をはじめとした、多様な症状を特徴とする。欧米の調査をもとにした有病率は約1万5千人に1人といわれている。この数字を仮に日本における2009年の出生数約107万人(厚生労働省調べ)にあてはめると、日本ではアンジェルマン症候群の新生児が年間約70人生まれている計算になる。 - 3.大脳皮質、視覚野
哺(ほ)乳類、特にヒトで顕著に発達した、大脳の表面を覆うように存在する神経細胞の層状構造。垂直方向には神経細胞が6層に並んだ構造を持ち、水平方向には分担する機能によって、視覚野、聴覚野、運動野などの領野に分かれる。 - 4.可塑性
脳が異なる刺激や経験に応じて、その構造や機能を適応的に変化させる性質のこと。動物個体において異なる感覚経験や学習経験が引き起こす可塑性を、特に経験依存的可塑性(experience-dependent plasticity)と呼ぶ。 - 5.内因性シグナル光学イメージング
神経活動に伴う脳の代謝変化を検出することで、活動した脳の部位と活動の大きさを画像化する技術。脳組織の赤色光に対する光の吸収率が、神経細胞の活動後、数秒でごくわずかに増加する性質を利用したもの。 - 6.臨界期
脳の生後発達の過程でみられる、感覚経験の変化が神経回路の精緻化に極めて大きな影響を及ぼす短い一時期のこと。 - 7.ゲノム刷り込み
ヒトを含む哺(ほ)乳類のゲノム中のほとんどの遺伝子は、父親と母親のそれぞれに由来する1対の染色体の両方から等しく発現するが、全遺伝子の1%以下と推定されるごく一部の遺伝子では、一方の親由来の染色体からの発現が選択的に抑制され、他方の親由来の染色体からのみ発現が起こる。このような親特異的な遺伝子発現の抑制をゲノム刷り込みと呼ぶ。 - 8.眼優位可塑性、成体眼優位可塑性,
視覚野の神経細胞の多くは両方の眼からの入力を受けて活動するが、臨界期に片方の眼の瞼(まぶた)を一定期間閉じて視覚を遮へい(片眼遮へい)すると、これらの神経細胞の遮へい眼に対する反応性が失われ、それぞれの眼に対する活動の相対比(眼優位比)が、遮へい眼優位から非遮へい眼優位の方向へ劇的に変化することが知られている。この可塑性を眼優位可塑性(ocular dominance plasticity)と呼ぶ。従来、視覚野では臨界期を過ぎると、この眼優位可塑性はほとんど起こらないと考えられてきたが、マウスを用いた最近の研究では、臨界期後でも片眼遮へいの期間を長くすれば、程度は小さくなるが明らかな眼優位可塑性が起こることを報告しており、これを成体眼優位可塑性(adult ocular dominance plasticity)と呼ぶ。この現象は、臨界期可塑性のように遮へい眼に対する反応が弱くなるのではなく、むしろ非遮へい眼に対する反応が増強することで、視覚野の眼優位比が非遮へい眼側に変化する。このことは臨界期の眼優位可塑性と成体眼優位可塑性が異なるメカニズムで起こることを示しており、その違いの解明が期待される。 - 9.棘(きょく)突起
神経細胞がほかの細胞からの信号を受けとる樹状突起上に多数存在し、直径1マイクロメートル程度の小さな棘状の突起のこと。スパインとも呼ばれる。信号を送るほかの神経細胞は、この棘突起上にシナプスと呼ばれる神経細胞同士の継ぎ目構造を作る。 - 10.細胞外マトリックスタンパク質
多細胞生物の組織において細胞の外に分泌、蓄積する高分子複合体(細胞外マトリックス)の成分となるタンパク質で、細胞同士の接着の足場になったり、細胞の増殖や成長を制御するなど、その組織内での生存環境の形成に重要な役割を持つ。特に脳では、神経細胞を取り巻くように存在する細胞外マトリックスが、神経の再生や可塑性に対して抑制的に働くとされる。
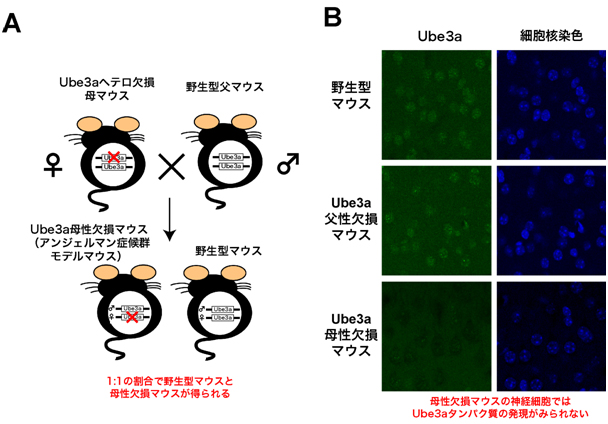
図1 マウス視覚野におけるUbe3aの母性発現
(A)一対のUbe3a遺伝子の片方を欠く(ヘテロ欠損)母マウスと野生型父マウスの交配により、母親由来の染色体上のUbe3a遺伝子を欠いた母性欠損マウスが得られる。
(B)野生型マウスとUbe3a父性欠損マウスの視覚野の神経細胞では、細胞核染色で染まる核(青の丸い部分)の場所に、Ube3aタンパク質の存在(緑の丸い部分)が観察される。一方、Ube3a母性欠損マウスでは、このUbe3aタンパク質が消失し、核の部分が黒く抜けて見える。
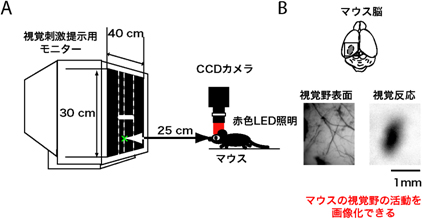
図2 内因性シグナル光学イメージングによる視覚野活動の画像化
(A)麻酔下のマウスに視覚刺激を提示し、視覚野表面の画像を赤色照明下でCCDカメラにより連続的に取得する。
(B)マウス視覚野(上図の灰色部分)の表面画像(下左図)と、視覚刺激提示中に取得した画像を数学的に解析して得られる視覚反応画像(下右図)。反応が強いほど、活動した脳の領域が黒く表現される。この技術により、長さ約1mm、幅約0.5mmの小さなマウスの視覚野の活動を画像化することができる。
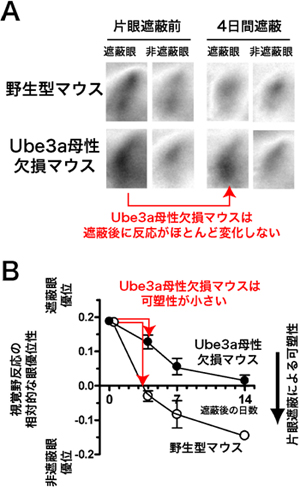
図3 Ube3a母性欠損マウスの視覚野における臨界期可塑性の障害
(A)内因性シグナル光学イメージングで測定した臨界期の視覚野の反応。野生型マウスでは4日間の片眼遮へいによって遮へい眼の反応の強さが弱くなるが(臨界期可塑性)、Ube3a母性欠損マウスではこの減弱がほとんど起こらない。
(B)それぞれの眼に対する視覚野の反応の強さの相対的な比を計算すると、野生型マウスでは、4日間の片眼遮蔽後にこの比が非遮蔽眼方向に大きく変化するが、Ube3a母性欠損マウスでは、この変化は28%と小さい(可塑性の度合いが小さい)。この差は片眼遮蔽を14日まで延長しても存続する。
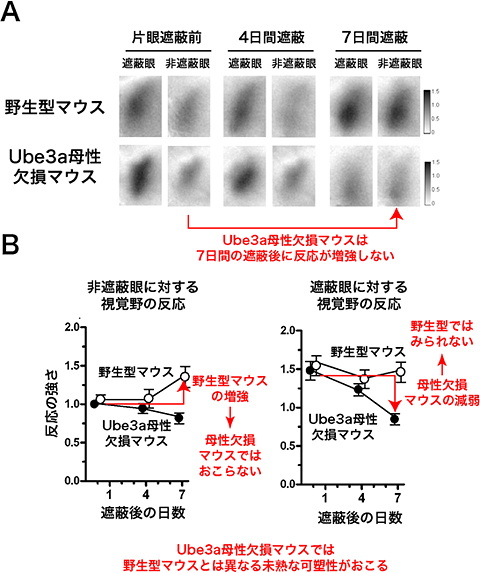
図4 臨界期終了後のUbe3a母性欠損マウスの視覚野の可塑性
(A)内因性シグナル光学イメージングで測定した臨界期終了後の視覚野の反応。
(B)野生型マウスでは7日間の片眼遮へい後に非遮蔽眼の反応の増強が見られるが(成体眼優位可塑性)、Ube3a母性欠損マウスではこの特徴が見られず、むしろ臨界期の可塑性のように遮へい眼の反応が減弱し続ける。

図5 Ube3a母性欠損マウスの神経細胞の棘突起
(A)視覚野の神経細胞の模式図。
(B)(A)の点線部分の拡大写真。Ube3a母性欠損マウスでは細胞体から水平方向に伸びる樹状突起上の棘突起が減少していた。
