2010年5月20日
独立行政法人 理化学研究所
リンパ球への化学的な糖鎖導入技術でがん認識能力が向上
-高速6π-アザ電子環状反応を活用し、世界で初めて細胞を糖鎖修飾化-
ポイント
- 生きた細胞の表面へ複合型N-結合型糖鎖を短時間で簡便に修飾することに成功
- 糖鎖修飾活性化リンパ球が、がん組織に効率的に集積することをマウス実験で確認
- がんの免疫細胞療法などの評価法の構築と治療効果の飛躍的な向上に期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、高速6π-アザ電子環状反応※1を活用し、生きた細胞の表面に複合型N-結合型糖鎖※2を簡便に導入することに世界で初めて成功しました。さらに、細胞の表面に糖鎖修飾した活性化リンパ球が、がん組織に効率よく集まることをモデルマウスの実験で確かめました。理研分子イメージング科学研究センター(渡辺恭良センター長)分子プローブ機能評価研究チーム(尾上浩隆チームリーダー)の田原強研究員、分子プローブ動態応用研究チーム(渡辺恭良チームリーダー)の野崎聡研究員と国立大学法人大阪大学大学院理学研究科天然物有機化学研究室(深瀬浩一教授)の田中克典助教、キシダ化学株式会社(大阪市中央区本町橋、岸田充弘代表取締役)の小山幸一研究員との共同研究による成果です。
研究グループは、高速6π-アザ電子環状反応を活用し、37℃という温和な反応条件の下、10~30分間という短い時間で、ラットの培養細胞の細胞表面に選択的に複合型N-結合型糖鎖を結合させることに世界で初めて成功しました。さらに、この糖鎖修飾法を用いて、マウスから取り出したリンパ球を試験管内で活性化した後、リンパ球に複合型N-結合型糖鎖と蛍光色素Cy5(蛍光波長670nm、赤色)の両分子を結合させ、がん細胞移植モデルマウスに投与すると、この糖鎖を修飾したリンパ球が、がん組織に効率的に集積することを蛍光イメージングで観察することができました。
糖鎖は、細胞表面にあるタンパク質の安定性や働きを調節することで、細胞間の相互作用に関与し、細胞の行き先(どの組織と結合するか)を決める重要な因子となっています。研究グループが開発した細胞表面への糖鎖導入技術は、さまざまな糖鎖を付加することで、細胞に新たな機能を持たせることが可能で、がんの免疫細胞療法では、その治療効果を飛躍的に向上させることが期待できます。
この研究成果は、米国の科学雑誌『Journal of Carbohydrate Chemistry』オンライン版に近く掲載されます。
背景
研究グループはこれまでに、高速6π-アザ電子環状反応を応用し、生きた細胞表面へ温和な反応条件および数分という短時間で極低濃度の蛍光物質を標識する技術を開発してきました。さらに、標識したリンパ球が、生体内で正常なホーミング※3をしている様子を可視化することに成功し、標識したリンパ球が正常な機能を保っていることを証明しました(2010年4月19日プレス発表)。
近年、がんの治療では、摘出手術・抗がん剤治療・放射線照射療法に次ぐ第4の治療法として、がん組織に集まり細胞障害性を発揮する活性化リンパ球を投与して、がん細胞を攻撃する免疫細胞療法が注目されています。この治療法では、活性化リンパ球が、がん組織に効率よく集まることが重要だと考えられています。現在実用化されているリンパ球調製法では、がん細胞を特異的に認識するリンパ球の割合が低いため、リンパ球ががん組織へ効率的に集まらず、がんの縮小などの治療効果が得られないケースが多い、という課題を抱えています。
がん細胞を特異的に認識するためには、リンパ球の細胞表面にある糖鎖の機能が重要であることが知られています。これまでに、リンパ球のがん細胞認識機能を上げるため、さまざまな研究が行われてきましたが、まだ効果的な改善例は報告されていません。そこで研究グループは、リンパ球のがん細胞認識機能を向上させるために、独自に開発した細胞表面への蛍光物質の標識方法を応用して、生きた細胞へ温和な反応条件の下、糖鎖を導入する技術の開発に挑みました。
研究手法と成果
研究グループは、ヘキサトリエン-β-カルボニル化合物※4の高速6π-アザ電子環状反応を活用して、複合型N-結合型糖鎖を、短時間で素早く、しかも100%の収率で、タンパク質のリジン残基に導入する方法を新たに開発しました(図1)。具体的には、ラット由来の脳腫瘍細胞に対して、複合型N-結合型糖鎖を結合させた電子環状反応プローブを作用させ、細胞表面に糖鎖を導入することに成功しました。プローブ溶液はマイクロチューブ内で簡単に調製でき、浮遊状態やシャーレに接着した状態の生きた細胞に対して、緩衝溶液中、37℃で10~30分間作用させた後、培養液で細胞を洗浄するだけで簡単に糖鎖導入細胞を得ることができました。
この糖鎖導入技術は、細胞表面の活性を損なうことなく、細胞表面の“外側”に位置して、反応性の高いリジンやエタノールアミンなどのアミノ基だけで反応が選択的に進行する特徴も併せ持っています。研究グループは、細胞表面に糖鎖が付加されたかどうか調べるために、導入した糖鎖に結合するTRITC標識レクチン(TRITC;蛍光波長580nm、オレンジ色)を細胞と反応させ、蛍光顕微鏡下で観察しました。その結果、糖鎖が細胞表面に結合していることを確認することができました。
次いで、糖鎖を付加することでがん細胞認識機能が向上するかどうかを確認するために、がん細胞移植モデルマウスを使って、マウスの生体内でがん組織への集積を観察しました。具体的には、正常マウスの血液から単離したリンパ球を活性化した後、複合型N-結合型糖鎖とCy5蛍光基(蛍光波長670nm、赤色)を導入し、糖鎖修飾と蛍光標識した活性化リンパ球をがん細胞移植モデルマウスに尾静脈から投与して、マウスを生きた状態のままで蛍光イメージングしました(図2)。コントロールには、Cy5蛍光基だけを導入し、糖鎖修飾していない活性化リンパ球を使用しました。その結果、糖鎖修飾した活性化リンパ球が、糖鎖修飾していない活性化リンパ球に比べ、顕著にがん組織に集積する様子を観察することに成功しました。これは、糖鎖で修飾することによって活性化リンパ球のがん細胞認識機能が向上したことを示しています。
今後の期待
糖鎖は、細胞表面にあるタンパク質の安定性や働きを調節することで、細胞間の相互作用に関与し、細胞の行き先(どの組織と結合するか)を決める重要な因子となっています。新たに開発した細胞表面への糖鎖導入技術は、さまざまな糖鎖を付加することによって、細胞に新たな機能を持たせることを可能にします。この技術によって、例えば、がんの免疫細胞療法などの治療効果を飛躍的に向上させることが期待できます。さらに、高速6π-アザ電子環状反応を用いると、生きた細胞を、各種金属の配位した標識基で標識することも可能です。このため、より簡便に標識細胞を利用したPET(陽電子放射断層画像撮影法)※5やMRI(核磁気共鳴画像法)※6などの非侵襲的イメージング技術へ応用することができ、これまでヒトでは実現していないがん治療法の新たな評価法としても期待できます。
発表者
理化学研究所
分子イメージング科学研究センター
分子プローブ機能評価研究チーム
チームリーダー 尾上 浩隆(おのえ ひろたか)
研究員 田原 強(たはら つよし)
Tel: 078-304-7121 / Fax: 078-304-7123
分子プローブ動態応用研究チーム
チームリーダー 渡辺 恭良(わたなべ やすよし)
研究員 野崎 聡(のざき さとし)
Tel: 078-304-7124 / Fax: 078-304-7126
お問い合わせ先
神戸研究推進部 企画課Tel: 078-306-3007 / Fax: 078-306-3039
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.高速6π-アザ電子環状反応
1-アザトリエンの末端炭素原子と窒素原子が結合してピリジン誘導体を与える反応をアザ電子環状反応と呼ぶ。この反応は古くから良く知られていたものの、長い反応時間と高い反応温度が必要とされ、さらに収率も良くなかったことから積極的に合成法として活用されることは少なかった。しかし1998年に、アザ電子環状反応を強力に促進させる置換基効果が発見されて以来、この“高速アザ電子環状反応”は天然物の合成に限らず、生物分野や医療分野への応用、例えば、生体分子や細胞の標識、あるいはエンジニアリングのための次世代クリック型反応として大きな注目を集めるようになった。 - 2.複合型 N-結合型糖鎖
N-型糖鎖とは、糖タンパク質の糖鎖のうち、タンパク質のアスパラギン残基に結合している糖鎖のこと。複合型糖鎖とは、Galβ1-4GlcNAc構造(ラクトサミン構造)を持ち、基本構造の先に付いている枝の本数に応じて、一本鎖(monoantenna)、二本鎖(biantenna)、三本鎖(triantenna)と呼ぶ。 - 3.ホーミング
リンパ球は、胸腺、骨髄などの一次リンパ組織で産生され、血管系を経てリンパ節、パイエル板、脾臓などの二次リンパ組織の間を繰り返して循環する。リンパ球はリンパ組織内で外来抗原などの刺激により特定のリンパ球(エフェクター細胞やメモリー細胞)などへ分化し、リンパ組織内の特定の領域(ヘルパーTリンパ球は傍皮質領域、Bリンパ球は皮質内の胚中心、プラズマ細胞は髄索領域)やほかの特定の組織へと分布するようになる。一方、分化しなかったリンパ球はリンパ管を経てそのリンパ組織を離れ、胸管を介して血管系に戻り、さらに再循環現象を繰り返す。このようなリンパ球の移動現象は一般にリンパ球ホーミング(lymphocyte homing)と呼ばれている。 - 4.ヘキサトリエン-β-カルボニル化合物
アミノ基を高速6π‐アザ電子環状反応によって修飾するための化合物の総称。 - 5.PET(陽電子放射断層画像撮影法)
Positron Emission Tomographyの略。ごく微量の放射線を出す原子を薬などの分子に導入し、そこから出る放射線を測定することで、薬が体内のどこにあるかを見る方法。PETで見ることができる放射線を出す原子には、炭素や窒素、酸素、フッ素および金属などを用いる。 - 6.MRI(核磁気共鳴画像法)
Magnetic Resonance Imagingの略。磁気と電磁波、それに水素原子の動きを利用して、主に身体の解剖学的な情報を得る技術。水素原子には、磁気に反応する性質があるため、磁場をつくる装置の中で体に電磁波を当てると、体内の水素原子が反応して信号を発することから、その信号をとらえコンピューターで解析して画像にしている。
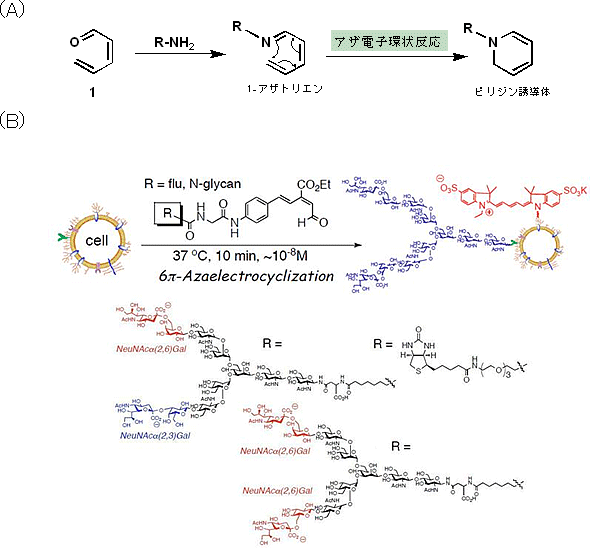
図1 高速6π-アザ電子環状反応(A)とアザ電子環状反応を用いた細胞表面への糖鎖修飾(B)
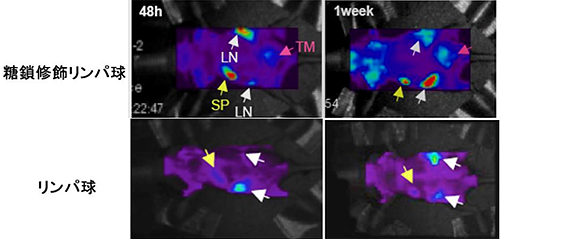
図2 糖鎖修飾活性化リンパ球を用いた非侵襲的がんイメージング
(TM:がん組織、LN:リンパ節、SP:脾(ひ)臓)
糖鎖修飾および蛍光標識した1万個の活性化リンパ球をがん細胞移植モデルマウスの尾静脈から投与し、活性化リンパ球のがん組織への集積の様子を、蛍光イメージング装置で投与48時間、1週間後に観察した。糖鎖修飾した活性化リンパ球は、糖鎖修飾していない活性化リンパ球に比べ、顕著にがん組織への集積が見られた。
