2010年7月30日
独立行政法人 理化学研究所
免疫センサーを制御する動植物に共通な仕組みを解明
-免疫センサーの制御タンパク質複合体の立体構造解析から機能を解く―
ポイント
- 免疫センサーの制御にはRAR1-SGT1-HSP90複合体形成が必須
- RAR1が複合体形成を促進し、HSP90のATP分解活性を上げ、複合体の機能を増大
- 機能タンパク質複合体の立体構造情報を基に耐病性作物の作出戦略に道を開く
要旨
独立行政法人理化学研究所(野依良治理事長)は、種を超えて動植物に共通する免疫センサー※1を制御するタンパク質複合体(RAR1、SGT1、HSP90という3つのタンパク質で構成)の立体構造の解明から、RAR1が複合体形成を促進して機能を高め、ウイルス(タバコモザイクウイルス)の侵入を防御する仕組みを解明しました。これは理研植物科学研究センター(篠崎一雄センター長)植物免疫研究グループの白須賢グループディレクター、門田康弘 基礎科学特別研究員と英国・The Institute of Cancer Researchのミンハオ・ツァン(Minghao Zhang)研究員、ローレンス・パール(Laurence H. Pearl)教授との共同研究の成果です。
植物は常に病気の脅威にさらされており、毎年8億人分を支える食糧が作物の病気により失われているといわれています(国連食糧農業機関)。将来予想される爆発的な人口増加や近年のバイオ燃料の需要拡大などに対応する手段として、耐病性作物による収量増大に大きな期待が寄せられています。
植物は、病原体を認識する免疫センサーを持ち、その侵入を認識して速やかに撃退します。研究グループはこれまで、RAR1、SGT1、HSP90という3つのタンパク質で構成する複合体が免疫センサーに結合し、その働きを制御していることを明らかにしてきました。HSP90は、分子シャペロン※2の1つで、タンパク質の構造形成を助けたり、活性を制御したりすると考えられています。興味深いことに、最近の研究から、動物も同様の免疫センサーを持ち、さらにこの複合体が免疫センサーの制御を担っていることが明らかとなり、動植物が同じシステムを生体防御に用いていることが分かってきました。
今回、研究グループは、RAR1-SGT1-HSP90複合体の形成部位の立体構造を解明しました。得られた立体構造情報を基に解析を行ったところ、RAR1は、SGT1とHSP90に直接結合することで複合体の形成を促進し、免疫センサーとの結合を増強することが分かりました。さらにRAR1は、HSP90のATP分解活性※3を増大させることにより複合体の機能を高めることを発見しました。また、これら3つのタンパク質が複合体を形成することが免疫センサーの働きに必須であることが分かりました。
本研究成果は、米国の科学雑誌『Molecular Cell』(7月30日号)に掲載されます。
背景
植物は、抵抗性タンパク質と呼ばれるさまざまな免疫センサーを持ち、病原体由来の物質を直接的あるいは間接的に認識しています。これまで研究グループが中心となって、免疫センサーの制御に重要な因子としてRAR1、SGT1、HSP90という3つのタンパク質を同定してきました。これらのタンパク質は、互いに結合して複合体を形成し、免疫センサーと結合します。3つのうちどのタンパク質が機能を失っても、免疫センサーの働きが低下し、植物は種々の病原菌に感染しやすくなることが分かっています。しかし、RAR1-SGT1-HSP90複合体がどのような機構で免疫センサーを制御しているのかは不明でした。そこで、研究グループは、この複合体の立体構造解析と生化学、分子生物学的解析を組み合わせた多角的なアプローチにより、機能解析を試みました。
研究手法と成果
(1)RAR1、SGT1、HSP90の各ドメインを用いたX線結晶解析
生化学的手法による詳細な解析の結果、RAR1のCHORD2(Cys-and His-rich domain)ドメイン※4、SGT1のCS(CHORD-containing protein and SGT1)ドメイン、HSP90のN末端ドメインが、複合体の形成に必須の部位であることが分かりました。これらのドメインを共結晶化し、X線結晶解析により、RAR1-SGT1-HSP90複合体の形成部位の立体構造を解明しました(図1)。この結晶は、それぞれのタンパク質を2つずつ含んだ6量体の構造をしており、RAR1のCHORD2ドメインは、SGT1のCSドメインおよびHSP90のN末端ドメインと結合し、さらにCSドメインもHSP90のN末端ドメインと結合することが分かりました。
(2)RAR1によるHSP90のATP分解活性に及ぼす影響実験
立体構造解析によって、RAR1の188番目のHis(ヒスチジン)残基が、HSP90に結合したヌクレオチドと接触することが分かりました。このことから、RAR1は、HSP90のATP分解活性に何らかの影響を与えると予想できました。RAR1の活性を詳細に調べるため、試験管内でHSP90とRAR1を混ぜ、HSP90のATP分解活性を測定した結果、RAR1の濃度に依存して増大することが分かりました。これまでの研究から、HSP90のATP分解活性は、RAR1-SGT1-HSP90複合体の働きに極めて重要であることが分かっており、薬剤処理によりATP分解活性を阻害すると、さまざまな免疫センサーの働きが短時間のうちに低下してしまいます。従って、RAR1は、HSP90のATP分解活性を増大させることで、複合体の機能を高め、免疫センサーの制御を効率化していると考えられます。
(3)RAR1、SGT1、HSP90および免疫センサーの結合実験
RAR1、SGT1、HSP90の結合実験を行ったところ、RAR1は、SGT1とHSP90に直接結合することで複合体の形成を促進し、免疫センサーとの結合を増強することが分かりました。さらに、部位特異的変異導入法※5により、RAR1およびHSP90のアミノ酸に変異を導入して、3つのタンパク質の結合親和性を調べ、それぞれのタンパク質との結合に必須なアミノ酸を同定しました。
(4)SGT1結合能を失ったRAR1変異タンパク質の機能解析
立体構造情報を基にして、部位特異的変異導入により、SGT1と結合できないRAR1変異タンパク質を作製しました。このRAR1変異タンパク質を発現させたタバコ植物では、免疫センサーが機能できず、タバコモザイクウイルスの増殖を抑制できませんでした(図2)。このことから、RAR1、SGT1、HSP90が複合体を形成することが免疫センサーの働きに必須であることが分かりました。
今後の期待
構造を決定した複合体形成部位は、RAR1-SGT1-HSP90複合体の心臓部であり、今回の一連の研究から、複合体の全体像と植物の免疫センサーを制御する仕組みが明らかとなってきました。今後、複合体の機能を増強することで、さまざまな免疫センサーの働きが活性化するような耐病性作物の作出を期待できます。また、動物の免疫センサーの制御にも同じシステムが使われていることから、この複合体の立体構造情報は、ヒトの疾患治療薬の開発にも役立つと考えられます。
発表者
理化学研究所
植物科学研究センター 植物免疫研究グループ
グループディレクター 白須 賢(しらす けん)
Tel: 045-503-9574 / Fax: 045-503-9573
基礎科学特別研究員 門田 康弘(かどた やすひろ)
Tel: 045-503-9444 / Fax: 045-503-9573
お問い合わせ先
横浜研究推進部Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.免疫センサー
ヌクレオチド結合領域とロイシンリッチリピートと呼ばれる特徴的な構造を保持しているタンパク質の一群で、植物では「抵抗性タンパク質」と呼ばれている。植物は、これらの免疫センサーを介して植物病原菌の感染を認識する。動物にも「Nodファミリー」と呼ばれる同様のタンパク質群が存在し、自然免疫において、病原菌の感染の認識に重要な役割を果たしている。 - 2.分子シャペロン
分子シャペロンは、タンパク質の正確な折り畳みを助け、凝集や分解を防ぐだけでなく、タンパク質の活性制御にも関与している。HSP90は、代表的な分子シャペロンの1つで、主にキナーゼ、転写因子、ホルモンセンサーなど、シグナル伝達系に重要な役割を果たす因子と結合することで、立体構造の安定化や活性調節を行う。HSP90の活性や基質タンパク質との結合特異性は、HSP90の結合因子であるコシャペロンにより調節されており、RAR1、SGT1もこのようなコシャペロンの1つと考えられている。 - 3.ATP分解活性
アデノシン三リン酸(ATP)の末端の高エネルギーリン酸結合を加水分解する活性のこと。ATPは生体内のエネルギー通貨であり、ATP分解活性を持つタンパク質はATP分解で得られるエネルギーを原動力にして働く。HSP90の機能にはATP分解が必要不可欠であり、薬剤処理によりHSP90のATP分解活性を阻害すると、さまざまな免疫センサーが機能を失う。 - 4.ドメイン
1つのタンパク質は構造上または機能上、複数の領域に分けることができる場合があり、これらの領域をドメインと呼ぶ。また、異なったタンパク質分子間に広く存在し相同性を持つ領域についてもドメインと呼ぶ。 - 5.部位特異的変異導入法
タンパク質中の任意のアミノ酸をほかのアミノ酸で置換する方法。
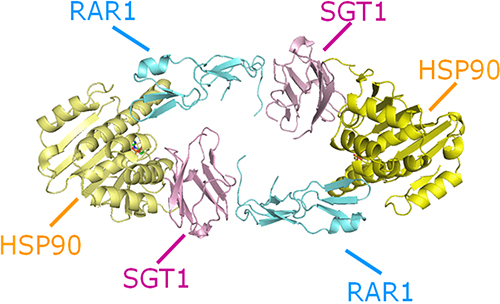
図1 RAR1-SGT1-HSP90複合体形成部位の立体構造
RAR1のCHORD2ドメイン、SGT1のCSドメイン、HSP90のN末端ドメインを用いた共結晶化とX線結晶解析により、RAR1-SGT1-HSP90複合体の形成部位の立体構造を解明した。この結晶が、それぞれのタンパク質を2つずつ含んだ6量体の構造をしていることが分かった。
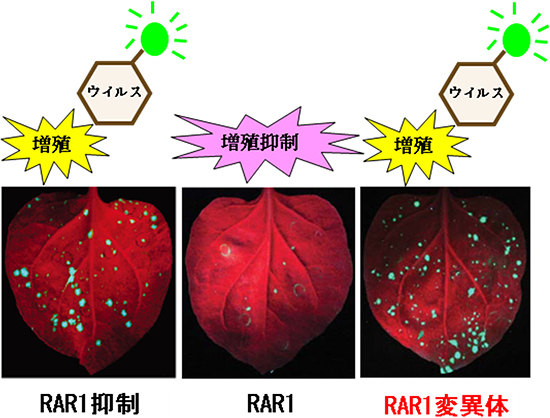
図2 SGT1と結合できないRAR1変異タンパク質は病原体(ウイルス)の増殖を抑制できない
左:RAR1の発現を人為的に抑制させたタバコ植物に、蛍光タンパク質(GFP)を融合したタバコモザイクウイルスを感染させると、植物は防御反応を誘導できずウイルスの増殖を抑制できない。中:RAR1を一過的に発現させると植物は防御反応を誘導できウイルスの増殖は抑えられる。右:SGT1との結合部位に変異を入れたRAR1変異タンパク質を発現させた場合もウイルスの増殖を抑制できない。これらの結果は、SGT1とRAR1が結合し、RAR1-SGT1-HSP90複合体を形成することが免疫センサーの働きに必須であることを示している。
