ポイント
- 遺伝子配列「HS2」と「CGRE」がアレルギー反応に関わる遺伝子座に存在
- 「HS2」に転写因子「GATA-3」が結合し、アレルギー発症がスイッチオン
- 新しい視点に立ったアレルギー治療や予防への応用に期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、アレルギー反応に関わるサイトカイン※1 IL-4※2の遺伝子座に遺伝子配列HS2を発見し、HS2に転写因子GATA-3が結合することでIL-4の発現スイッチが入るという、アレルギー発症のメカニズムを解明しました。これは、理研免疫・アレルギー科学総合研究センター(谷口克センター長)シグナル・ネットワーク研究チームの久保允人チームリーダー(東京理科大学 (藤島昭学長)生命科学研究所 生命工学研究部門 教授)、国立大学法人九州大学(有川節夫学長)呼吸器内科の井上博雅准教授(現、鹿児島大学 教授)および東京都臨床医学総合研究所(田中啓二 所長代行)サイトカインプロジェクトの宮武昌一郎室長らによる共同研究の成果です。
私たちの体には、異物から体を守る「免疫」というシステムが備わっています。この免疫システムは時々、私たちの体に不都合な反応を起こします。その1つが、花粉症などで知られる「アレルギー」です。アレルギー反応は、Th2細胞と呼ばれるヘルパーT細胞※3が引き起こします。ナイーブT細胞※4がアレルギーの基となる花粉などの抗原(アレルゲン)と接するとTh2細胞に分化し、このTh2細胞が司令塔となって、アレルギー反応に関わるさまざまなサイトカインを産生し、一連の免疫反応を制御します。これまでに、サイトカインの1つであるIL-4がナイーブ細胞からTh2細胞への分化に関与し、GATA-3がアレルギーを発症する重要な分子として知られていますが、詳細なアレルギー発症のメカニズムは謎のままでした。
研究グループは、既知の配列HS2とCGREが、それぞれIL-4とIL-13※5の遺伝子座に遺伝子発現を制御する遺伝子配列として存在することを見いだしました。遺伝子改変マウスを用いた解析により、GATA-3がHS2やCGREに結合することで、それぞれIL-4やIL-13の発現スイッチをオンにすることを明らかにしました。この発見により、GATA-3によるサイトカイン遺伝子の発現制御が、私たちの体に備わったアレルギーを発症するメカニズムの本質であることが分かりました。
今回の研究成果は、新しい視点からのアレルギー治療の実現や、根本的予防あるいは個人個人の体質の理解につながると期待されます。
本研究成果は、米国の科学雑誌『Nature Immunology』オンライン版(2010年12月5日付け:日本時間12月6日)に掲載されます。
背景
私たちの体には、侵入してきたウイルスや細菌などの病原体から体を守る「免疫」というシステムが生まれながらにして備わっています。しかし、この免疫システムは時々、私たちの体に不都合な反応を引き起こすことがあります。その1つが、花粉症などで知られる「アレルギー」です。アレルギー反応は、免疫反応の司令塔として働くヘルパーT細胞の一種、Th2細胞が引き起こします。しかし、私たちの体には、ヘルパーT細胞はほとんど存在せず、その前段階の「ナイーブT細胞」が常駐しています。アレルギーを発症する場合、ナイーブT細胞が花粉などの抗原(アレルゲン)と接することでTh2細胞に分化し、Th2細胞がアレルギー反応に関わるIL-4やIL-13などのさまざまなサイトカインを産生し、一連の免疫反応を制御する司令塔として働きます。
これまで、アレルギーを発症する分子として、「GATA-3」という転写因子の存在が知られていました。GATA-3は、遺伝子の発現スイッチをオンにする働きを持つ分子で、Th2細胞の産生に関わります。また、IL-4の発現が、ナイーブT細胞からTh2細胞への分化に関与することも知られています。しかし、GATA-3がどのような仕組みでTh2細胞を産生し、アレルギーを発症するのか、その詳細なメカニズムは謎のままでした。そこで、研究グループは、遺伝子改変マウスを用いてGATA-3によるアレルギー発症のメカニズムの解明に取り組みました。
研究手法と成果
研究グループは、相同組み換えの技術により、マウスゲノムからさまざまな非転写領域を欠失させた遺伝子改変マウスを作製しました。マウスゲノムの解析から、アレルギー反応に関わるサイトカインIL-4とIL-13の遺伝子座の中に、遺伝子発現を制御する遺伝子配列として知られるHS2とCGREがそれぞれ存在することを見いだしました。
そこで、HS2とCGREがそれぞれ、サイトカインIL-4とIL-13の発現に関与するかどうかを調べるために、HS2あるいはCGREを欠失した遺伝子改変マウスを解析しました。具体的には、GATA-3の結合と、遺伝子発現活性の指標であるヒストンのアセチル化※6について、時空間的な変化を観察しました。その結果、HS2あるいはCGREを欠失したマウスのゲノムでは、それぞれIL-4あるいはIL-13遺伝子座におけるGATA-3の結合が見られず、同時に、ヒストンのアセチル化も起こりませんでした(図1)。また、それぞれIL-4、IL-13の発現も見られませんでした。このことから、GATA-3がHS2あるいはCGRE領域に結合することにより、それぞれIL-4、IL-13遺伝子の発現が開始することが分かりました。特に、IL-4の発現を制御するHS2へのGATA-3の結合は、ナイーブT細胞からTh2に分化する運命を決定付けています。GATA-3が結合せず、IL-4の発現スイッチが入らないナイーブT細胞では、別の方向への運命付けがなされます。
この発見は、GATA-3によるサイトカイン遺伝子の発現制御が、私たちの体に備わったアレルギーを発症するメカニズムの本質であることを示しました。さらに、ナイーブT細胞がTh2細胞に分化するために必要と考えられていた抗原刺激の仕組みについても、新たな視点を与えてくれました。具体的には、アレルギーを引き起こす抗原がナイーブT細胞を刺激することで、ナイーブT細胞のクロマチン構造※7がほどけ、それによってGATA-3がHS2やCGREなどの標的となる遺伝子配列に結合しやすい状況が作られると考えられます(図2)。
今後の期待
現代社会において、アレルギーは日常生活に支障を与え、生活環境を見直す必要が生じるほどの、非常に大きな社会問題を引き起こしています。今回の成果により、アレルギー発症のメカニズムが明らかとなり、今後、新しい視点からのアレルギー治療の実現や、根本的予防あるいは個人個人の体質の理解につながると期待されます。
発表者
理化学研究所
免疫・アレルギー科学総合研究センター
シグナル・ネットワーク研究チーム
チームリーダー 久保 允人(くぼ まさと)
Tel: 045-503-7047 / Fax: 045-503-7046
お問い合わせ先
横浜研究推進部 企画課Tel: 045-503-9113 / Fax: 045-503-9117
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.サイトカイン
細胞同士の情報伝達に関わるさまざまな生理活性を持つ可溶性タンパク質の総称。 - 2.IL-4
インターロイキン-4。アレルギーに関与するヘルパーT細胞(Th2)を産生するサイトカイン。IL-4はIgE抗体の産生を誘導するために必須のサイトカインで、Th2細胞を増加させるなど、免疫のバランスを、アレルギーを起こしやすい方向へシフトさせる。 - 3.ヘルパーT細胞
免疫応答に関与するリンパ球「T細胞」の1つ。アレルゲンの情報をB細胞へ伝え、アレルギー抗体の産生を誘導する。 - 4.ナイーブT細胞
ヘルパーT細胞の前駆細胞。感染など抗原刺激を受けていない状態では、血液中に存在するT細胞のほとんどが、このステージにいる。 - 5.IL-13
インターロイキン-13。IL-4同様アレルギーに関与するヘルパーT細胞(Th2)を産生するサイトカインの1つ。喘息などで、気道におけるアレルギーの病態を直接コントロールする。 - 6.ヒストンのアセチル化
クロマチン構造( ※7参照)を構成する一部のヒストンタンパク質がアセチル化すると、電位が変化し、結合が緩やかになる。従って、特定のヒストンがアセチル化されるということは、その部分が活性化された状態であることを示し、その部分に転写因子を結合しやすくする。 - 7.クロマチン構造
細胞中に存在するDNAはヒストンタンパク質の複合体に巻きつくような構造をとることにより、最小単位であるクロモゾーム構造をとっている。このクロモゾーム構造の集合体をクロマチン構造と呼ぶ。
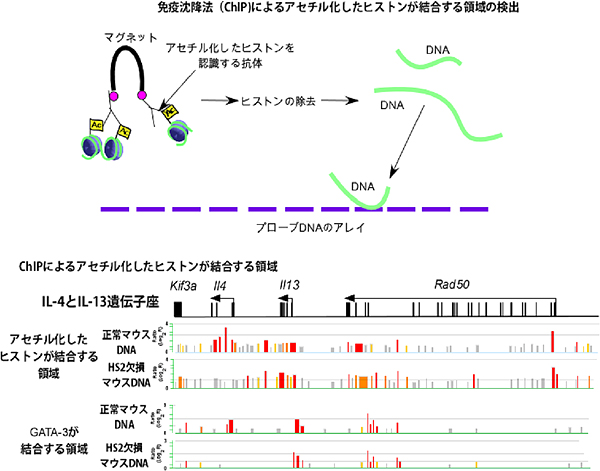
図1 免疫沈降法を用いたアセチル化したヒストンに結合するDNA領域とGATA-3が結合するDNA領域の検出
上:アセチル化したヒストンを認識する抗体を使うことにより、アセチル化したヒストンに結合した領域を含むDNAを免疫沈降させる。タンパク質除去によりDNAだけを集め、IL-4とIL-13遺伝子座をコードするDNAをプローブとしたアレイと反応させることにより、アセチル化したヒストンが結合する領域を同定する。
下:HS2を欠失させたマウスにおけるアセチル化したヒストンが結合している領域とGATA-3が結合する領域。赤で示した領域が結合しているDNA領域。HS2を欠失させたマウスでは、IL-4、IL-13遺伝子座だけがアセチル化したヒストンもGATA-3も結合できなくなる。
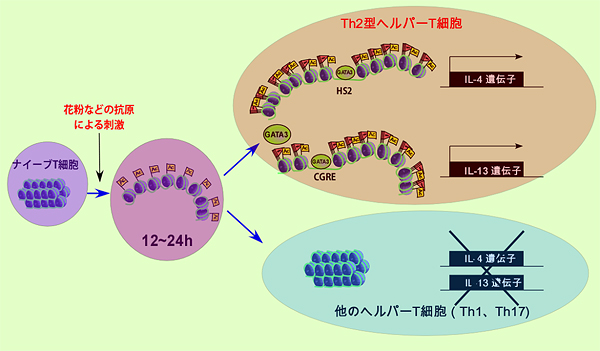
図2 ナイーブT細胞がヘルパーT細胞へと運命付けがなされる分子メカニズム
ナイーブT細胞ではたくさんの遺伝子座を含むクロマチンが凝集された状態にあり、抗原で刺激されるとヒストンのアセチル化が起こり、クロマチン構造がほどける。そこにGATA-3が存在すると、クロマチンに結合できるようになる。この時GATA-3が、遺伝子配列HS2に結合すると、サイトカイン遺伝子IL-4の発現スイッチがオンになり、Th2に分化する。さらに、GATA-3がHS2やCGREに結合することで、IL-4やIL-13が発現する。GATA-3が結合できないとクロマチン構造はまた凝縮した構造に戻ってしまい、サイトカイン遺伝子の発現スイッチが入らない状態になる。
