2011年2月25日
独立行政法人 理化学研究所
膜タンパク質の性状を簡便かつ迅速に解析できる手法の開発に成功
-膜タンパク質解析の最大のハードル「試料調製条件確立」の有効なツールに-
ポイント
- 従来手間と時間がかかった膜タンパク質性状解析のハイスループット化を実現
- ジオクチルスルホコハク酸で、構造を保ったまま高分解能に電気泳動分離
- 立体構造解析を含む膜タンパク質研究の有効なツールとして期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、膜タンパク質の構造解析に欠かせない試料や試料調製条件を、ハイスループットでスクリーニングすることができる新たな電気泳動法「FN-PAGE(Fluorescence-detectable Native PAGE)法」を開発しました。これは、理研放射光科学総合研究センター(石川哲也センター長)構造生理学研究グループ分子シグナリング研究チームの山下敦子チームリーダー、伊原誠研究員、松浦紀子リサーチアシスタントによる成果です。
膜タンパク質は、細胞膜などの生体膜中に埋め込まれたタンパク質で、生物が持つタンパク質の約30%の種類を占め、多くの重要な生命機能を担っています。また、医薬の標的分子となっているものも多く、市販の医薬品の約半数が膜タンパク質をターゲットにしています。生命機能の理解や、標的分子だけに作用する薬の効率的な設計のためには、膜タンパク質の立体構造情報を得ることが非常に重要です。しかし膜タンパク質は、構造解析のための試料を調製する際に生理的な構造が壊れやすいため、現状では構造解析が進んでいません。
研究チームは、調製した膜タンパク質試料が正しい構造を保持しているかどうかなどの性状解析をハイスループットで行う方法として、Native PAGE法※1に着目し、その条件を探索しました。その結果、スルホコハク酸系陰イオン界面活性剤の一種であるジオクチルスルホコハク酸を電気泳動試薬として用いることで、膜タンパク質の構造を保ち、シャープな電気泳動バンドを示す良好な電気泳動分離ができる条件を見いだすことに成功しました。また、この方法は、GFP(蛍光タンパク質)とつないだ膜タンパク質を用いると、GFP由来の蛍光を検出することができるため、多くの試料を精製することなく迅速に性状解析することが可能となり、SPring-8を利用したX線結晶構造解析をはじめとする構造解析のための試料や試料調製条件のハイスループットスクリーニングに有効であることが分かりました。研究チームが確立したこの方法は、立体構造解析だけでなく、広く膜タンパク質研究を推し進めるものとして期待されます。
本研究成果は、わが国で推進している「ターゲットタンパク研究プログラム」の一環として行ったもので、米国の科学雑誌『Analytical Biochemistry』に近く掲載されます。
背景
膜タンパク質は、細胞を包む細胞膜などのさまざまな生体膜に埋め込まれた状態で存在するタンパク質で、膜を介した情報伝達・物質輸送・エネルギー変換など多くの重要な生命機能を担っています。このため、その機能を理解することは生命科学にとって重要な課題となっており、膜タンパク質の立体構造の解明が強く求められています。また、医薬の標的分子となっているものも多く、膜タンパク質の立体構造の情報は新薬開発に役立つと期待されています。
しかし膜タンパク質の立体構造解析は、他のタンパク質と比べて大きく遅れています。生物のゲノムに記録されている遺伝子の約30%が膜タンパク質をコードしていると考えられているにも関わらず、タンパク質構造データベースであるProtein Data Bank※2に登録されている情報のうち、膜タンパク質の立体構造情報はわずか1%程度に過ぎません。この最大の原因は、膜タンパク質の構造解析を行うための試料調製が極めて難しいことです。
タンパク質構造解析では、第一段階として、まず精製したタンパク質を多量に用意する必要があります。天然の状態で多量に存在する場合を除き、通常は大腸菌や各種の培養細胞などに遺伝子を導入して目的のタンパク質を大量生産しますが、膜タンパク質の場合は、折り畳み、膜への挿入および目的の生体膜への移行が適切に起こらないケースが多く見られます。また、目的タンパク質を精製するには、界面活性剤を使って生体膜から抽出する作業が必要ですが、このときに構造が壊れてしまうことも多くあります。そこで、多くの解析候補タンパク質や試料生産条件の中から、正しい構造を保持したタンパク質とその生産条件をスクリーニングする必要があります。実際、膜タンパク質構造研究の多くの時間がこの条件検討に費やされており、研究全体の最大のハードルとなっています。
近年、この解析候補タンパク質や試料生産条件のスクリーニングを推し進める方法の1つとして、蛍光検出ゲルろ過クロマトグラフィー法※3(Fluorescence-detection size-exclusion chromatography:FSEC)が開発されました。これは、目的タンパク質をGFPなどの蛍光タンパク質とつないだ条件で発現させ、ゲルろ過クロマトグラフィーを行って分子量分析を行う方法です。目的タンパク質だけが蛍光ラベルされるため、ゲルろ過クロマトグラフィーの結果を蛍光検出することで、各種細胞で生産した目的タンパク質が正しい構造を保持しているかどうかなどの性状解析を、試料を精製することなく行うことができます。しかし、この方法では、液体クロマトグラフィー装置を用いて1試料ずつ解析を行う必要があるため、多くの条件を一度にスクリーニングするには限界がありました。
研究手法と成果
研究チームは、膜タンパク質試料の性状解析を行う方法として、タンパク質を変性させずに生理的構造を保ったまま電気泳動分離を行うNative PAGE法に着目しました。Native PAGE法を用いると、一度の実験で多数の試料を同時に解析でき、ゲルろ過クロマトグラフィー法よりもハイスループットにスクリーニングを行うことができます。しかし、従来のNative PAGE法では、試料タンパク質の持つ電荷が電気泳動に影響するため、ゲルろ過クロマトグラフィーのように正確に分子量に従った分離ができないとともに、その分解能も悪いという欠点がありました(図1)。
研究チームは、タンパク質の電荷を打ち消すため、膜タンパク質の可溶化によく用いられる界面活性剤ドデシルマルトシドに少量の陰イオン界面活性剤を混ぜた混合ミセルを電気泳動用試薬に用いました。各種の陰イオン界面活性剤を試した結果、ジオクチルスルホコハク酸(ドキュセート)を利用した条件で、膜タンパク質の構造を保ったまま、ゲルろ過クロマトグラフィーと同様に、試料タンパク質の分子量に従った良好な電気泳動分離ができることを見いだしました。ジオクチルスルホコハク酸は、スルホコハク酸系陰イオン界面活性剤の一種で、緩下剤(便秘薬)としても利用されており、生体膜の主要な構成成分であるグリセロリン脂質と類似した化学構造を有しています(図2)。
さらに、ジオクチルスルホコハク酸含有の混合ミセルが無色透明なため、この電気泳動法では、試料の電気泳動バンドを蛍光検出することが可能です。例えばGFPとつないだ試料を用いた場合、GFP由来の蛍光を検出することで、FSECと同じく未精製試料の性状解析をすることができます。FN-PAGE(Fluorescence-detectable Native PAGE)と名付けたこの電気泳動法を用いて、可溶化に用いる界面活性剤の違いによる膜タンパク質の構造の壊れ方の違いを検出したところ、FSECの検出結果とよく一致しました。また、これまでに結晶構造解析が成功している性状の良い膜タンパク質と、試料を不安定化する条件下においた性状の悪い膜タンパク質の検出結果を比較すると、前者はシャープな電気泳動バンドとして、後者は幅広く広がった電気泳動バンドとして観察することができました。つまり、FN-PAGEの電気泳動結果から、膜タンパク質の性状の良否や正常な構造を保っているかどうかを判定できることが分かりました(図3)。
今後の期待
膜タンパク質試料が正常な構造を保っているかどうかは、構造解析の試料としてだけではなく、機能解析に用いる試料としても重要な要素です。今回開発した方法は、GFPと結合させた目的タンパク質を蛍光検出する未精製試料の解析も、従来法のように色素染色で検出する精製試料の解析もいずれも可能で、膜タンパク質研究のための一般的な方法として有用であると考えられます。また本手法は、結晶構造解析に成功した試料と結晶化ができていない試料を、泳動パターンの違いとして検出できることから、SPring-8などの放射光施設におけるX線結晶構造解析をはじめとした構造解析の試料スクリーニングをハイスループット化し、膜タンパク質研究の最大のハードルである正常なタンパク質試料の調製条件や、結晶化に適した試料のスクリーニングに非常に有用な手法となります。さらに、泳動条件をキャピラリー電気泳動法やミクロ流路電気泳動法などに応用することができると、より一層の自動化、サンプルの少量化、解析のスピードアップが期待できます。
発表者
理化学研究所
放射光科学総合研究センター 構造生理学研究グループ
分子シグナリング研究チーム
チームリーダー 山下 敦子(やました あつこ)
Tel: 0791-58-1823 / Fax: 0791-58-1879
お問い合わせ先
播磨研究所 研究推進部 企画課
Tel: 0791-58-0900 / Fax: 0791-58-0800
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.Native PAGE法
ポリアクリルアミドゲル電気泳動法(PAGE)のうち、未変性(生理構造を保った状態)のタンパク質をそのまま泳動する方法。タンパク質の分子量のほか、タンパク質の形状や表面電荷などによってゲル中での泳動が影響されるため、従来の方法では必ずしも分子量に従った分離ができないケースが見られた。 - 2.Protein Data Bank
タンパク質と核酸の立体構造情報を蓄積する国際データベース。無償で公開されている。2011年2月22日現在で、70,000以上のタンパク質構造データが蓄積されている。 - 3.蛍光検出ゲルろ過クロマトグラフィー法
Fluorescence-detection size-exclusion chromatography(FSEC)。物質の大きさ・吸着力・電荷・疎水性などの違いを利用して物質を分離、精製する手法をクロマトグラフィーと呼ぶ。このうち、試料を、網目構造を持つゲル粒子に通し、物質(タンパク質分子など)の大きさの違いによってふるい分けることで分離する方法をゲルろ過クロマトグラフィーと呼ぶ。FSECでは、対象となるタンパク質を蛍光タンパク質と融合させ、ゲルろ過クロマトグラフィーの結果を蛍光で検出することで、他のタンパク質と混じり合った未精製の状態でも、目的タンパク質の分子量(大きさ)情報を得ることができる。
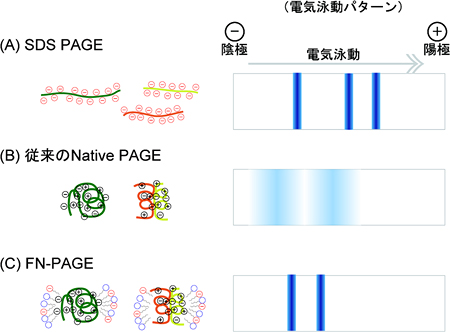
図1 各種の電気泳動法の模式図
- (A)
SDS-PAGE
タンパク質をSDS(ドデシル硫酸ナトリウム)で変性させ、電気泳動分離を行う方法。タンパク質が持つ本来の電荷をSDSが打ち消すことで、タンパク質の分子量に従った移動度を持つシャープな電気泳動バンドが得られるが、生理的構造を保った状態の分子量情報を得ることができない。 - (B)
従来のNative PAGE
SDSのような変性剤を入れずに、タンパク質の生理的構造を保った状態で電気泳動する方法。電気泳動がタンパク質の電荷に影響されるため、幅広く広がった電気泳動バンドになり、分子量に従った移動度とならないことも多い。 - (C)
今回開発したFN-PAGE
タンパク質の生理的構造を保ったまま電気泳動するが、泳動中に入れる陰イオン界面活性剤ジオクチルスルホコハク酸によって、タンパク質の電荷が打ち消され、シャープな電気泳動バンドが得られる。また、分子量に従った移動度を示すため、生理的構造を保った状態での分子量情報を得ることができる。
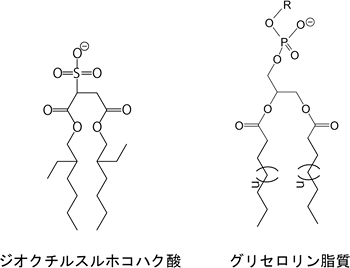
図2 ジオクチルスルホコハク酸と生体膜の主要な構成成分であるグリセロリン脂質の化学構造
グリセロリン脂質の化学構造のうち、Rはコリン、エタノールアミン、セリン、イノシトールなどであり、nは通常10または12程度(脂肪酸の炭素鎖数で16または18程度で、不飽和結合を持つ場合もある)である。極性頭部(ジオクチルスルホコハク酸の場合は硫酸基、グリセロリン脂質の場合は各種のリン酸アルコール基)及び2本の疎水性尾部を持つという共通点が見られる。
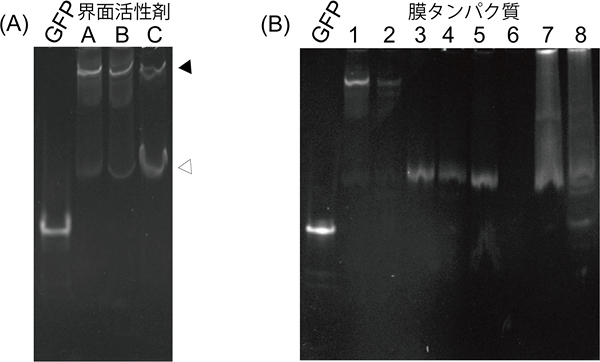
図3 FN-PAGEでの解析例
- (A)
三量体膜タンパク質のGFP融合体をFN-PAGEで解析したもの
可溶化する界面活性剤によって、生理的な構造である三量体(黒三角印)が壊れ、単量体(白三角印)が生成している様子が観察できる。この膜タンパク質の場合、界面活性剤A、Bにくらべ、界面活性剤Cを用いた方が単量体比率は高くなっており、試料タンパク質が不安定になる条件であることが分かる。 - (B)
各種膜タンパク質のGFP融合体をFN-PAGEで解析したもの
これまでに結晶構造解析に成功している性状の良い膜タンパク質(1-4)はシャープなバンドを示す。一方、結晶化に成功していない膜タンパク質(5-8)では、良好な発現が得られず電気泳動バンドが観察されないもの(6)、幅広く広がった電気泳動バンドが観察されるもの(7、8)など、性状の良否を泳動パターンの違いとして検出することができる。
