2011年4月29日
独立行政法人 理化学研究所
植物が有害DNAからゲノムを保護するメカニズムを解明
-シロイヌナズナで有害DNAを不活性化する直接作用が明らかに-
ポイント
- エピジェネティックな制御因子HDA6の機能損失が有害DNAを活性化
- 有害DNAの抑制にはヒストン脱アセチル化とDNAメチル化が協調的に作用
- 農作物のウイルス感染被害やヒトのがん化メカニズムの解明に期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、植物のゲノム中に入り込んだトランスポゾン※1などの有害なDNA配列の抑制・不活性化に、エピジェネティック※2な制御因子であるヒストン脱アセチル化酵素※3HDA6が直接作用するメカニズムをシロイヌナズナ※4で解明しました。これは、理研植物科学研究センター(篠崎一雄センター長)植物ゲノム発現研究チームの関 原明チームリーダー、金 鍾明研究員、藤 泰子研修生と、生命情報基盤研究部門(豊田哲郎部門長)らによる共同研究の成果です。
植物をはじめとする真核生物※5の遺伝子発現抑制には、エピジェネティックな化学修飾であるヒストン修飾※6とDNAメチル化※7が関与することが知られています。しかし、ヒストン修飾やDNAメチル化がどのように連携しながら遺伝子発現を抑制したり、トランスポゾンなどの有害DNAを抑制・不活性化したりするのか、詳細なメカニズムは分かっていません。また、有害DNAの活性化は、植物のゲノムを不安定化させ、個体発生不全を引き起こすだけでなく、ヒトのがん化メカニズムにも関わることから、これら有害DNAの抑制メカニズムの解明は農学、医薬学の面からも注目されていました。
研究チームはこれまで、モデル植物のシロイヌナズナを用いて、ヒストン脱アセチル化酵素HDA6の生理学的な機能に着目し解析を進めてきました。今回、HDA6によるヒストンの脱アセチル化を介して、直接不活性化するトランスポゾンを含む特定の遺伝子領域を決定しました。また、これら領域の不活性化には、HDA6とDNAメチル化酵素MET1が協調的に作用することを見いだし、植物ゲノム中のこれら有害DNAの抑制にはいずれも必須であることを明らかにしました。
この成果は、植物が有害DNAからゲノムを保護するメカニズムを、シロイヌナズナを用いた遺伝学的、生化学的解析法によって明らかにしたものです。農作物のウイルス感染被害や、ヒトのがん化メカニズムの解明につながると期待できます。
本研究成果は、米国のオンライン科学雑誌『PLoS Genetics』(4月28日付:日本時間4月29日)に掲載されます。
背景
ヒトや植物など真核生物のゲノムには、通常の生育時に使用されることがない遺伝子が多数含まれています。また、トランスポゾンと呼ばれるDNAの反復配列が多く挿入されており、これら不要な遺伝子やトランスポゾンの異常な活性化によって、発生異常やがん、個体死などを引き起こすことが知られています。真核生物のゲノムは、こうした異常に対抗するため、エピジェネティックな化学修飾であるヒストン修飾とDNAメチル化を用いて、遺伝子発現を抑制したり有害DNAを抑制・不活性化したりするメカニズムを持っていると考えられています。これまでの研究から、モデル植物のシロイヌナズナでは、DNAメチル化酵素MET1がなくなると、ゲノム全体である種のDNAメチル化が消失し、トランスポゾンの再活性化を誘発して、植物の形態異常や個体死を引き起こすことが報告されています。また、ゲノムDNAを効率よく収納したり、不要な遺伝子を折り畳んで、しまい込んだりするために機能すると考えられているヒストン脱アセチル化酵素HDA6の機能を失った場合も、同じようにトランスポゾンの再活性化が起こることが知られていました。しかし、これらがどのように連携しながら、遺伝子発現の抑制やトランスポゾンなどの有害DNAの抑制・不活性化に機能しているのか、その詳細なメカニズムは分かっていませんでした。
研究手法と成果
クロマチン免疫沈降法※8は、タンパク質に対する特異的抗体を用いてDNAとタンパク質の相互作用(結合)を研究する方法の1つで、遺伝子発現調節やクロマチン※9動態などの研究を進める上で非常に有効な方法となっています(図1)。そこで、研究チームは、シロイヌナズナに最適化した独自のクロマチン免疫沈降法を用いて、HDA6タンパク質が直接結合するいくつかの遺伝子領域を探し出しました。また、これら遺伝子領域でのHDA6タンパク質の機能を詳細に調べるため、HDA6遺伝子破壊株などを材料にして、遺伝学や生化学の手法を用いた解析を行いました。
(1)HDA6の機能を欠損させた植物体は、有害DNAの抑制が外れる
HDA6遺伝子を破壊したシロイヌナズナと野生型シロイヌナズナをそれぞれ寒天培地上で2週間生育し、ゲノム全体の発現パターンの違いを比較しました。その結果、157個の遺伝子領域で、HDA6遺伝子の破壊に依存した発現の誘導が見られました。これら領域のうち81個は、多数のトランスポゾンや機能未知遺伝子を含む既知の遺伝子配列で、残り76個は、新規のRNA転写領域であることが分かりました。また、既知の遺伝子配列の6割の領域(47個)は、MET1遺伝子の破壊株を用いて行った同様の実験結果と良く合致しており、HDA6とMET1によるトランスポゾンなどの有害DNAの抑制は、共通した標的領域を持つこと強く示すものでした。すなわち、有害DNAの抑制には、ヒストン修飾とDNAメチル化とが協調しながら作用することを示唆しています(図2)。
(2)HDA6が植物のトランスポゾンに直接結合し発現抑制に機能する
次に、HDA6タンパク質に特異的な抗体を用いて、クロマチン免疫沈降実験を行い、標的と考えられる領域にHDA6が直接結合するかどうか確かめました。その結果、81個の既知遺伝子配列のいくつかに、HDA6が直接結合していることが分かりました(図3)。同じ方法を使って、遺伝子の活性化や抑制化に関わるクロマチン上の目印であるヒストン修飾の変化を調べたところ、HDA6遺伝子を破壊したシロイヌナズナでは、HDA6が直接結合することが分かった領域上で、クロマチンの活性化を示すヒストン修飾が多く蓄積していることが判明しました(図4)。また、HDA6が直接作用すると考えられるヒストン修飾の種類の同定にも成功しました。これらの結果から、HDA6は特定のヒストン修飾を変化させることでトランスポゾンなどの有害なDNA領域を不活性化させていることが明らかとなりました。これは、HDA6タンパク質の標的領域への直接結合と酵素活性を同定した世界で初めての成果となります。
(3)有害DNAの抑制にはヒストン脱アセチル化とDNAメチル化が協調的に作用する
さらに、トランスポゾンなどの有害DNAの抑制に機能するHDA6とMET1の関係を明らかにするため、MET1遺伝子を破壊したシロイヌナズナでのHDA6のトランスポゾンへの結合を調べました。その結果、MET1非存在下のHDA6は、その標的領域上に結合できなくなることが分かりました(図5)。一方、HDA6遺伝子を破壊したシロイヌナズナでは、同じ標的領域上でMET1に依存するDNAのメチル化が検出できなくなることから、MET1のDNAメチル化酵素活性にはHDA6が不可欠であることが判明しました(図6)。これらの結果から、HDA6によるヒストン修飾の脱アセチル化とMET1によるDNAのメチル化が協調的に作用して、抑制機能を発揮することが明らかとなりました。これら酵素によるエピジェネティックな化学修飾は、多段階からなるトランスポゾンなどの有害DNA領域の抑制・不活性化の初期過程であり、植物のゲノム安定化のための基盤構築に不可欠であることが分かりました(図7)。
今後の期待
今回の成果は、植物がエピジェネティックな化学修飾によって有害DNAからゲノムを保護するメカニズムを、シロイヌナズナを用いた遺伝学的、生化学的解析法によって明らかにしたものです。植物のトランスポゾン抑制メカニズムを詳細に解析したことで、植物のゲノム保全機構のメカニズムの一端を解明したことになります。また、エピジェネティックな化学修飾は、ヒトのがん抑制に作用することが知られていますが、脱アセチル化酵素遺伝子が破壊されるとヒト細胞は致死になってしまうため、ヒト細胞を用いた有害DNA抑制のメカニズム解明は容易ではありません。本研究成果を出発点として、農作物のウイルス感染被害やヒトのがん化メカニズムの解明につながることが期待でき、ストレス耐性作物の作出など多様な応用・利用に貢献することを目指していきます。
発表者
理化学研究所
植物科学研究センター 植物ゲノム発現研究チーム
チームリーダー 関 原明(せき もとあき)
研究員 金 鍾明(きむ じょんみょん)
研修生 藤 泰子(とう たいこ)
Tel: 045-503-9587 / Fax: 045-503-9584
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.トランンスポゾン
転移などによりゲノム上を移動することができる塩基配列。トランスポゾンの転移と増幅により生じる、ゲノムのDNA配列の変化は、生物ゲノムの多様性を生み出す一因と考えられているが、トランスポゾンの異常な転移、増幅はゲノムの不安定化を招き、個体発生異常や細胞のがん化などを引き起こすことが知られている。 - 2.エピジェネティック(ス)
DNA配列の変化を伴うことなく、後天的なクロマチンへの修飾やDNAへの作用により遺伝子発現が制御されることに起因する遺伝学または分子生物学の研究分野。DNAのメチル化や、ヒストンタンパク質のアセチル化、メチル化などが、後天的な修飾として作用している。 - 3.ヒストン脱アセチル化酵素
ヒストンタンパク質に生じた化学修飾であるアセチル化を取り除くために機能する酵素。主に遺伝子の不活性化や、ゲノム高次立体構造の構築に関与することが知られている。 - 4.シロイヌナズナ
学名は Arabidopsis thaliana (L.) Heynh.。全長約30~40cmのアブラナ科一年生草本植物。北半球のほぼ全域の冷温帯にかけて広く分布している。自家和合性を持ち、基本的に自家受粉で次世代の種子を作るが、人工交配による他家受粉も可能である。通常、秋に発芽して冬を越した後、春から夏にかけて日が長くなると花が咲く長日植物である。広大な圃場を必要とせず、実験室内の蛍光灯で育成可能である。実験室内では約2カ月で次世代の種子をつける。2倍体で、5対の染色体を持つ。ゲノムプロジェクトなどにより、ゲノムサイズは約1.3億塩基対、全遺伝子数は約30,000個であることが判明している。 - 5.真核生物
動物、植物、菌類、原生生物など、個体を構成する細胞の中に細胞核と呼ばれる構造を有する生物のこと。 - 6.ヒストン修飾
ヒストンはDNAと高い親和性を示す強い塩基性のタンパク質である。主にH2A、H2B、H3、H4と呼ばれる4種類のヒストンが、それぞれ2分子ずつ集まって球状のヒストン8量体を形成し、この周りに、約150塩基対のDNAが巻きついて、クロマチン構造の最小単位であるヌクレオソームを形成する。ヌクレオソームからは、各ヒストンのアミノ末端領域が突出している。このアミノ末端上の特定アミノ酸残基がアセチル化やメチル化などの化学修飾を受けることで、クロマチン構造が弛緩、凝集して遺伝子発現調節に関与している。シロイヌナズナのヒストンH3アミノ末端領域には、5カ所のアセチル化(H3K9ac、H3K14ac、H3K18ac、H3K23ac、H3K27ac)と3カ所のメチル化(H3K4me、H3K9me、H3K27me)を受けるリジン残基がある。 - 7.DNAメチル化
DNAを構成する4つのデオキシリボ核酸(アデニン、チミン、シトシン、グアニン)のうち、シトシン塩基に付加される化学修飾で、遺伝子活性化抑制のための目印になると考えられている。 - 8.クロマチン免疫沈降法
タンパク質に対する特異的抗体を用いて、DNAとタンパク質の相互作用(結合)を研究する方法の1つ。クロマチン状態と相関するヒストンの化学修飾を検出できるだけでなく、さまざまなDNA結合性転写因子や非結合性タンパク質のクロマチン上での局在を解析するためにも用いられ、遺伝子発現調節、クロマチン構造変換などの研究を進める上で不可欠な方法。 - 9.クロマチン
真核細胞の核内に存在するDNAとタンパク質の複合体。基本的にはDNAがヒストン8量体に巻きついたDNA-ヒストン複合体を形成しており、これをヌクレオソームと呼ぶ。こうした構造がリンカー部分を含む150~200塩基対の周期で繰り返され、ビーズ状につながり、さらにこのヌクレオソーム繊維が折り畳まれ、直径30nmのクロマチン繊維(30nmファイバー)を形成する。
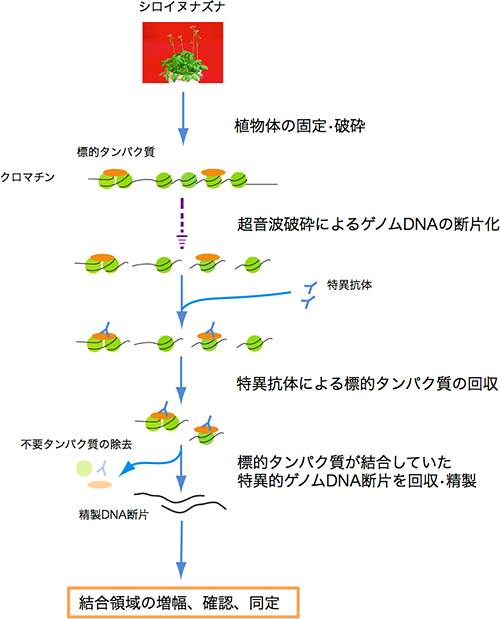
図1 クロマチン免疫沈降法
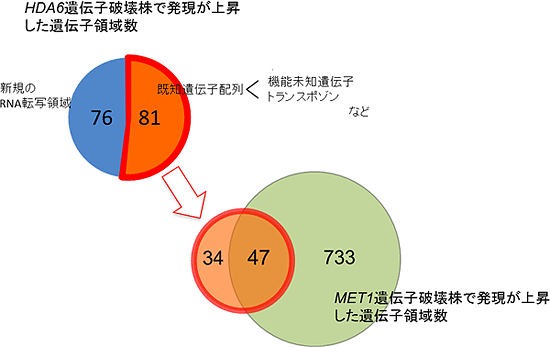
図2 HDA6遺伝子破壊によって影響を受ける遺伝子群
HDA6遺伝子及びMET1遺伝子をそれぞれ破壊したシロイヌナズナ植物体を寒天培地上で2週間生育させ、タイリングアレイを用いて遺伝子発現パターンの変化を解析し、影響を受ける遺伝子群を同定した。その結果、シロイヌナズナのゲノム中には少なくとも157個の遺伝子または新規転写単位と考えられる領域がHDA6によって大きく影響を受けていた。これらのおよそ半分は機能未知遺伝子またはトランスポゾン配列を含む既知遺伝子配列であった。またこのうち、およそ6割の領域はMET1遺伝子により影響を受けることが明らかとなった。このことから、トランスポゾンなどの抑制には、HDA6によるヒストン修飾とMET1によるDNAメチル化が協調しながら作用することが示唆できた。
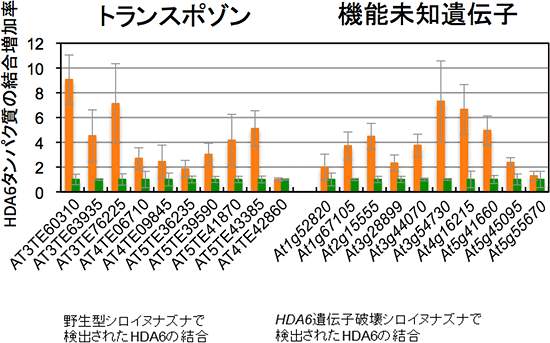
図3 HDA6の直接的な結合活性の同定
HDA6タンパク質に対する特異抗体を用いたクロマチン免疫沈降法を用いて、標的領域上におけるHDA6タンパク質の結合活性を検出した。HDA6タンパク質の結合増加量は、活性型のHDA6タンパク質が存在しないHDA6遺伝子破壊シロイヌナズナでのHDA6結合量に対する比率で算出した。また、図中のAT4TE42860及びAt5g55670領域は、HDA6の結合が見られない場合を示す。発現パターン変化の解析結果から、抽出した標的領域のうち、いくつかのトランスポゾン及び機能未知遺伝子に対して、HDA6タンパク質の直接的な結合が確認できた。
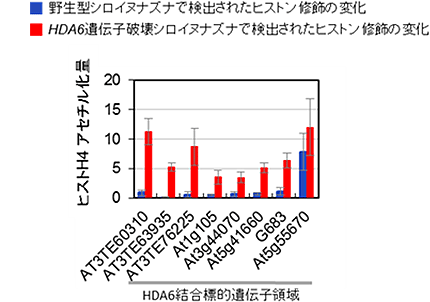
図4 HDA6遺伝子の破壊による抑制の解除
ヒストンH4アセチル化に対する特異抗体を用いたクロマチン免疫沈降法を用いて、標的領域上におけるヒストンアセチル化量を検出した。ヒストンアセチル化量は、アクチン遺伝子領域で検出されるヒストンアセチル化量に対する比率で算出した。また、図中のAt5g55670領域は、ヒストンアセチル化量の変動が見られない場合を示す。HDA6遺伝子破壊シロイヌナズナ植物体では、HDA6タンパク質の直接標的領域上で、遺伝子活性化のマーカーとなるヒストンH4のアセチル化量の上昇が確認できた。これは、HDA6遺伝子の欠損により、野生型株で抑制されているHDA6の標的領域の抑制が解除、活性化することを示す。
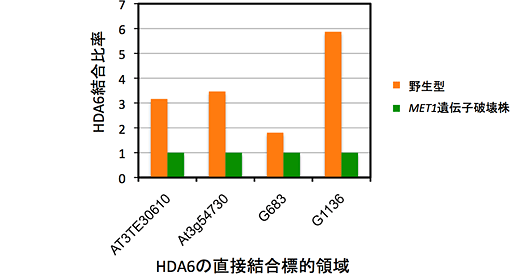
図5 MET1遺伝子破壊株中でのHDA6結合量の低下
HDA6タンパク質に対する特異抗体を用いたクロマチン免疫沈降法を用いて、MET1遺伝子破壊株中でのHDA6標的領域上におけるHDA6タンパク質の結合活性を検出した。発現パターン変化の解析結果から抽出した標的領域のうち、いくつかのトランスポゾン及び機能未知遺伝子に対して、HDA6タンパク質の結合低下が確認できた。このことから、MET1はHDA6の標的領域上への結合に必須であることが明らかとなり、これら2つのタンパク質が協調してシロイヌナズナの遺伝子抑制に機能することが分かった。
HDA6遺伝子破壊株におけるHDA6標的領域上での、MET1機能に依存的なDNAのメチル化量をバイサルファイトシーケンス法により検出した結果の一例。HDA6遺伝子破壊株中で、機能未知遺伝子At5g41660及びトランスポゾンAT3TE76225のそれぞれの領域上のDNAメチル化が完全に消失していることが明らかとなった。このことはMET1のDNAメチル化機能またはMET1自体の結合に、HDA6が不可欠であることを示している。
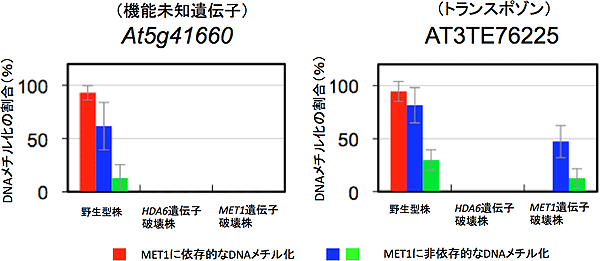
図6 HDA6遺伝子破壊株中でのMET1依存的なDNAメチル化量の検出
HDA6遺伝子破壊株におけるHDA6標的領域上での、MET1機能に依存的なDNAのメチル化量をバイサルファイトシーケンス法により検出した結果の一例。HDA6遺伝子破壊株中で、機能未知遺伝子At5g41660及びトランスポゾンAT3TE76225のそれぞれの領域上のDNAメチル化が完全に消失していることが明らかとなった。このことはMET1のDNAメチル化機能またはMET1自体の結合に、HDA6が不可欠であることを示している。
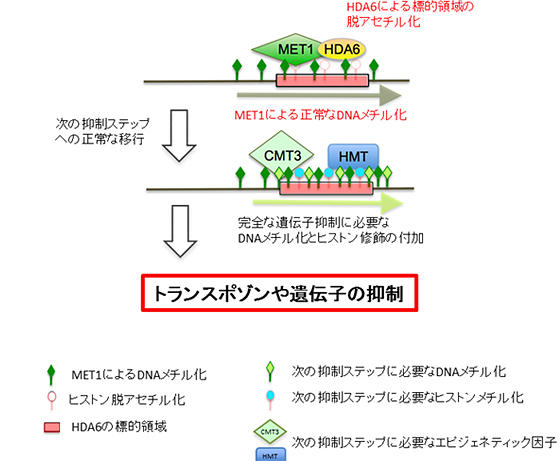
図7 HDA6のヒストン脱アセチル化を介した遺伝子抑制メカニズム
