ポイント
- 気孔閉鎖に必要な孔辺細胞で働く新規輸送因子AtABCG22を発見
- 赤外線サーモグラフィーで、葉温低下から水分蒸散を検出
- 気孔開閉のメカニズムの解明により、植物の水利用効率の向上に期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、植物体において水分の蒸散量を制御する新しい輸送因子(トランスポーター)※1である「AtABCG22」を発見しました。これは、理研植物科学研究センター(篠崎一雄センター長)機能開発研究グループの黒森崇上級研究員らの成果です。
植物は水分が少なくなり乾燥ストレスを受けると、植物体表面の「気孔※2」と呼ばれる開口部を閉じることで、植物体から水分が蒸散することを防ぎます。気孔は、「孔辺細胞※3」という特別に分化した細胞2つがペアとなり、その間に溝のように形作られています。孔辺細胞は、植物を取り巻く環境の状態やストレス条件によって、さまざまな生体物質のやり取りを行い、その細胞形状を変えることで気孔の開閉を調節しています。
研究グループは、これまでに作製してきた実験モデル植物であるシロイヌナズナの研究リソース※4の中から、葉からの水分蒸散が促進される新規の変異体を選別して解析しました。その結果、ABCトランスポーター※5と呼ばれる輸送因子の遺伝子ファミリーの1つであるAtABCG22遺伝子の遺伝子破壊型変異体で、通常よりも水分蒸散量が多いことを発見しました。この変異体を詳細に解析したところ、気孔が開きやすいために水分蒸散が進んでいること、AtABCG22遺伝子は主に孔辺細胞で発現していること、が分かりました。すなわち、このトランスポーターを欠損すると気孔が閉まりにくくなり、水分蒸散が盛んに行われることが明らかとなりました。
気孔は植物の生育において大変重要な役割を果たしています。AtABCG22が輸送している物質を特定し、気孔開閉の制御メカニズムを解明できれば、作物の生産量を上げたり、乾燥地に適応できる植物を育種したりするためのグリーンイノベーションに関わる知見を提供できると期待されます。
本研究成果は、英国の科学雑誌『The Plant Journal』に掲載されます。成果の一部は、生物系特定産業技術研究支援センター(生研センター)イノベーション創出事業(植物の水利用効率に関わるストレ ス感知機構解明と分子育種への応用)の課題の1つとして行われました。
背景
植物の生育のために水は必須ですが、地球規模での温暖化や干ばつによって乾燥化が進んでおり、効率的な水の利用が重要になりつつあります。植物は水分が少なくなり乾燥ストレスを受けると、植物体表面の気孔を閉じることで、植物体から水分が蒸散することを防ぎます。気孔は、孔辺細胞2つがペアとなり、その間に溝のように形作られています。孔辺細胞は、植物を取り巻く環境の状態やストレス条件によって、さまざまな生体物質のやり取りを行い、その細胞形状を変えることで気孔の開閉を調節しています。植物体からの水分蒸散のほとんどは気孔から行われているため、植物体の水利用効率を上げるには、気孔開閉の制御による水分の蒸散量の調節が重要な課題となります。
研究手法と成果
研究グループは、これまでに作製してきたシロイヌナズナの研究リソースを用いて、さまざまな表現型解析(フェノーム解析※6)を行ってきました。現在では、目視できる形態的異常についてだけではなく、さまざまな測定機器を用いて検出できる形質についても解析を進めています。研究グループは今回、赤外線サーモグラフィー※7を用いて植物体の水分蒸散を観察しました。赤外線サーモグラフィーは、肉眼では分からない植物体の温度の変化を、非接触で撮影することができる利点を持ちます。一般に、水分蒸散の多い部位は温度が低く、逆に水分蒸散の少ない部位は温度が高くなることから、赤外線サーモグラフィーによる温度変化の検出で植物体からの水分蒸散の状態を視覚化することができます。
研究グループは2010年に、遺伝子発現させることで気孔が閉まりやすく、水分蒸散が抑制されるAtABCG25を報告しました(2010年1月19日プレスリリース)。AtABCG25はABCトランスポーターと呼ばれる輸送因子の1つで、遺伝子ファミリーを形成しており、植物には構造的によく似た遺伝子が数多く存在しています。
そこで、この遺伝子ファミリーに属する他の遺伝子の変異体を調べたところ、AtABCG22遺伝子の遺伝子破壊型変異体で水分蒸散量が上昇していることを発見しました(図1)。さらに、この変異体で水分蒸散が進んでいる原因を調べたところ、気孔が開きやすいために植物体から水分が蒸散していることを突き止めました(図2A)。この変異体は、水を与えずに乾燥状態にすると、野生型植物よりも先にしおれることが分かりました(図2B)。
AtABCG22遺伝子の植物体内での発現個所を調べた結果、地上部の葉部分、特に孔辺細胞で発現していることを観察しました(図3)。これは、変異体では気孔開度が正常でない結果と一致しており、AtABCG22遺伝子が孔辺細胞で気孔開閉に関わる重要な役割を果たしていることを示しています。さらに、AtABCG22タンパク質に蛍光タンパク質を融合させて、タマネギ細胞や植物培養細胞へ導入して調べたところ、細胞を取り囲む細胞膜に局在しており、孔辺細胞への生体物質の流入(あるいは排出)に働いていることが判明しました(図4)。
今後の期待
気孔は植物の生育において大変重要な役割を果たしている器官であるため、孔辺細胞による気孔開閉の制御メカニズムが解明できれば、作物の生産量を上げたり、乾燥地に適応できる植物を育種したりするためのグリーンイノベーションに関わる知見を提供できると期待されます。今回発見したAtABCG22タンパク質は、輸送因子ファミリーに含まれるため、孔辺細胞の働きに重要な何らかの生体物質を輸送し、気孔開閉に関与していると予想されますが、具体的な対象物質はまだ分かっていません。AtABCG22が輸送する物質を特定できると、気孔開閉の制御メカニズムの解明に一歩近づきます。今後は、AtABCGに分類される他のファミリー遺伝子の機能解析やAtABCG22との関係性を調べることで、メカニズムの全容を明らかにしていきます。
発表者
理化学研究所
植物科学研究センター センター長
機能開発研究グループ グループディレクター
篠崎 一雄(しのざき かずお)
Tel: 045-503-9579 / Fax: 045-503-9580
機能開発研究グループ 上級研究員
黒森 崇(くろもり たかし)
Tel: 045-503-9625 / Fax: 045-503-9586
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.輸送因子(トランスポーター)
生体膜に存在し、膜を通過して物質輸送を行う膜タンパク質。膜輸送体とも呼ばれる。 - 2.気孔
高等陸上植物の地上部の表皮にあり、特有な構造を持つ小さい隙間。植物体内外のガス交換や、蒸散作用の際の空気や水蒸気の通り道になる。 - 3.孔辺細胞
気孔を構成する一対の細胞。細胞の体積の増減により気孔の開閉を行う。 - 4.研究リソース
さまざまな研究や開発のために用いられる実験材料のことで、ライフサイエンス研究の基盤となる生物遺伝資源は、特にバイオリソースと呼ばれている。代表的なものにゲノムDNAやcDNA、変異体系統などがある。 - 5.ABCトランスポーター
ATP-binding cassetteトランスポーターの略。ATPのエネルギーを用いて能動的に物質を輸送する。大腸菌からヒトに至るまで全ての生物に存在し、特に植物でその数が多いことから(ナズナやイネでは100遺伝子以上)、生理的に重要な役割をしていると考えられている。 - 6.フェノーム解析
表現型(Phenotype)の網羅的な解析。さまざまな遺伝子の変異体に関してどのような表現型になるか調べることによって、変異の入った各遺伝子の働きを予測する。ゲノム上のすべての遺伝子の機能を探ることを目的としている。 - 7.赤外線サーモグラフィー
対象物から出ている赤外線放射エネルギーを検出することで、温度分布を画像表示する装置。
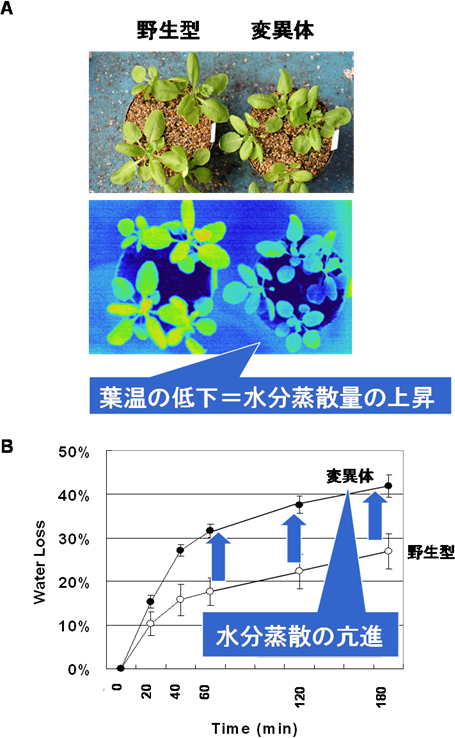
図1 AtABCG22遺伝子の変異体の水分蒸散
- A: 野生型(左)とAtABCG22遺伝子の変異体(右)の植物体の写真。赤外線サーモグラフィーによる観察(下)によって、変異体では葉温が低く水分蒸散量が上昇していることが分かる。
- B: 葉の重さから水分蒸散量を測定した。変異体では葉からの水分蒸散量が上昇している。
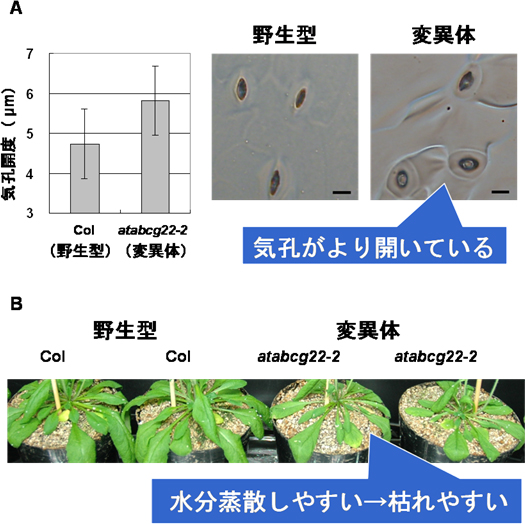
図2 AtABCG22遺伝子の変異体の気孔開度
- A: 野生型(左)とAtABCG22遺伝子の変異体(atabcg22、右)の気孔開度の測定。野生型に比べて変異体の方が気孔が開いており、変異体で水分蒸散量が上昇しているのは気孔の開度が原因であることが分かった。
- B: 水を与えず乾燥状態にした時の植物体の写真(左の2個体が野生型、右の2個体が変異体)。気孔開度が大きく蒸散量が高いため、変異体が先にしおれてくる。
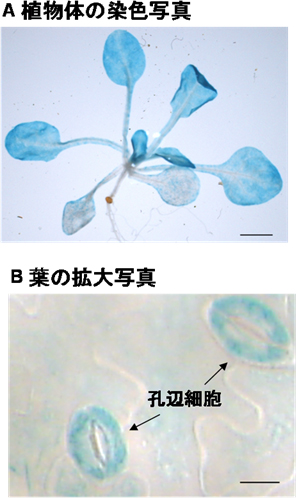
図3 シロイヌナズナの染色写真
- A: AtABCG22遺伝子のプロモーターの後ろに、青く染色されるためのレポーター遺伝子を組み込んで植物体へ導入し、AtABCG22遺伝子が発現している部位を観察した。写真は2週齢のシロイヌナズナ。地上部の葉で、AtABCG22遺伝子が発現していることが分かった。
- B: 5週齢のシロイヌナズナの葉の拡大写真。特に孔辺細胞でAtABCG22遺伝子が発現していた。

図4 AtABCG22タンパク質の局在
- A: AtABCG22タンパク質を黄色の蛍光タンパク質と融合して、タマネギ細胞に導入し観察した結果、AtABCG22タンパク質が細胞を取り囲む細胞膜に局在していた。
- B: 植物の培養細胞へ導入して観察した結果、タマネギ細胞と同様に、1つ1つの細胞を取り囲む細胞膜に局在していた。
