2011年9月19日
独立行政法人 理化学研究所
水素の挙動を観察できる新たな水素吸蔵材料の合成と構造解析に成功
-異種多金属ヒドリドクラスターのX線構造解析で、水素の吸着・放出を直接観察-
ポイント
- 希土類金属とd-ブロック遷移金属を含む異種多金属ヒドリドクラスターを合成
- 固体と水素が反応する様子や、取り込んだ水素の位置を初めて解明
- 高効率な水素の吸着・放出を実現する水素吸蔵材料開発への新しいアプローチ
要旨
独立行政法人理化学研究所(野依良治理事長)は、希土類金属※1とd-ブロック遷移金属※2という異なる金属を組み合わせた、新しいタイプの水素吸蔵材料「多金属ヒドリド(H-)クラスター※3」の合成と構造解析に成功し、これが水素と反応する様子をX線構造解析※4で初めて明らかにしました。これは、理研基幹研究所(玉尾皓平所長)侯有機金属化学研究室の侯召民主任研究員、島隆則専任研究員、中国大連理工大の羅一教授、仏・ラウエ-ランジュバン研究所(ILL)のサックス メイスン(S. A. Mason)博士、ギャリー マッキンタイア(G. J. McIntyre)博士、および米・南カリフォルニア大のティム ステュアート(T. Stewart)博士、ロバート バウ(R. Bau)教授らによる共同研究の成果です。
水素吸蔵材料の開発は、環境・エネルギー問題に対する関心の高まりから重要な課題になっています。より高効率な吸着・放出を実現する水素吸蔵材料を開発するには、材料の詳細な構造や水素との反応プロセスなどの解明が必要です。しかし固体では、金属が多くの電子を持つため、近傍の電子を1つしか持たない水素の位置をX線構造解析で正確に決定し、その挙動を調べることが難しいのが現状です。こうした状況の下、例えば希土類金属とd-ブロック遷移金属といった性質の異なる金属を組み合わせた異種金属混合型の多金属ヒドリドクラスター(異種多金属ヒドリドクラスター)は、従来の水素吸蔵合金※5などと比べ、構造解析が容易で、水素を吸着・放出する機能も優れていると期待されています。しかし、その詳細な構造や水素との反応プロセスはこれまで明らかにされていませんでした。
研究グループは、独自に開発してきた希土類ヒドリド化合物を用いて、モリブデンやタングステンなどのd-ブロック遷移金属と組み合わせ、異種多金属ヒドリドクラスターの合成に成功し、水素も含めた詳細な構造を中性子回折※6で明らかにしました。また、X線構造解析により水素の挙動を直接観察することにも成功し、取り込んだ水素の位置や反応プロセスを明らかにしました。この成果は、異種多金属ヒドリドクラスターの構造と水素の吸着・放出の相関に基礎的な知見を与えるとともに、新しい水素吸蔵材料の開発にもつながると期待できます。
本研究成果は、科学雑誌『Nature Chemistry』オンライン版(9月18日付け:日本時間9月19日)に掲載されます。
背景
水素は燃焼しても水になるだけで、温室効果ガスを排出しないクリーンで再生可能なエネルギーとして注目されています。また、燃料電池として利用すれば電気自動車の動力源にもなります。しかし、化石燃料と違い、常温・常圧では気体であり、輸送や貯蔵の難しさが普及の妨げになっています。燃料電池車実現への最も大きな課題も、走行に十分な水素をいかに安全で効率よく積み込むかにかかっています。その解決策として有望な方法の1つが、水素をヒドリド(H-)の形で金属と結合させ固体にする貯蔵法です。この方法では、用いる材料によらず水素の体積を1000分の1以下に抑えることができ、かつ使用したいときには水素として取り出せます(図1)。各国が新しい水素吸蔵材料の開発を進めていますが、実用化までにはまだ多くの課題が残っています。特に、水素を吸着したあとの構造はどうなっているのか、その反応のプロセスはどうなのか?これらを固体中で詳しく調べるのは非常に困難です。なぜなら、分子の立体構造を調べる有効な手段の1つにX線構造解析がありますが、この方法は電子密度の分布を明らかにする方法であり、多くの電子を持つ金属原子近傍に位置し、電子を1つしか持たない非常に小さな水素を見つけにくいからです。一方、水素を含む金属-ヒドリド化合物の構造が明らかになった化合物も存在しますが、それらの多くは水素の出し入れが自由にできませんでした。
研究グループは、これまで希土類-ヒドリドの結合をもつ希土類ヒドリド化合物の性質や反応性を明らかにしてきました。希土類金属は、電子的にプラスになりやすく、それと結合をもつヒドリド原子はマイナスになりやすいため、X線構造解析でも比較的容易に水素の位置を決められます。しかし、希土類金属だけでは水素を吸着・放出することはできません。そこで、この希土類ヒドリド化合物を基にd-ブロック遷移金属を組み合わせ、分子構造が明確でしかも可逆的に水素を吸着・放出することが可能な異種金属混合型の多金属ヒドリドクラスター(異種多金属ヒドリドクラスター)の実現を予測し、その合成と水素との反応プロセス解明に挑みました。
研究手法と成果
研究グループは、2003年に開発した希土類ヒドリド化合物と、モリブデンやタングステンのヒドリド化合物を組み合わせることによって、異種多金属ヒドリドクラスターの合成に初めて成功しました(図2、左)。この分子構造をX線および中性子線で解析したところ(図2、右)、両者の結果はほぼ等しく、金属を結ぶ全てのヒドリド原子の精密な位置が確認できました。また、モリブデンやタングステンだけと結合するヒドリド原子は正電荷を帯び、イットリウムだけと結合するヒドリド原子は負電荷を帯びる、というようにお互い電子的な性質が異なり、混ざり合わないことも分かりました(図2、右)。
この異種多金属ヒドリドクラスターを減圧下で加熱脱気(10-8気圧、80 ℃、)すると、水素1分子を放出した新たなクラスターを得ました(図3、右)。この構造を調べたところ、中心部にあったヒドリド原子と、2つのイットリウム原子間(Y3とY4)を架橋していたヒドリド原子が、水素分子となって放出していることが明らかになりました(図3左→右)。この水素分子が抜けた多金属ヒドリドクラスターに再び水素を吹きかける(常温・常圧)と、速やかに水素を吸着し、元のクラスターに戻ることが分かりました(図3右→左)。また、水素がこの単結晶に吸着する様子をX線構造解析で追跡し、水素と反応しヒドリド原子が中心部とY3~Y4の間に取り込まれる様子と全体構造の変化を、リアルタイムでとらえることに成功しました(図4)。理論計算による解析の結果、この水素との反応では、イットリウムが水素を捕まえ、モリブデンが水素を蓄えることでクラスター内に水素が取り込まれることが分かりました。
今後の期待
今回の成果は、より多くの水素を効率よく吸着・放出するための「金属の組み合わせ」や「金属の電子的性質が反応性に及ぼす影響」についての理解を深め、今後さらなる新たな物質群の創製や、それらの研究を通した新たな水素吸蔵材料の開発へとつながるものと期待できます。また、これまで1つの金属に集中した研究がほとんどでしたが、多数の金属が反応に作用する多金属クラスターを用いた新たな触媒の開発などへの展開も期待できます。
原論文情報
- Takanori Shima, Yi Luo, Timothy Stewart, Robert Bau, Garry J. McIntyre, Sax A. Mason and Zhaomin Hou. "Molecular heterometallic hydride clusters composed of rare-earth and d-transition metals." Nature Chemistry, 2011, doi: 10.1038/NCHEM.1147.
発表者
理化学研究所
基幹研究所 侯有機金属化学研究室
主任研究員 侯 召民(こう しょうみん)
Tel: 048-467-9393 / Fax: 048-462-4665
専任研究員 島 隆則(しま たかのり)
Tel: 048-467-9392 / Fax: 048-462-4665
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.希土類金属
元素番号21のスカンジウム(Sc)、39のイットリウム(Y)と57~71のランタノイド元素の総称。希土類-ヒドリド(H-)結合は著しく分極しており、ヒドリド原子上は電子密度が大きく、極めて反応性が高い。 - 2.d-ブロック遷移金属
周期表で第4族から第11族までに属する元素の総称。鉄(Fe)、モリブデン(Mo)、タングステン(W)、ルテニウム(Ru)など。d-ブロック遷移金属-ヒドリド結合間に電子が使われるため、ヒドリド原子上の電子密度は小さくなる。 - 3.多金属ヒドリド(H-)クラスター
多数の金属が金属-金属結合やヒドリド原子(H-)を介して集まった集合体のこと。今回合成したものは、希土類金属4つ(イットリウム、あるいはジスプロシウムや、ホルミウムがそれぞれ4つ)とd-ブロック遷移金属(モリブテンまたはタングステン)1つからなる異種金属混合型の多金属ヒドリドクラスターである。 - 4.X線構造解析
単結晶によるX線の回折現象を利用して、物質の結晶構造を解析する手法。回折強度が電子密度に比例するため、電子数の少ない水素が電子数の多い金属に結合すると、水素の位置を正確に決定することが困難な場合が多い。 - 5.水素吸蔵合金
水素を温和な条件下で可逆的に吸着・放出することができる金属。多くは水素との親和性が異なる金属を組み合わせた合金。代表的なものとして、ランタン・ニッケル合金(LaNi5)、鉄・チタン合金(FeTi)、マグネシウム・ニッケル合金(Mg2Ni)などが知られている。水素吸蔵合金は安全な水素の保管方法として研究され、アポロ宇宙船に搭載された燃料電池(水素と酸素を反応させて、電気と水を得る電池)にも、ランタン・ニッケル合金が利用されていた。 - 6.中性子回折
単結晶による中性子線の回折現象を利用して、物質の結晶構造を解析する手法。X線とは異なり原子核によって散乱がおこるので、構造中の水素の位置を正確にとらえることができる。しかし、中性子線の強度の問題から0.5mm角以上の大きな単結晶を必要とする。
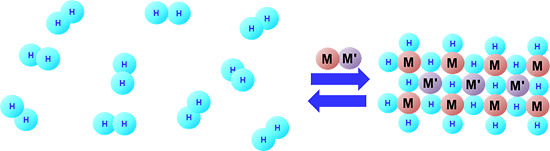
図1 水素が金属(合金)に吸着される模式図
加圧することで水素がヒドリドとして水素吸蔵合金(M-M')に取り込まれる(左→右)。加熱などによりヒドリドは容易に水素として取り出せる(右→左)。
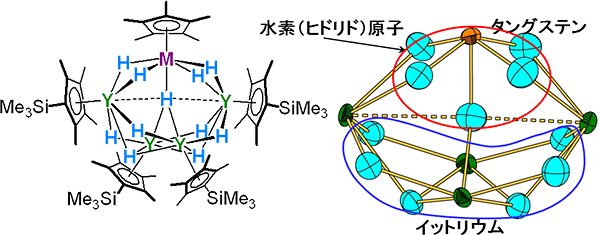
図2 異種金属混合型の多金属ヒドリドクラスターの構造
- 左: 合成した異種金属混合型の多金属ヒドリドクラスターの全体構造。Mはモリブデン(Mo)やタングステン(W)、Hはヒドリド、Yはイットリウム。SiMe3, Me3Siはトリメチルシリル基。
- 右: 中性子回折で得られたコア構造。赤(電子的にプラス)と青(電子的にマイナス)で囲ったヒドリド原子は、互いに異なる電荷を持ち、混ざり合わない。
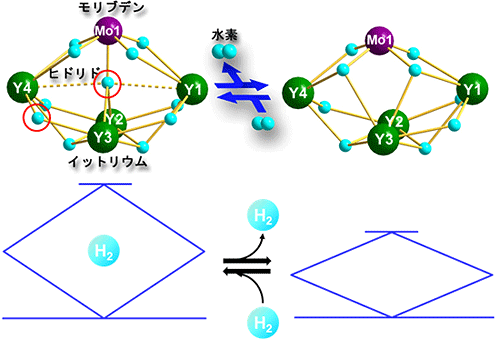
図3 可逆的な水素付加・脱離反応と電車のパンタグラフ
減圧下で加熱脱気すると、赤丸で示したヒドリド原子が水素分子として抜けていく。金属フレームは電車のパンタグラフをたたむように空いたスペースを埋めている。
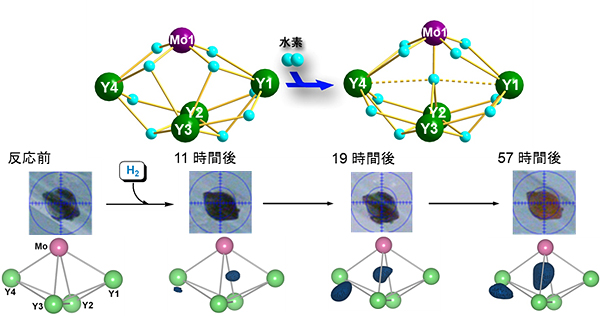
図4 結晶状態を保持したまま水素と反応する様子
- 上: 水素との反応の式。
- 中: 結晶の写真。結晶が水素と反応し構造が変化するため、結晶自体の色が黒→赤に変化していく。
- 下: 差電子密度図。電子密度の変化(紺色)とその位置により、ヒドリド原子が徐々に増えていく様子が分かる。
