2012年1月26日
独立行政法人 理化学研究所
新型インフルエンザウイルス検出に期待の新技術が登場
-独自開発したRT-SmartAmp 法を適用し、迅速かつ高感度の検出が可能に-
ポイント
- 発症から6~24時間以内で新型インフルエンザウイルスを判定可能
- タミフル耐性型や新規変異ウイルス検出にも応用可能
- 新たなパンデミックの拡大防止に貢献
要旨
独立行政法人理化学研究所(野依良治理事長)は、独自開発の遺伝子迅速検出法「RT-SmartAmp法※1」を適用して、従来のインフルエンザウイルス簡易検査キットに比べ約100倍という高感度で、かつ40分以内と短時間でウイルスを検出する方法を開発し、臨床研究でその有効性を実証しました。これは理研オミックス基盤研究領域(OSC、林崎良英領域長)LSA要素技術開発グループLSA要素技術開発ユニットの石川智久上級研究員らと複数の医療・研究機関、地域診療所※2の協力による成果です。
2009年、新型のインフルエンザ2009pandemiA/H1N1(2009pdmA/H1N1)ウイルス感染が国内で急速な広がりをみせました。特に妊婦、乳幼児および糖尿病やぜんそくなどの基礎疾患がある高齢の患者においては、重篤化する恐れがあるため早期の診断が求められました。LSA要素技術開発ユニットは、こうしたニーズに応えるため特定のウイルスが検出できるRT-SmartAmp法を開発しました。鼻腔や気管の分泌液から標的ウイルスのゲノムRNAを1段階でDNAに変換して増幅するようにプライマー※3を設計して、検出時間を40分以内に短縮することに成功しました。さらに、一般的にPCR※4を用いたウイルス検出法とは異なり、ウイルスRNAを抽出するステップをなくすことで操作を簡便にできました。実際の医療現場で性能を検証するために、千葉県や東京都にある3医療・研究機関と11地域診療所の協力を得て、2009pdmA/H1N1ウイルスを検出する臨床研究を行いました。その結果、従来の検査キットでは、発症後24時間を経ないと検出が難しかったのですが、6~24時間以内でも感度よく検出できることを確認しました。これにより2009pdmA/H1N1ウイルスの早期発見に有効な検出法となる可能性を示しました。
またRT-SmartAmp法は検出対象とする遺伝子を増幅するためのプライマーの設計を変えることで、タミフル※5耐性型のウイルスや新型高病原性H5N1亜型ウイルス※6の検出にも応用することが可能です。今後も懸念される新型パンデミックインフルエンザウイルスの蔓延防止に役立つ高感度で迅速な診断方法として貢献すると期待できます。
本研究の一部は、科学技術振興調整費「重要政策課題への機動的対応の推進」プログラム“新型インフルエンザ対策に資する緊急研究”として行い、本成果は、米国のオンライン科学雑誌『PLoS ONE』(1月25日付け:日本時間1月26日)に掲載されます。
背景
インフルエンザウイルスは、タンパク質の抗原性の違いによりA型、B型、C型の3属に分類されます。その遺伝子は1本鎖RNA上にあるため、変異頻度が高く細かな変異を有する亜型が次々と発生するのが特徴です。特にA型は変異型が多く、世界的な大流行(パンデミック)を起こしやすいことが知られています。2009年、メキシコで発生した豚由来の新型インフルエンザ2009pandemicA/H1N1(2009pdmA/H1N1)ウイルスは世界的な猛威をふるい、全世界でおよそ18,000人もの死者を出しました(出典:Pandemic(H1N1)2009‐update97(World Health Organization, Geneva, Awitzerland.2010))。国内においても急速な広がりをみせ、特に妊婦、乳幼児および糖尿病やぜんそくなどの基礎疾患がある高齢の患者では重篤化する恐れがあるため、早期の診断が緊急に求められました。しかし2009年当時、医療現場で広く使用されていた簡易検査キットでは、A型かB型ウイルスかを区別して判定することはできても、同じA型に属する2009pdmA/H1N1ウイルスを判別することはできませんでした。そのため医療現場で迅速に診断することができず、重篤な症例や死亡例が報告されました。
2009pdmA/H1N1ウイルス感染は2010年には収束しましたが、今後も新型インフルエンザが大流行する可能性があるといわれており、社会的および経済的パニックを招く危険性が十分考えられます。被害を最小限にくい止めるには、流行の初期に原因ウイルスを確定し、早急に感染拡大の防止対策を講じることが必要不可欠です。そこで、LSA要素技術開発ユニットは、こうしたニーズに応えるため医療現場で有効性のある特定のウイルスを検出できる方法の開発に挑みました。
研究手法と成果
理研オミックス基盤研究領域が開発したRT-SmartAmp法は、等温DNA増幅法であるSmartAmp法※7と逆転写酵素反応※8を組み合わせることで、インフルエンザウイルスなどのゲノムRNAにコードされた遺伝子を特異的に検出する方法です。一般的にウイルス検出に用いられるPCRのように反応温度を上下させる必要がなく、摂氏60度で逆転写酵素反応と等温DNA増幅反応を同一のチューブで同時に行うことができるため、簡単な装置で遺伝子を検出することが可能です。そこで、2009pdmA/H1N1ウイルスを検出対象としたプライマーを設計したところ、検体採取後40分以内でウイルスに特有の遺伝子配列を簡単に検出することができました(図1)。また、タンパク質レベルで検出する従来のインフルエンザ簡易検査キットと比べて、遺伝子レベルで検出することによる正確さと、SmartAmp法がもつ優れたDNA増幅能により約100倍もの高感度が実現できました。
RT-SmartAmp法の有効性を医療現場で検証するために、千葉県と東京都にある3医療機関(千葉県立東金病院、いすみ医療センター、国立国際医療研究センター)と千葉県の東金市、山武市・山武郡にある11診療所の協力を得て、2009pdmA/H1N1ウイルス検出の臨床研究を行いました。インフルエンザの疑いのある発熱外来患者対象に、鼻腔から綿棒で検体を採取して、従来のインフルエンザ簡易検査キット(免疫クロマトグラフィー法)※9とRT-SmartAmp 法でインフルエンザウイルスを検出しました。その結果、簡易検査キットでは、255検体中110検体がA型インフルエンザと診断されたのに対し、RT-SmartAmp法では、140検体から2009pdmA/H1N1ウイルスを検出しました。そのうち104検体は簡易検査キットでも陽性反応が出ましたが、残りの36検体はRT-SmartAmp法だけが検出できました。また、2009pdmA/H1N1ウイルスと診断した98検体は、発熱から24時間以内の患者の検体であり、そのうちの28検体は6時間以内のものでした。従来の簡易検査キットでは、感度にばらつきがあったり発症から24時間以上経過しないと検出が難しいのですが、RT-SmartAmp法を使えば、発症から高感度で迅速にウイルスを検出できることを実証しました。
さらに、本臨床研究の一例である自己免疫性肝炎を患った女性(72歳)の場合は、発熱から11時間後にRT-SmartAmp法で調べたところ、2009pdmA/H1N1ウイルス感染陽性でしたが(図2A)、簡易検査キットではA型とB型ともにウイルス感染陰性でした。その後、52時間経過しても簡易検査キットでは陰性のままでした。この女性はタミフル投与などさまざまな治療を受けましたが、胸部レントゲン写真(図2B)が示すように症状は悪化の一途を辿り、残念ながら発熱から52時間後に死亡しました。この症例は、厚生労働省からも報道発表された2009pdmインフルエンザ感染による死亡例でした。また詳しく調べてみるとウイルスの一部に変異があり、1918年に世界大流行したスペイン・インフルエンザウイルスと同じ変異だったことが分かりました(図2C)。この重篤な症例で示されたように、従来法では死亡時まで診断できなかった症例でも、RT-SmartAmp法では発症初期段階からウイルスを検出することができました。
今回の臨床研究結果から、RT-SmartAmp法は2009pdmA/H1N1ウイルスの早期発見に有効な検出法、さらにはその蔓延を防止する効果的な手段となる可能性を示しました。
今後の期待
21世紀は感染症の時代ともいわれ、国際的な交通網の発達とともに感染症の世界規模での拡大が懸念されています。2009年、世界中で感染拡大した新型インフルエンザ2009pdmA/H1N1ウイルスの出現は、近代社会における感染症の脅威に警鐘を鳴らすこととなりました。特にわが国では、インフルエンザ治療においてタミフルを広く使用しており、タミフル耐性ウイルスが出現する可能性が極めて高いことが予想されます。また、アジアを中心に世界15カ国で鳥インフルエンザH5N1亜型のヒトへの感染が発生しています。早期診断・早期治療は患者の生死を分けるばかりでなく、社会・経済活動全体に対する影響を最小限にくい止めるために重要です。今回の臨床研究は、理研オミックス基盤研究領域が開発したRT-SmartAmp法が医療現場で短時間に高感度で特定のインフルエンザウイルスを検出できることを実証しました。その検出方法の原理は、タミフル耐性ウイルスや新規の変異ウイルスの検出にも応用することができます。現在、石川上級研究員は文部科学省・感染症研究国際ネットワーク推進プログラム(J-GRID)インフルエンザコンソーシアムのなかで、鳥インフルエンザH5N1亜型ウイルスのRT-SmartAmp法による迅速検出法を開発しています。このように将来懸念される新型パンデミックインフルエンザウイルスの蔓延防止に役立つ新しい診断方法として貢献することが期待できます。
原論文情報
- Yuki Kawai, Yasumasa Kimura, Alexander Lezhava, Hajime Kanamori, Kengo Usui, Takeshi Hanami, Takahiro Soma, Jean-Etienne Morlighem, Satomi Saga, Yuri Ishizu, Shintaro Aoki, Ryuta Endo, Atsuko Oguchi-Katayama, Yasushi Kogo, Yasumasa Mitani Takefumi Ishidao, Chiharu Kawakami, Hideshi Kurata, Yumiko Furuya, Takayuki Saito, Norio Okazaki, Masatsugu Chikahira, Eiji Hayashi, Sei-ichi Tsuruoka, Tokumichi Toguchi, Yoshitomo Saito, Toshiaki Ban, Shinyu Izumi, Hideko Uryu, Koichiro Kudo, Yuko Sakai-Tagawa, Yoshihiro Kawaoka, Aizan Hirai, Yoshihide Hayashizaki, and Toshihisa Ishikawa “One-step detection of the 2009 pandemic influenza A(H1N1) virus by the RT-SmartAmp assay and its clinical validation”. PLoS ONE, 2012, doi:10.1371/journal.pone.0030236
発表者
理化学研究所
オミックス基盤研究領域
LSA要素技術開発グループ LSA要素技術開発ユニット
上級研究員 石川 智久(いしかわ としひさ)
Tel: 045-503-9222 / Fax: 045-503-9216
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.RT-SmartAmp法
等温DNA増幅法であるSmartAmp法と逆転写酵素反応を組み合わせることで、インフルエンザウイルスなどのゲノムRNAにコードされた遺伝子を1ステップで迅速に検出する方法。ゲノムRNAを抽出・精製する必要がないという特徴を持つ。これまでの検出方法は、ゲノムRNAを抽出・精製し、逆転写酵素反応でRNAをDNAに変換した後、PCRでDNAを増幅させてウイルスの有無を検出していた。そのため検出には数時間を要したが、RT-SmartAmp法では、検体採取後1時間以内に検出することが可能。 - 2.協力医療・研究機関、地域診療所
千葉県立東金病院(平井愛山院長、林栄治内科医師、今村茂樹内科副部長、古垣斉拡内科医長、鶴岡成一臨床検査科長、外口徳美致地域医療連携室長)、いすみ医療センター(伴俊明副院長、川野英一郎医師、佐野英樹医師、柴田貴久医師、岩佐亮太医師、正田稔子医師、齊藤美朝臨床検査科長)、国立国際医療研究センター(工藤宏一郎国際疾病センター長、泉信有特別疾病征圧班医長、瓜生秀子小児科医師)、横浜市衛生研究所(川上千春専任研究員)、神奈川県衛生研究所(岡崎則男部長、古屋由美子部長、斉藤隆行専門研究員)、東京大学医科学研究所(河岡義裕教授、坂井研子特任助教)
千葉県山武市・山武郡の11診療所:天野内科クリニック(天野豊医師)、伊藤医院(伊藤俊夫医師)、岡崎医院(岡崎信彦医師)、松尾クリニック(金子昇医師)、山武市日向診療所(加部恒雄医師)、佐久間医院(佐久間猛医師)、北辰堂佐藤医院(佐藤成信医師)、高橋医院(高橋一医師)、西田医院(西田泉医師)、はにや内科(埴谷一夫医師)、古川クリニック(古川洋一郎医師)※研究当時の職名で記載 - 3.プライマー
DNAを合成する際に使用される短い核酸の断片。プライマーの3'OH部分にDNAポリメラーゼが作用しDNA伸長するため、プライマーなしではDNAを伸長することはできない。PCRやSmartAmp法に使用されるものは、目的DNAの増幅に適するよう設計し化学合成した短い断片で、長さは通常20塩基程度。 - 4.PCR
Polymerase chain reactionの略。DNA合成酵素であるDNAポリメラーゼを利用してDNA分子の特定の領域を増幅させる実験手法。目標領域の両端に相補的な20塩基程度のプライマー、基質dNTP、鋳型となるDNA、耐熱性DNAポリメラーゼを含む反応液を、①高温での熱変成②低温でのプライマーと鋳型DNAとの特異的結合③プライマーからのDNA合成④熱変成の各段階を数十回繰り返すことで爆発的にプライマーの組を両端に持つDNA断片が増幅される。1980年代開発された革新的技術で、遺伝子組み換え実験などの分子生物学研究において広く利用されている。最初にPCR法を着想し、方向性を示した業績により、1993年にK. Mullisがノーベル化学賞を受賞した。Mullisはこの方法を"polymerase-catalyzed chain reaction"(ポリメラーゼ触媒連鎖反応)と名付け、 Natureや Scienceなどの著名な科学雑誌に論文として投稿したが、掲載されなかった。1987年にようやく、その論文は Methods in Enzymology誌に掲載されたという経緯がある。 - 5.タミフル
インフルエンザウイルスが体内で新たに拡散するのを阻害する薬剤。名称はオセルタミビル。タミフルはインフルエンザ治療薬の商品名。A型B型インフルエンザウイルスのノイラミニダーゼに作用し、発症後48時間以内に投与すれば有意に羅患期間を短縮できる。 - 6.新型高病原性H5N1亜型ウイルス
A型インフルエンザH5N1ウイルス亜型の一つ。鳥インフルエンザH5N1ウイルスが変異して、ヒト-ヒト間感染の能力を持つ高病原性ウイルスの出現は、世界同時大流行をひき起こし、社会・経済に甚大な被害をもたらす可能性がある。1997年に香港でヒトへの感染が発生し、H5N1亜型の感染拡大が危惧されている。現在H5N1亜型はアジア、ヨーロッパ、アフリカにまで拡散し、ヒトに感染した場合の致死率は60%を超える。 - 7.SmartAmp法
理研オミックス基盤研究領域が開発した「核酸の恒温増幅法を利用した遺伝子検出法(Smart Amplification procecc法)」。複数の酵素を組み合わせて、摂氏60度でゲノムDNAにコードされた遺伝子を特異的に増幅して検出する簡便・迅速・安価な新しい遺伝子検出技術。独自に開発した鎖置換活性を有する酵素と独自の非対称なプライマーデザインにより、目的の遺伝子を迅速かつ高感度に増幅することを可能にした。SmartAmp法を応用することによって、1滴の血液からヒトの1塩基多型(SNP)を検出することや、がん組織特異的な遺伝子変異を検出することも可能。 - 8.逆転写酵素反応
RNA依存性DNAポリメラーゼ(RNA-dependent DNA polymerase;別名逆転写酵素)を用いてRNAを鋳型として相補的DNA(cDNA)を合成する反応。遺伝情報はDNAからRNAへの転写によって一方向にだけなされると考えられていた(セントラルドグマ)が、この酵素の発見により遺伝情報はRNAからDNAへも伝達されることが明らかとなった。 - 9.インフルエンザ簡易検査キット(免疫クロマトグラフィー法)
免疫クロマトグラフィー法による簡易検査キットは、特別な機器を必要とせず、簡便で短時間(約10~15分)で結果を得られることから、検査施設を持たない小規模の医療機関でも使用できる。インフルエンザウイルスの検査用免疫クロマトグラフィー法は、発熱外来患者がインフルエンザに感染しているかどうかを判定するのに広く使われている。インフルエンザウイルスに特徴的なタンパク質を認識する抗体を用いて検査するが、感度に関して簡易検査キット間でばらつきがある。
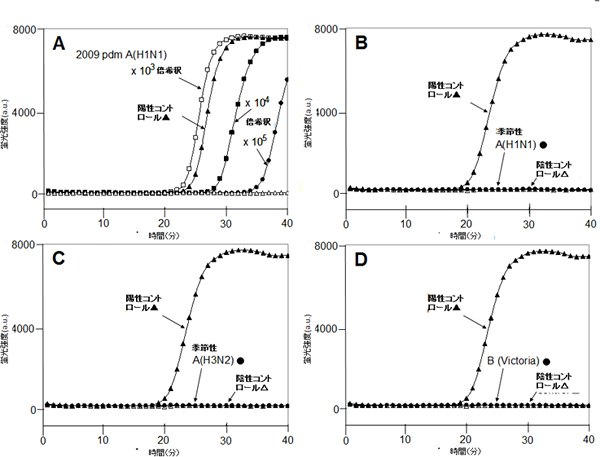
図1 RT-SmartAmp法による2009pdmA/H1N1ウイルスの検出結果
2009pdmA(H1N1)ウイルス特異的にプライマーを設計したRT-SmartAmp法を用いて、2009pdmA(H1N1)ウイルスと他の季節性インフルエンザウイルスとの検出感度を比較した。
(縦軸は、蛍光強度。▲…陽性コントロール、△…陰性コントロール)
- A: 2009pdmA(H1N1)ウイルス(□:103倍希釈、■:104倍希釈、●:105倍希釈)
- B: 季節性A型インフルエンザ(H1N1)(●)
- C: 季節性A型インフルエンザ(H3N2)(●)
- D: B型インフルエンザ(Victoria)(●)
RT-SmartAmp法を用いると、標的ウイルスに対して低濃度でも迅速に高感度で検出することができた。(A)また他の季節性インフルエンザウイルスには全く検出せず、高精度に標的ウイルス特異的に検出することが証明できた。(B-D)
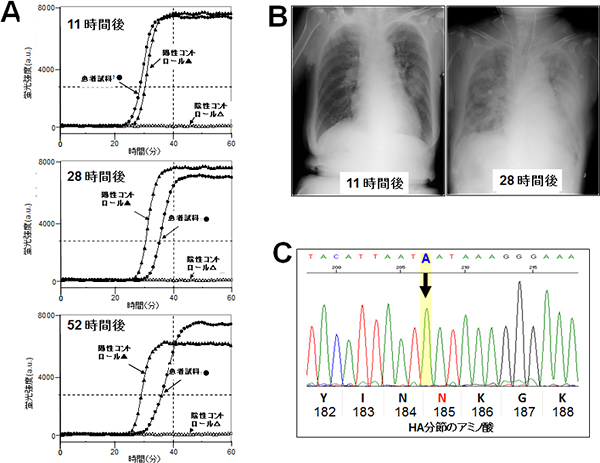
図2 重篤なインフルエンザ感染の症例(自己免疫性肝炎を患った72歳女性)
- A: RT-SmartAmp法では、発熱から11時間後でウイルスを検出できたが、従来の簡易検査キットでは、52時間経過してもウイルスを検出することはできなかった。
- B:
胸部レントゲン写真(発熱後11時間および28時間後に撮影)
タミフル投与などさまざまな治療を行ったが、症状は改善されなかった。 - C: 患者由来2009pdmA/H1N1ウイルスの一部であるヘマグルチニンのアミノ酸配列。
G(グアニン)がA(アデニン)に変異したことで185番目のアミノ酸がアスパラギン酸(D)(対応コドン:GAT)からアスパラギン(N)(対応コドン:AAT)に変異している。
これは、1918年に世界大流行したスペイン・インフルエンザウイルスと同じ変異だった。
