2013年1月25日
理化学研究所
神経難病ALSとSMAに共通した病態メカニズムを発見
-DNAから成熟RNAを合成するスプライシング反応の破たんが細胞死を誘因-
ポイント
- ALSの原因タンパク質とSMAの原因タンパク質がお互い作用し複合体を形成
- ALSの運動神経細胞の核にスプライシング反応を担うsnRNPsが異常蓄積
- 運動神経変性疾患の発症メカニズムの全貌解明や治療法開発への応用が期待
要旨
理化学研究所(野依良治理事長)は、全身の筋肉まひを引き起こす運動神経変性疾患の1つ「筋萎縮性側索硬化症(ALS)」の運動神経細胞の中に、小児期に発症する運動神経変性疾患「脊髄性筋萎縮症(SMA)」と類似した異常を発見し、2つの疾患に共通する神経細胞変性のメカニズムの一端を解明しました。これは、理研脳科学総合研究センター(利根川進センター長)運動ニューロン変性研究チームの山中宏二チームリーダー、築地仁美研究員らと、名古屋大学、東京都健康長寿医療センター、福祉村病院長寿医学研究所との共同研究グループによる成果です。
運動神経細胞が変性し筋肉まひを引き起こす疾患であるALSの一部は、RNA結合タンパク質TDP-43[1]やFUS[1]をコードする遺伝子の異常により発症します。正常な脊髄運動神経細胞にあるTDP-43やFUSタンパク質は核内に局在しますが、ALSの約90%を占める非遺伝性ALSの脊髄運動神経細胞では、TDP-43タンパク質は細胞質に異常凝集していることから、これらのタンパク質の異常がALSの発症に直結する原因であると考えられます。しかし、どのようなメカニズムが破たんし、細胞死を引き起こすのかはまだ不明です。
共同研究グループは、正常な細胞においてTDP-43とFUSタンパク質の局在を詳細に調べたところ、もう1つの運動神経変性疾患のSMAの病因タンパク質SMN[2]とTDP-43、FUSが互いに結合し、核内にあるGem[3]と呼ばれる構造体を形成することを見いだしました。さらに、ALS患者の変性した運動神経細胞では、TDP-43の異常に伴い、Gemが消失していること、またタンパク質の鋳型を作るスプライシング反応[4]を担うsnRNPs[5]が核内で異常凝集し蓄積していることも発見しました。さらに、snRNPsの減少はSMAの要因と知られていたことからALSとSMAの運動神経細胞に共通してsnRNPsの異常が起こっていることを初めて突き止めました。
今回の研究成果は、JST戦略的創造研究推進事業チーム型研究(CREST)の研究領域「精神・神経疾患の分子病態理解に基づく診断・治療に向けた新技術の創出」における研究課題「孤発性ALSのモデル動物作成を通じた分子標的治療開発」(研究代表者:祖父江元、名古屋大学教授)、文部科学省新学術領域研究「脳内環境」の支援を受けて行われ、欧州の医学専門誌『EMBO Molecular Medicine』2月号に掲載されるのに先立ち、オンライン版(2013年1月25日付け:日本時間1月25日夕)に掲載されます。
背景
筋萎縮性側索硬化症 (Amyotrophic Lateral Sclerosis;:ALS)は、全身の筋肉を支配する運動神経細胞に障害が起き、呼吸筋を含む全身の筋肉がまひする運動神経変性疾患です。50代から60代での発症例が多く、極めて進行が早い原因不明の難病です。有効な治療法は見つかっておらず、日本では約8,500人のALS患者が闘病していると推定されています(出典:公益財団法人難病情報センター)。患者さんの苦痛に加え、長期にわたって負担が大きい介護を必要とするため、その原因の解明と治療法の開発が社会的に強く求められています。
ALSの約90%は非遺伝性で、ほぼ全ての非遺伝性ALSの病巣にTDP-43と呼ばれるRNA結合タンパク質が運動神経細胞の細胞質内に異常に凝集し蓄積しています。さらに、過去の研究から遺伝性ALSの一部にTDP-43やFUS遺伝子の変異が見つかっていることから、TDP-43やFUSタンパク質の異常がALSの発症に直結する原因であると考えられます。TDP-43とFUSタンパク質の働きは、スプライシングやmRNA安定性の制御などさまざまなRNA代謝の制御に関わることが知られています。RNA代謝の制御は、DNAからタンパク質が合成される転写や翻訳などのプロセスに重要な役割を持ち、生物が正常に生命維持活動を行うために欠かせない機構の1つです。
しかし、この2つのタンパク質の異常がどのようなメカニズムで運動神経細胞の変性を引き起こすのかは依然として不明のままです。
一方、脊髄性筋萎縮症(Spinal Muscular Atrophy: SMA)は、ALS同様に脊髄の運動神経細胞の病変によって全身の筋肉まひが起こる運動神経変性疾患で、小児期から発症する遺伝性の進行性神経難病です。過去の研究からSMNというタンパク質の減少によりSMAを発症することが知られていました。SMNタンパク質はスプライシング反応を担うsnRNPsと呼ばれるタンパク質とRNAの構造体の形成に必須なので、snRNPsの減少がSMA発症の要因と考えられます。ALSもSMAと同様なRNA代謝の異常が予想されますが、ALSではどのようなRNA代謝異常があるのか、またALSでどのメカニズムの破たんが運動神経細胞を死滅させるのかは不明でした。
そこで、共同研究グループは、TDP-43やFUSタンパク質の異常とRNA代謝の関連性を突き止め、運動神経変性メカニズムの解明に挑みました。
研究手法と成果
まず、正常な状態でのALS病因タンパク質TDP-43、FUSとSMA病因タンパク質SMNの動態を確認するために、ヒトとマウスの正常な培養細胞内でこれらの局在を詳細に調べました。すると、TDP-43、FUSタンパク質とSMNタンパク質は一緒に核内に存在し、Gemと呼ばれる構造体に共に局在していることを見いだしました(図1 A)。さらに生化学実験によってTDP-43タンパク質のカルボキシル末領域がGemへ局在するのに必要であることが分かり、その領域はSMNとの結合に必要であることも明らかになりました(図1 B-D)さらに、この3つのタンパク質は互いに結合して複合体を形成していることも分かりました(図1 E)。
次に、ALS患者と非ALS患者の脊髄組織を用いてTDP-43タンパク質とGemを 免疫染色したところ、非ALS患者の脊髄にある正常な運動神経細胞では核内にGemが観察され、TDP-43タンパク質はGemに局在することが分かりました。しかし、ALS患者の変性した運動神経細胞では、TDP-43は細胞質に異常に凝集し、Gemが形成されていませんでした(図2)。また、ALS患者の脊髄の運動神経細胞では、snRNPsの量が異常に上昇し核内に凝集していることも分かりました(図3)。snRNPsのRNA構成成分であるsnRNAs[6]の染色法による解析によっても核内にsnRNAsの異常蓄積が認められ(図4 AB)、かつ脊髄組織中のRNA量を定量するとALS患者組織でsnRNAs発現量の上昇が確認されました(図4C)。
通常、核内でDNAから転写されたsnRNAsは細胞質へ運ばれ、SMNタンパク質によりsnRNPsが構築され、再び核内のGemへと輸送されます。Gemでさらに修飾が起こり、多くのタンパク質が相互作用することでスプライシング反応を起こすスプライソソーム[4]まで成熟します。ALSの変性した運動神経細胞では、snRNPsが核内に異常に増えて凝集し、スプライシング反応の破たんを招いていることが示唆されました。snRNPsの減少がもう1つの運動神経変性疾患SMAを起こすことを考え合わせると、運動神経細胞はsnRNPs異常に脆弱であると考えられました(図5)。
今後の期待
本研究により、根本治療法がなく難病とされるALSとSMAに共通した病態メカニズムを初めて突き止めました。今後は、このスプライシング反応の破たんがどのように運動神経細胞死を引き起こしているかを詳細に検証することで、ALSやSMAを含む運動神経変性疾患全体の発症メカニズムの全貌の解明や治療法開発への応用が期待できます。
原論文情報
- Hitomi Tsuiji, Yohei Iguchi, Asako Furuya, Ayane Kataoka, Hiroyuki Hatsuta, Naoki Atsuta, Fumiaki Tanaka, Yoshio Hashizume, Hiroyasu Akatsu, Shigeo Murayama, Gen Sobue, Koji Yamanaka
"Spliceosome Integrity is Defective in the Motor Neuron Diseases ALS and SMA"
EMBO Molecular Medicine 2013 DOI: 10.1002/emmm.201202303
発表者
理化学研究所
脳科学総合研究センター 疾患メカニズムコア 運動ニューロン変性研究チーム
チームリーダー 山中 宏二(やまなか こうじ)
研究員 築地 仁美(ついじ ひとみ)
お問い合わせ先
脳科学研究推進部
Tel: 048-467-9757 / Fax: 048-462-4715
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.TDP-43、FUS
RNA結合タンパク質で、スプライシングやmRNA安定性の制御などさまざまなRNA代謝の制御に関わっている。正常な細胞では主に核内に局在するが、遺伝性のALSの運動神経細胞では細胞質に移行し異常凝集がみられる。TDP-43タンパク質は,非遺伝性ALSの運動神経においても異常凝集がみられる。 - 2.SMN
snRNPsの構成に必須のタンパク質。SMNのタンパク質量の減少はSMAを引き起こす。 - 3.Gem
細胞の核の中にある構造体で、SMN、Geminファミリー、snRNPsなどのタンパク質群から成る。snRNPsのRNA成分であるsnRNAsの成熟の場と考えられている。 - 4.スプライシング反応、 スプライソソーム
DNAから転写されたmRNA前駆体から、余分なRNA配列を切り落とし、タンパク質合成の鋳型になる成熟したmRNAを作り出す機構。スプライシング反応を起こす各種snRNAやタンパク質により構成される複合体が、スプライソソームと呼ばれる。 - 5.snRNPs
small nuclear ribonucleoproteinsの略。スプライソソームの構成成分で、スプライシングを引き起こす本体。 - 6.snRNAs
small nuclear RNAs の略。snRNPsのRNA成分。スプライソソームの成分としてはU1など9種類が存在する。
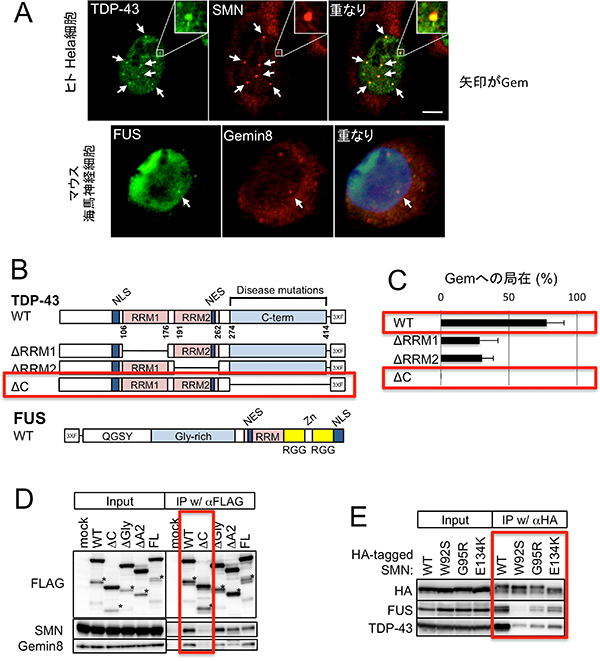
図1 TDP-43、FUS、SMNは核内でGemに共局在し、互いに結合している
- A.培養細胞でTDP-43、FUS、SMNタンパク質、Gemin8(Gemを構成する成分の一種)を免疫染色すると、Gemという核内構造体(矢印)で3つのタンパク質が共局在していることが分かる。
- B.使用したTDP-43、FUSおよびその変異体タンパク質の領域を模式的に示す。RRM:RNA結合部位、C-term:カルボキシル末端付近の部位、NLS:核移行シグナル、NES:核外移行シグナル、QGSY:グルタミン、グリシン、セリン、チロシンの豊富な領域、Gly-rich:グリシンの豊富な領域、RGG:アルギニン、グリシン、グリシンのくり返しが豊富な領域。
- C.TDP-43タンパク質のカルボキシル末端を欠損した変異体(ΔC)は、野生型(WT)でみられるGemへの局在がみられないことから、TDP-43のカルボキシル末領域がGemへの局在に必要であることが分かる。
- D.TDP-43タンパク質のカルボキシル末領域がSMNとの結合に必要である。
- E.SMA疾患変異体(W92S, G95R, E134K)では3タンパク質からなる複合体形成が減ることが分かり、SMN、TDP-43、FUSタンパク質が複合体を形成する際の重要部位の同定ができた。
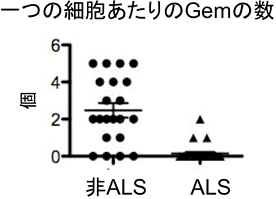
図2 ALS患者の脊髄運動神経細胞Gemが減少している
非ALS患者の脊髄運動神経細胞ではGemが1つの細胞あたりに2個程度存在するが、ALS患者ではGemの数が極端に減っている。
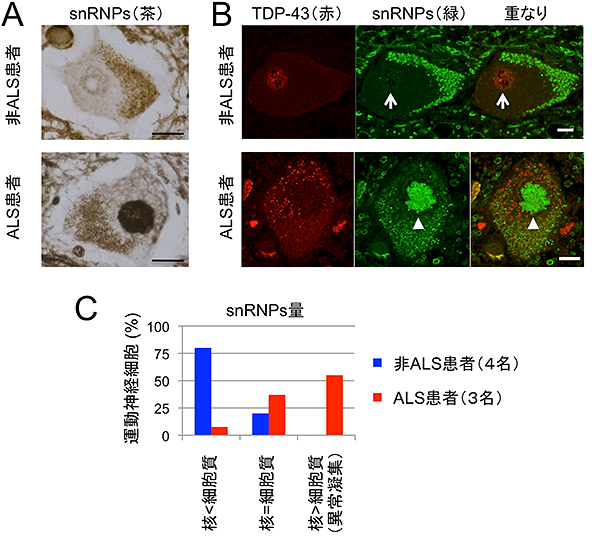
図3 ALS患者の脊髄運動神経細胞におけるsnRNPsの核内異常蓄積
- A.snRNPsを認識する抗体で免疫染色すると、非ALS患者の場合、細胞質に局在するが、ALS患者の場合、核内に異常に蓄積することが分かる。
- B.snRNPsおよびTDP-43抗体で蛍光二重免疫染色すると、非ALS患者の場合は、TDP-43タンパク質は核内に、snRNPsは核と細胞質に弱く広がって存在するが、ALS患者の場合は、TDP-43タンパク質は細胞質に、snRNPsは核内に異常凝集する(白三角)ことが分かる。白矢印は核を示す。
- C.運動神経細胞の核内snRNPs量の定量。非ALS患者では、snRNPsは細胞質に多く分布するが(青)、ALS患者の運動神経細胞では、細胞質より核内により多く蓄積するものが多い(赤)。
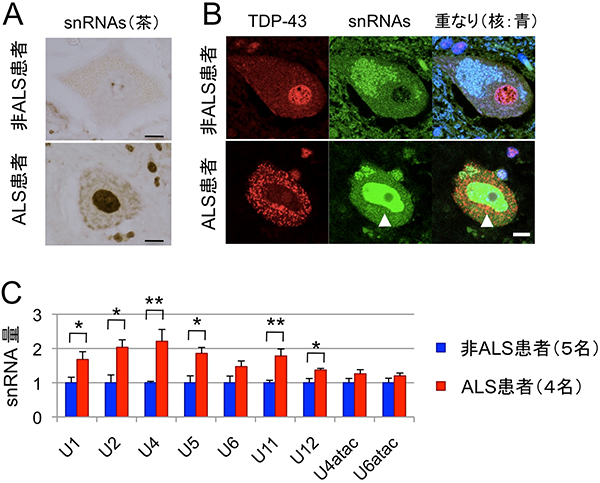
図4 ALS患者の脊髄運動神経細胞におけるsnRNAsの異常蓄積
- A.snRNAsを認識する抗体による免疫染色すると、ALS患者の場合、核内に異常に蓄積していることが分かる。
- B.snRNAsおよびTDP-43抗体による蛍光二重免疫染色すると、非ALS患者の場合は、TDP-43タンパク質は核内に、snRNAsは主に細胞質に局在する。しかしALS患者の場合は、TDP-43タンパク質は細胞質に、snRNAsは核内に局在する(白三角)ことが分かる。
- C.各種(U1~U6atac)のsnRNAs量をRT-PCR法で測定し、その平均値をプロットするとALS患者におけるsnRNAs量が、統計学的に有意に増加していることが分かる。
*:p<0.05、**:p<0.01(Student’s t 検定、p値=偶然にそのような事が生じる確率)
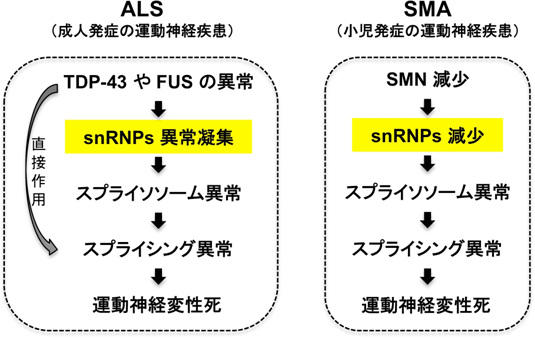
図5 概念図
ALSとSMAは共にRNA代謝に関わるタンパク質の異常により運動神経細胞の変性が起こり、その影響で細胞が死滅する疾患である。SMA患者では、その細胞死はスプライソソーム異常により起こることが分かっていた。今回の研究によりALSでもスプライソソーム異常があることが分かり、運動神経細胞は他の細胞よりもスプライソソーム異常に脆弱で、スプライソソーム異常がALSとSMAに共通した発症メカニズムではないかと考えられる。
