2013年4月8日
独立行政法人理化学研究所
独立行政法人科学技術振興機構
動物の体作りに重要なレチノイン酸の可視化に成功
-脊椎動物の胚でレチノイン酸が直線的な濃度勾配を形成-
ポイント
- レチノイン酸濃度をモニターする蛍光指示薬「GEPRA」を開発
- 魚の胚の真ん中から頭と尾に向かうほどレチノイン酸の濃度が直線的に減少
- 皮膚病やがんの治療で投与されるレチノイン酸の分布を観測する技術へ発展
要旨
理化学研究所(理研、野依良治理事長)は、ゼブラフィッシュの胚を用いて、ビタミンA誘導体であるレチノイン酸を可視化する技術を開発し、その濃度勾配が動物の体を形作るのに重要な役割を担うことを明らかにしました。これは、理研脳科学総合研究センター(利根川進センター長)細胞機能探索技術開発チームの宮脇敦史チームリーダー、下薗哲研究員らによる研究チームの成果です。
私たちが摂取するビタミンAは、体内でレチノイン酸という活性分子になって働きます。レチノイン酸は脊椎動物が発生する過程で細胞の運命を決定づけるモルフォゲン分子[1]として注目されてきました。しかし、レチノイン酸はタンパク質ではないので、蛍光タンパク質などで標識できません。そのため、胚の中でどういう濃度分布を示して位置情報を与え体作りに関わるのか、不明のままでした。
研究チームは、レチノイン酸と結合するタンパク質(レチノイン酸受容体)のうち、レチノイン酸が結合する部分だけを取り出し、これに蛍光タンパク質を連結した蛍光プローブ「GEPRA(ゲプラ)」を開発、ゼブラフィッシュの胚の前後軸(頭尾軸)に沿ったレチノイン酸濃度を可視化することに成功しました。レチノイン酸は合成部位(胚の真ん中)と分解部位(胚の両端)に挟まれた領域でほぼ直線的に分布しており、シミュレーションにより、レチノイン酸が胚の中で素早く拡散することが示唆されました。興味深いことに、こうした直線的な濃度勾配は、外から過剰のレチノイン酸を投与しても、あまり影響を受けないことが分かりました。
現在研究チームは、GEPRAをマウスなどに適用し、哺乳類動物の体作りにおけるレチノイン酸の役割の研究に着手しています。例えば、妊婦のビタミンA過剰摂取が胎児催奇形を引き起こす可能性が指摘されていますが、GEPRAはそのメカニズムの定量的な解析に貢献すると考えられます。さらに、レチノイン酸は私たちの体の中でリンパ球のホーミング現象[2]や神経シナプスの可塑性[3]に関与しており、これら組織・器官でのレチノイン酸動態を解析できると期待されます。また、ヒトの皮膚病やがんの治療にビタミンAが用いられることがありますが、組織におけるレチノイン酸の濃度勾配が分かれば薬の投与方法に関する指針が得られるはずです。レチノイン酸は分化誘導試薬としても知られているので、iPS細胞技術を中心とする再生医療の分野にもGEPRAは適用可能です。培養細胞集団から3次元的な組織を作り上げる過程で、レチノイン酸の濃度勾配を実測し制御する重要性が明らかになると、GEPRAの活躍する分野がさらに拡大すると期待できます。
本研究は、JST戦略的創造研究推進事業ERATO型研究「宮脇生命時空間情報プロジェクト」の一環として行われ、英国の科学雑誌『Nature』オンライン版(4月7日付け:日本時間4月8日)に掲載されます。
背景
モルフォゲンは、その濃度によって細胞の運命を決定する分子の総称です。動物の発生、変態、再生などの段階において、体のさまざまな空間で濃度勾配を作って位置情報を与え、形態形成(形作り)に関わっています。動物個体の中にモルフォゲンを産生・放出する場所が存在し、モルフォゲンはそこから周囲に向かって拡がっていくと考えられています。拡がりの先にはモルフォゲンを積極的に分解・破棄する場所が存在する場合もあります。モルフォゲンの濃度分布の情報を元に、さまざまな空間軸、つまり前後軸(頭尾軸)、背腹軸、左右軸、遠近軸などが形成され体全体が作られていきます。これまでに、繊維芽細胞増殖因子、ビコイド、ノーダルなどのさまざまな分泌タンパク質がモルフォゲンとして同定されてきました。これらはいずれもタンパク質なので、GFP[4]などの蛍光タンパク質を連結すると、空間軸に沿う蛍光シグナルの広がりや動きを解析することができます。
1980年代になると、脊椎動物特有のモルフォゲン分子としてレチノイン酸が注目されてきました。レチノイン酸は、脊椎動物胚の前後軸に沿う空間情報を与えるモルフォゲンとして、例えば後脳(小脳や延髄)形成や体節形成に必須であると考えられています。脊椎動物の発生遺伝実験では、胚の透明度が高く、発生が母体外で進行するゼブラフィッシュがよく用いられています(図1)。受精後14時間の胚では、レチノイン酸合成酵素は胚の真ん中で発現し、一方、レチノイン酸分解酵素は頭と尾に発現しています(図2)。従って、胚の真ん中から両端に向かってレチノイン酸の濃度勾配があると推測されてきました。しかし、レチノイン酸はビタミンA誘導体であって(図3)タンパク質ではないため、遺伝子工学的な手法で蛍光タンパク質を連結することができません。化学的な手法で蛍光標識することもできていません。これまでは、レチノイン酸の合成酵素または分解酵素を抑制したり、外部から過剰のレチノイン酸を投与する実験の結果から、前後軸に沿うレチノイン酸の濃度勾配の有無が間接的に議論されてきました。レチノイン酸の濃度勾配が存在するのか否か、存在するとして勾配は直線的(線形的)か非直線的(非線形的)か、こうした問題は未解決のままでした。
研究手法と成果
研究チームは、レチノイン酸の濃度を可視化するために、レチノイン酸が結合するレチノイン酸受容体に着目しました。受容体の中から、レチノイン酸が結合する主領域(ドメイン)だけを取り出し、ドメインがレチノイン酸と結合して構造を変化させる特徴を利用しました。具体的には、ドメインの両端にシアン色(水色)の蛍光タンパク質と黄色の蛍光タンパク質を連結し、ドメインの構造変化に従って蛍光タンパク質間のエネルギー移動の量が変化するように設計しました。こうして、レチノイン酸の濃度に応じて色が変わるプローブ「GEPRA (Genetically Encoded Probe for Retinoic Acid)」を開発しました(図4)。さらに、レチノイン酸に対する親和性が異なる2つのGEPRA(高親和性のGEPRA-Bと低親和性のGEPRA-G)を作製しました。これらGEPRAを組み込んだ個体で得られるデータを比較すると、広範囲のレチノイン酸濃度を定量的に解析できます。
実際に顕微鏡下で、生きたゼブラフィッシュの胚全体にわたってGEPRAの蛍光シグナルを観察しました(図5)。定量的に解析した結果、ゼブラフィッシュの胚の真ん中から頭と尾に向かってほぼ直線的にレチノイン酸の濃度が低くなることを確認しました(図6)。ゼブラフィッシュ胚の大きさを考慮しながらコンピュータシミュレーションを行ったところ、レチノイン酸が胚全体を素早く拡散することを示唆するデータが得られました。
これまで、ゼブラフィッシュの後脳(将来の小脳および延髄)の形成には、脳後方部位でレチノイン酸濃度が適切な勾配を持つことが必須であると考えられてきました。一方、レチノイン酸合成を阻害したゼブラフィッシュの胚をレチノイン酸溶液に浸し、一様にレチノイン酸を投与した場合でも後脳が正しく形成されるという薬理学的実験結果にもとづいて、レチノイン酸濃度勾配の不要説が提出されていました。研究チームが、GEPRAを発現するゼブラフィッシュ胚で再試した結果、レチノイン酸溶液に浸しても、頭部でレチノイン酸が盛んに分解されて、後脳形成領域でレチノイン酸の濃度勾配が形成されていることを突き止めました(図7)。また、蛍光観察を行ったGEPRA発現個体の全てが、その後も順調に成長して子孫を残すことも確認しました。GEPRAの発現がゼブラフィッシュの発生に影響を与える可能性は低いと考えられます。
こうして、遺伝学的あるいは薬理学的な操作がレチノイン酸濃度勾配をどう攪乱し形態形成異常を引き起こすのかを、ゼブラフィッシュ胚を個体丸ごと生きたままで観察できるようになりました。
今後の期待
過去に行われた数多の操作実験を、GEPRAゼブラフィッシュ胚を用いて再試すれば、注目する現象が起こる原理について理解が深まると期待されます。
今後研究チームは、GEPRAを哺乳類動物へ展開する計画です。妊婦がビタミンAを過剰に摂取すると胎児に奇形が生じる可能性が指摘されていますが、GEPRAを発現するマウス胚を使った模擬実験が、母体のビタミンA摂取量と体内のレチノイン酸濃度、奇形との相関について、定量的なデータを提供すると思われます。また、レチノイン酸はリンパ球のホーミング現象や神経シナプスの可塑性などにも関わるとされています。GEPRA発現マウスを用いて、免疫系や神経系を含めたさまざまな器官、組織でのレチノイン酸の合成と分解の動態を解析することができます。さらに、細胞の分化を促す作用を持つレチノイン酸は、皮膚病やがんの治療に用いられていますし、iPS細胞を用いる再生医療分野においては、レチノイン酸の濃度勾配を利用して組織を人工構築する試みがあります。さまざまな組織でのレチノイン酸濃度分布を観察することで、効率のよい治療や再生が可能になると期待されます。
原論文情報
Satoshi Shimozono, Tadahiro Iimura, Tetsuya Kitaguchi, Shin-ichi Higashijima & Atsushi Miyawaki
"Visualization of an endogenous retinoic acid gradient across embryonic development"
Nature, 2013, doi: 10.1038/nature12037
発表者
理化学研究所
脳科学総合研究センター 細胞機能探索技術開発チーム
チームリーダー 宮脇 敦史(みやわき あつし)
お問い合わせ先
脳科学研究推進室 入江真理子
Tel: 048-467-9757 / Fax: 048-462-4914
報道担当
独立行政法人理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
独立行政法人科学技術振興機構 広報課
Tel: 03-5214-8404 / Fax: 03-5214-8432
補足説明
- 1.モルフォゲン
濃度に応じて細胞の運命を決定したり細胞の分化を誘導したりする分子。発生、変態、再生においては、モルフォゲンの局所的な産生によって濃度勾配ができ、こうした勾配のパターンが体の形づくりを支配すると考えられている。 - 2.リンパ球のホーミング現象
リンパ球が特定のリンパ組織(リンパ節や脾臓など)から血中に循環し、再び元のリンパ組織にもどってくる現象。 - 3.神経シナプスの可塑性
神経シナプスは神経回路のつなぎ目に相当し情報伝達が起こる場である。シナプスにおける情報伝達の効率が神経活動や外部刺激によって変化することは神経シナプスの可塑性と呼ばれ、動物の記憶・学習の基礎と考えられている。 - 4.GFP
Green Fluorescent Protein(緑色蛍光タンパク質)の略。下村脩博士がオワンクラゲから見つけて1962年に発表。生きた細胞内で特定の構造やタンパク質を蛍光で標識する技術の発展につながった。2008年、下村博士を含む3名の博士が、「GFPの発見と開発」を理由にノーベル化学賞を授与された。
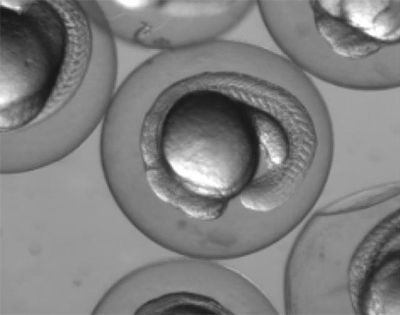
図1 発生中のゼブラフィッシュ
受精後約18時間のゼブラフィッシュ胚の写真。透明性が高い。
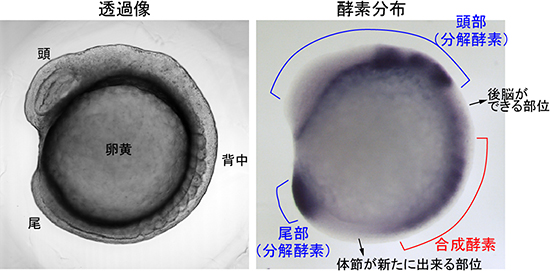
図2 受精後約14時間のゼブラフィッシュ胚の様子
- 左: ゼブラフィッシュ胚の形態写真
- 右:
レチノイン酸の合成酵素(赤)と分解酵素(青)の分布
黒い部分が酵素発現の箇所。
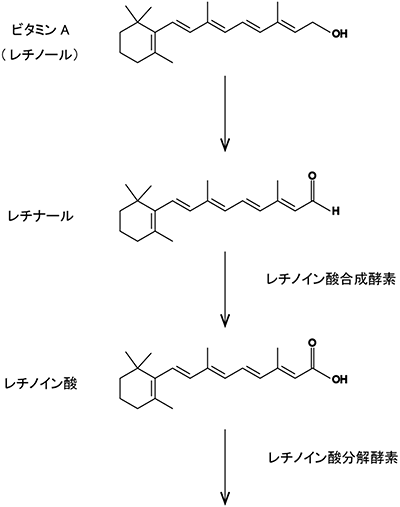
図3 ビタミンAからレチノイン酸合成、分解にいたる代謝経路
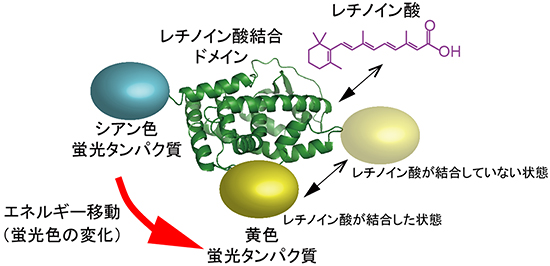
図4 レチノイン酸結合ドメインを用いて開発したレチノイン酸指示薬「GEPRA」
レチノイン酸(紫)の結合ドメイン(緑)の両端をシアン色蛍光タンパク質と黄色蛍光タンパク質で挟んだ構造を持つ。レチノイン酸がドメインに結合すると、シアン色と黄色の蛍光タンパク質が離れてエネルギー移動が起きにくくなり、黄色に比べてシアン色の蛍光が強くなる。
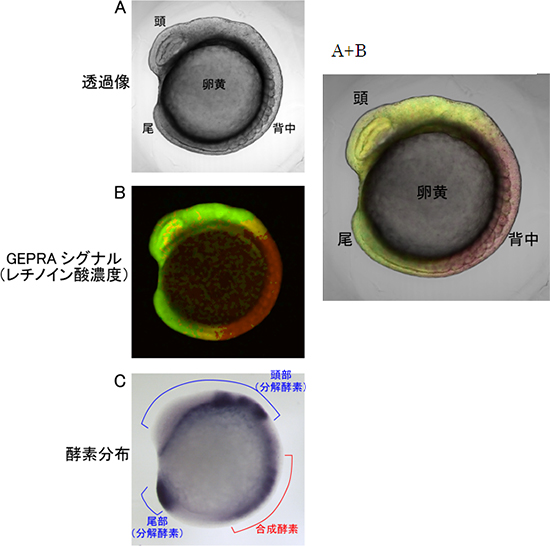
図5 受精後約14時間の胚の形態、レチノイン酸濃度、レチノイン酸代謝酵素の分布
- (A) 胚の形態
- (B)
GEPRAで可視化したレチノイン酸濃度
濃度が高いほど赤く(実際は、水色の蛍光が強い)、低いほど緑(実際は、黄色の蛍光が強い)で示した。 - (C)
レチノイン酸代謝酵素(合成酵素と分解酵素)の分布。
代謝酵素を発現する領域が黒く染まっている。
(A+B)透過像(A)とレチノイン酸濃度(B)の重ねあわせ
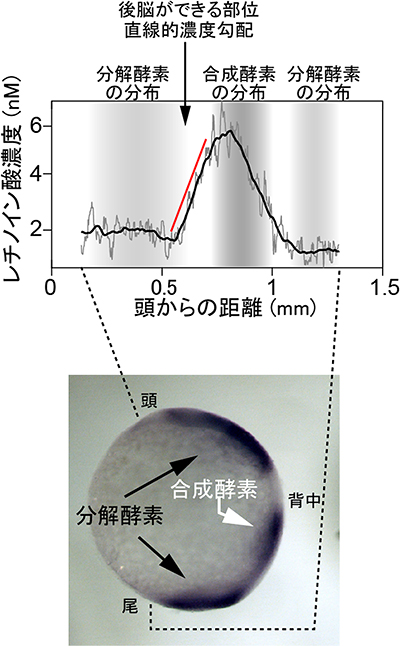
図6 レチノイン酸合成部位(胚の真ん中)と分解部位(頭)の間のレチノイン酸濃度
レチノイン酸は、合成部位と分解部位の間で直線的な濃度勾配を持つ。
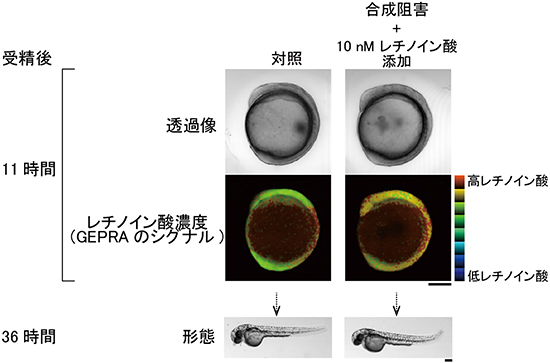
図7 レチノイン酸溶液にゼブラフィッシュ胚を浸した実験
- 左: 対照実験(正常発生している胚)
- 右: レチノイン酸合成を阻害した胚を10nM(ナノモル濃度)のレチノイン酸溶液に浸した
11時間後、頭部でレチノイン酸の濃度勾配(黄~赤)が観察され、36時間後には、正常な個体の発生が形態的に確認された。
