2014年1月20日
独立行政法人理化学研究所
独立行政法人科学技術振興機構
葉緑体内部のダイナミックな構造変化を生きたまま観察
-光合成調節の分子メカニズムに迫る技術として期待-
ポイント
- コケ植物の巨大葉緑体を利用した葉緑体ライブセルイメージング技術を開発
- 葉緑体内部でチラコイド膜構造が変化する様子の可視化に成功
- 葉緑体内部の実態を解明する重要な手立てに
要旨
理化学研究所(理研、野依良治理事長)は、葉緑体を生きたまま観察できる技術を開発し、コケ植物の葉緑体内で起きる膜ダイナミクス[1]の可視化に成功しました。これは、理研光量子工学研究領域(緑川克美領域長)ライブセル分子イメージング研究チームの岩井優和客員研究員(科学技術振興機構(JST)戦略的創造研究推進事業さきがけ研究者)、中野明彦チームリーダーらによる研究グループの成果です。
地球の環境と物質生産を支える植物の光合成反応は、植物細胞内にある葉緑体の中で行われています。これまでに電子顕微鏡を使って、葉緑体の中にチラコイド膜[2]と呼ばれる脂質二重膜が存在し、そこに光合成に関わるタンパク質が多く存在していることが知られています。これらのタンパク質は、環境の変化に応じて互いに結合する相手を変えながら光合成反応の調節を行っていると言われていますが、電子顕微鏡では生きたままの状態で葉緑体内部を観察することができないため、光合成に関わるタンパク質の動きや働きを捉えることはできませんでした。
そこで、研究グループは、新たに開発したライブセルイメージング技術を用いて、葉緑体内部の膜ダイナミクスの観察に挑みました。一般的な植物の葉緑体は、長径10μm以下と小さいため、内部観察は容易ではありません。そこで、抗生物質を投与すると細胞内に1つの巨大な葉緑体を形成するコケ植物の特徴を利用し、サイズの問題を解決しました。そして、クロロフィル色素の蛍光をコンピューター処理することによって、チラコイド膜が作る構造の識別に成功し、チラコイド膜の一部が活発に動いている様子の可視化に生きた細胞で初めて成功しました。また、チラコイド膜の部分構造によって、動きの活発さや構造の安定性が異なることも明らかになりました。今回の研究成果は、光合成調節の分子メカニズムの解明に向けて、葉緑体の膜ダイナミクスの役割を示唆するとともに、今後の解析の重要な手立てを提供するものです。
本研究はJST戦略的創造研究推進事業 個人型研究(さきがけ)研究領域「二酸化炭素資源化を目指した植物の物質生産力強化と生産物活用のための基盤技術の創出」研究課題名「ライブセルイメージングによる光環境適応機構の実態解明」(代表:岩井優和)の一環として行われ、成果は英国の科学雑誌『Scientific Reports』のオンライン版(1月20日付け:日本時間1月20日)に掲載されます。
背景
植物などの光合成生物は、約30億年という長い年月の間、地球規模で起こるさまざまな環境変化に耐え抜き、適応してきました。その結果、今ではありとあらゆる自然環境下において生存、繁栄しています。これまでの研究から、光合成反応を調節している光化学系タンパク質と太陽からの光エネルギーを集める集光アンテナタンパク質がチラコイド膜に存在し、膜内でその配置や互いの結合を変えることで、植物が光環境変化に適応していることが明らかになっています。しかし、それらの研究のほとんどは、試験管内での解析や、葉全体を使った解析だったため、生きた植物細胞の葉緑体内部での実際の様子や振る舞いについては不明な点が多く残っています。植物の光合成反応は、空気中の二酸化炭素を吸収し、安全な形で有機物を作りだす唯一の自然化学反応であり、近年多くの研究分野で注目されています。研究グループは、光合成反応の実態を明らかにするため、植物細胞の葉緑体内部を生きたままで観察する手法の開発に取り組み、その可視化に挑みました。
研究手法と成果
葉緑体は長径10μm以下と小さいため、その内部を観察することは容易ではありません(図1)。また、光合成反応を調節する多くのタンパク質はクロロフィル色素を含んでおり、その強い蛍光が観察の邪魔になります。
研究グループは、葉緑体の大きさの問題を解決するため、コケ植物「ヒメツリガネゴケ[3]」の原糸体(胞子が発芽した後に形成される糸状の構造)の細胞に着目しました(図2a)。ヒメツリガネゴケの原糸体細胞は簡素な構造であり、寒天の培地上に育った細胞を直接観察できるため生体観察に適しています。また、原糸体細胞に抗生物質(アンピシリンなど)を投与すると葉緑体の分裂が阻害され、細胞内に通常の約20倍以上の1つの巨大な葉緑体を形成することが知られています(図2e)。この特徴を利用することで、より広い空間視野で葉緑体内部を観察できるだけでなく、通常は細胞内を動き回る葉緑体が動かなくなるため、葉緑体内部の観察に適した試料状態にすることができます。
また、クロロフィル色素の強い蛍光の問題を解決するため、共焦点レーザー顕微鏡[4]を用いました。まず、共焦点レーザー顕微鏡でクロロフィルの蛍光の観察を行い(図2 b・f)、得られた三次元蛍光画像をコンピューター解析することで、非焦点ボケを除去しました(図2 c・g)。そうすることで、クロロフィル色素の強いクロロフィル蛍光を抑えることができ、葉緑体内部の構造をはっきりと捉えることに成功しました(図2 d・h)。
そして研究グループは、コケの巨大葉緑体形成、共焦点レーザー顕微鏡観察、そして画像解析による非焦点ボケ除去の組み合わせによって確立したライブセルイメージング技術を用いて、葉緑体内部の構造を詳細に解析しました。その結果、チラコイド膜が形成するグラナとストロマラメラという2つの異なる膜構造を識別することに成功しました。これまでの電子顕微鏡を使った解析で、グラナはチラコイド胞膜が数枚重なった構造をしていること、ストロマラメラは重なりのない1枚の胞膜として存在していることが分かっていました。また、ストロマラメラは複数のグラナをつなぐような形で存在していることも分かっていました。しかし、これらは化学物質で細胞を固定し観察されたものであり、生きた細胞の葉緑体内部でグラナとストロマラメラの2つの膜構造を識別したのは、今回が初めてです。
さらに、この膜構造を経時的に観察したところ、グラナは安定した膜構造を示すのに対し、ストロマラメラは非常に活発に動いている様子を観察できました(図3)。また、薬剤(リンコマイシン)を使ってグラナのサイズを小さくすると、膜構造全体の動きが活発化することも観察でき、グラナが葉緑体内部の膜ネットワーク構造の安定性に重要であることも明らかとなりました。
今後の期待
光合成反応を完全に解き明かすことは、人工光合成研究への利用だけでなく、植物の光合成能力の向上や今後起こりうる自然環境変化に植物が生き残るための機能を知るうえでも重要なことです。今回、コケ植物を使い、光合成反応を調節する葉緑体を生きたまま観察できるライブセルイメージング技術を開発し、葉緑体内で起きる膜ダイナミクスの可視化に成功しました。この成果は、葉緑体内部の実態を解明する重要な手立てとなります。
今後は光合成に関わるタンパク質の動きに膜ダイナミクスがどれだけ関与しているのか、また、その機能的側面についても明らかにする必要があります。葉緑体内部の複雑なチラコイド膜構造や光合成反応が起きる空間環境についても明らかにする必要があります。今回、開発した葉緑体のライブセルイメージング技術を基に、さらに時間と空間の分解能を上げたり、タンパク質の移動速度を測定するなど、解析手法を進化させることで、定量的かつ動態的な変化を追跡することを目指し、光合成調節の分子メカニズムの完全理解へとつなげていきます。
原論文情報
- Iwai, M., Yokono, M., Nakano, A. "Visualizing structural dynamics of thylakoid membranes". Scientific Reports,2014, doi: 10.1038/srep03768
発表者
理化学研究所
光量子工学研究領域 エクストリームフォトニクス研究グループ ライブセル分子イメージング研究チーム
客員研究員 岩井 優和(いわい まさかず)
チームリーダー 中野 明彦(なかの あきひこ)
お問い合わせ先
光量子工学研究推進室 広報担当
Tel: 048-467-9528 / Fax: 048-465-8048
報道担当
独立行政法人理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
独立行政法人科学技術振興機構 広報課
Tel: 03-5214-8404 / Fax: 03-5214-8432
補足説明
- 1.膜ダイナミクス
生体膜は、脂質や糖脂質、タンパク質を含む脂質二重層である。細胞の運動や分裂のほか、情報伝達といった生命機能を調節する多くの現象が生体膜を介して制御されている。一般的に膜ダイナミクスとは、そのようなダイナミックな膜の構造変化を示す挙動を指す。なお、対象とする生体膜によって「膜ダイナミクス」という言葉が意味する現象は異なる。また、検証する空間スケールの違いからもこの言葉が示す意味合いが異なってくる。本研究では、植物細胞が持つ葉緑体の内部に存在するチラコイド膜と呼ばれる生体膜に関する現象を対象にしており、これまでにさまざまな光合成反応との関連が示唆されているが、その詳細はほとんど分かっていない。 - 2.チラコイド膜
葉緑体内部に存在する内膜系で、光エネルギーを化学エネルギーに変換する光反応の場。扁平な形状をした胞膜であり、クロロフィルやカロテノイドを含んだ光合成に関わるタンパク質が多く存在する。膜が1枚ずつ独立した形状をしている場合と複数の膜が重なり多重になっている場合がある。一般的にコケ植物も含め陸上植物では、1枚の胞膜で存在する「ストロマラメラ」と10枚程に重なった「グラナ」と呼ばれる異なる2つの膜構造が発達していることが電子顕微鏡の観察によって明らかになっている。 - 3.ヒメツリガネゴケ
コケ植物のモデル生物として初めてゲノムが解読された。成長しても1cmほどにしか育たない。ヒメツリガネゴケの原糸体細胞は簡素な構造で、細胞1つに約50個の葉緑体が存在しており、薬剤などの処理も容易にできるため、顕微鏡観察に適している。 - 4.共焦点レーザー顕微鏡
光源にレーザーを用いる顕微鏡システム。レーザー光を使って試料を照射し、それによって試料から放出される蛍光を検出する。この時、ある特定の波長を持つレーザー光を照射し、特定の光学フィルターを組み合わせて用いることで、試料中に含まれる蛍光物質を選択的に検出することができる。また、レーザーを絞ることでスポット状に照射し、焦点面以外からの迷光を遮断するピンホールを用いることで、よりコントラストの高い画像を観察することができる。
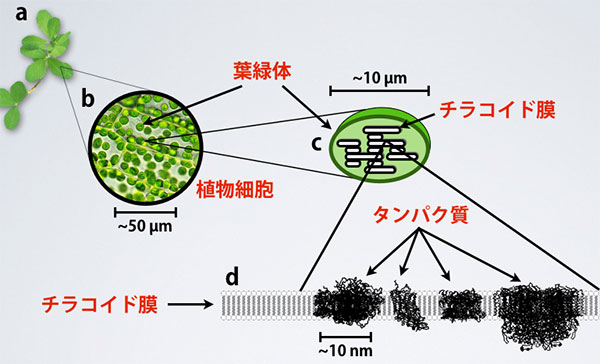
図1 植物の葉に存在する葉緑体のイメージ図
- a: 一般的な植物と葉。
- b: 葉に含まれる植物細胞。緑色の粒が葉緑体。
- c: 葉緑体の模式図。内部の構造がチラコイド膜。
- d: チラコイド膜の一枚を拡大した模式図。
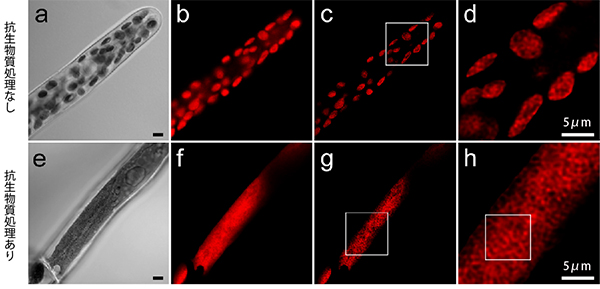
図2 ヒメツリガネゴケの葉緑体ライブセルイメージング
- a: 原糸体細胞の明視野顕微鏡画像。
- b: 共焦点レーザー顕微鏡を使ってクロロフィル蛍光を検出することで原糸体細胞内の葉緑体のみを観察することができる。丸く見える一粒が1つの葉緑体。
- c: bの画像から、コンピューター画像処理によって非焦点ボケを除くと、葉緑体の内部の様子を観察することができる。
- d: cの四角で囲った部分の拡大図。1つの葉緑体の内部に構造があることが分かる。
- e: 葉緑体は、抗生物質(アンピシリン)で処理することで1つの大きな葉緑体を形成する。
- f: bと同様に、eのクロロフィル蛍光を観察した顕微鏡画像。
- g: cと同様に、fの非焦点ボケを除去した顕微鏡画像。
- h: gの四角で囲った部分の拡大図。葉緑体を大きくすることで、葉緑体内部の構造をより鮮明に観察することができる。
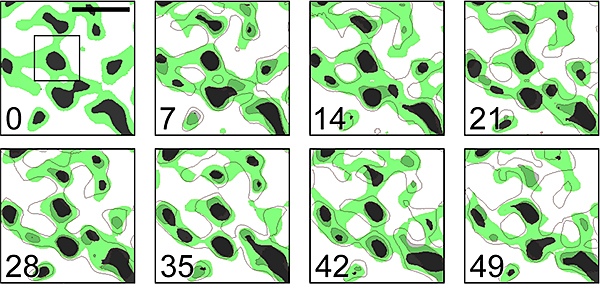
図3 ヒメツリガネゴケのチラコイド膜構造の経時的変化
葉緑体内部のチラコイド膜の構造を時間を追って観察し、構造変化を観察した。また、蛍光強度の違いから三次元構造を推測し、グラナとストロマラメラを判別した。黒色で示した部分はグラナの構造で、緑色で示したのはストロマラメラの構造。数字は観察時間(単位は秒)。7秒以降の各パネルに、1つ前で観察された膜構造を半透明で重ね合わせて表示することで、どれだけ構造が変化したのかを確認している。グラナの構造は形が変わっているが、位置はほとんど変化していない。一方、ストロマラメラは、7秒ごとにその形状が大きく変化していることが確認できた。スケールバーは2μm。
