ポイント
- Rre37タンパク質を細胞内で増やすとバイオプラスチック生産量が約2倍に増加
- Rre37とSigEタンパク質を同時に増やすと生産量が約3倍に増加
- ラン藻における代謝の制御機構を明らかにし基礎と応用の両面で研究を推進
要旨
理化学研究所(理研、野依良治理事長)は、光合成を行う微生物「ラン藻」の遺伝子を改変し、バイオプラスチックの1種「ポリヒドロキシ酪酸(PHB)[1]」の生産量を通常のラン藻に比べて約3倍増加させることに成功しました。これは、理研環境資源科学研究センター(篠崎一雄センター長)代謝システム研究チームの小山内崇客員研究員(JSTさきがけ専任研究者)、平井優美チームリーダーと酵素研究チームの沼田圭司チームリーダー、統合メタボロミクス研究グループの斉藤和季グループディレクター、及川彰客員研究員(山形大准教授)らの研究グループの成果です。
微生物によって合成されるPHBは、天然のポリエステルと呼ばれるバイオプラスチックです。生物由来で、かつ生分解性を有するため、環境問題や資源問題の解決に貢献すると期待されています。しかし、これまでのPHB生産法では、細菌の培養に使う糖の価格変動が大きく、コスト面の問題がありました。そこで、研究グループは、ラン藻を用いた低コストで安定的なPHB生産法の開発に取り組みました。
研究グループはこれまでの研究から、環境変動に合わせ細胞を適切に変化させる「レスポンスレギュレーター[2]」の1つで、ラン藻の炭素代謝を制御するタンパク質「Rre37」[3]が、PHB生産に関与する可能性を見いだしていました。そこで、細胞内でRre37の量を増やすラン藻を遺伝子改変によって作製し、PHBの合成を行いました。その結果、PHBの生産量が通常のラン藻に比べて約2倍に増加しました。また、研究グループが以前に発見したPHBの合成を促進する働きをもつタンパク質「SigE」[4]を細胞内で同時に増やしたところ、PHBの生産量が約3倍に増加しました。
今回の成果は、微細藻類による二酸化炭素からのPHB生産の基盤作りにつながります。また、Rre37はPHB合成だけでなく、糖代謝や新しいハイブリッド型の代謝回路を制御するという興味深い事実も明らかになりました。今後、ラン藻のPHB生産メカニズムの理解を深めることで、さらなるバイオプラスチックの増産につながると期待できます。
本研究成果は、JST戦略的創造研究推進事業個人型研究さきがけ(藻類・水圏微生物の機能解明と制御によるバイオエネルギー創成のための基盤技術の創出)の一環として行われ、米国の科学雑誌『Plant Physiology』のオンライン版(2月12日)に掲載されました。
背景
プラスチックは、化石燃料から生産されることや、環境中で分解されないなど、環境負荷が大きく、資源の持続的な活用の面でも問題があると指摘されています。一方、バイオプラスチックは、生物由来で合成されるバイオマスプラスチックと、環境中で分解される生分解性プラスチックのいずれかの特性を持っています。代表的なバイオプラスチックの1つポリヒドロキシアルカン酸(PHA)[5]は、両方の特性を併せ持つ材料です。しかし、現状では糖や油脂を原料としているため価格変動の影響を受けやすく、生産コストが化石由来のプラスチックに比べて高い、また、強度・耐久性が低いなどの問題があるため、広範な利用には至っていません。
光合成を行う微生物「ラン藻」は、窒素やリンの欠乏時に、光と二酸化炭素だけでPHAの1種であるポリヒドロキシ酪酸(PHB)を合成します(図1)。ラン藻を用いた効率的なPHBの生産方法を確立できれば、二酸化炭素を原料とした安定的なプラスチック供給が可能となるため、環境問題を解決できると期待されています。
そこで、研究グループは、多数のラン藻の種の中で広く研究されている「Synechocystis sp. PCC 6803(シネコシスティス)[6]」に着目し、PHBの増産を目指しました。
研究手法と成果
シネコシスティスは、相同組換えによる遺伝子改変が可能、他の藻類に比べて増殖が速いなど、多くの利点があります。また、研究グループのこれまでの研究から、PHBの合成酵素遺伝子の転写を活性化する因子としてタンパク質「Rre37」が示唆されていました。Rre37は、環境変動に合わせ細胞を適切に変化させる「レスポンスレギュレーター」であり、窒素欠乏時にその量が増えることが知られています。
そこで、シネコシスティスの遺伝子を改変し、Rre37過剰発現株(Rre37の量が増加したシネコシスティス)を作製して、窒素欠乏後のPHB生産量を調べました。その結果、対照株(通常のシネコシスティス)に比べてPHB生産量が約2倍増加しました(図2)。
次に、研究グループが以前発見したPHBの合成を促進する働きをもつタンパク質「SigE」とRre37の二重過剰発現株(SigE とRre37の量が同時に増加したシネコシスティス)を作製して、PHB生産量を調べました。その結果、対照株に比べてPHB生産量が約3倍増加することが明らかになりました(図2)。
Rre37過剰発現によるPHB生産量の増加の原因を調べたところ、Rre37は、PHBの合成だけでなく、細胞内の代謝を全体的に制御していることが分かりました(図3)。PHBは、アセチルCoAという物質から3段階で合成されます。アセチルCoAは、炭素の貯蔵源であるグリコーゲンから解糖系を経て供給されます。本研究により、Rre37は、PHBの合成酵素遺伝子の転写を活性化するとともに、グリコーゲンの分解や解糖系の酵素の遺伝子発現を増加させることが明らかになりました。生化学的解析により、分解酵素をつくるグリコーゲンホスホリラーゼ(GlgP)遺伝子のプロモーター(遺伝子を発現させる機能を持つ塩基配列)領域に、Rre37が直接結合することが分かりました。
また、マイクロアレイを用いたトランスクリプトーム解析[7]を行ったところ、Rre37が、PHB合成酵素やグリコーゲン分解酵素以外の酵素も制御していることが分かりました。得られた結果を考察したところ、炭素の代謝で有名なクエン酸回路[8]とオルニチン回路[9]が混ざった回路の存在が示唆されました(図3)。この回路が窒素欠乏時に働くと、2分子のアンモニアが窒素源として効率的に取り込まれることから、窒素欠乏時のラン藻は、Rre37を用いて、この「ハイブリッド型の回路」を促進する可能性が示唆されました。
今後の期待
本成果により、Rre37を使った新しいPHB増産方法が発見されました。今後は実用化に向けて、さらなる生産量の増加を目指した研究が必要です。実用化に向けては、低コストでのラン藻培養法や回収法、効率的なPHBの抽出・精製法の開発なども求められます。
また、本成果により、新しい代謝回路の存在が示唆されました。新しい代謝回路の発見は学術的重要性のみならず、さらなる物質の増産を目指す代謝工学の面からも大きな意味があります。本研究では、Rre37という制御因子を解析することにより、ラン藻のバイオプラスチック増産という応用研究と、代謝メカニズムの解明という基礎研究を同時に進めることが可能であることを示しました。
原論文情報
- Takashi Osanai, Akira Oikawa, Keiji Numata, Ayuko Kuwahara, Hiroko Iijima, Yoshiharu Doi, Kazuki Saito, Masami Yokota Hirai. "Pathway-Level Acceleration of Glycogen Catabolism by Response Regulator Rre37 in the Cyanobacterium Synechocystis sp. PCC 6803".Plant Physiology, 2014,doi: 10.1104/pp.113.232025
発表者
理化学研究所
環境資源科学研究センター 統合メタボロミクス研究グループ 代謝システム研究チーム
チームリーダー 平井 優美 (ひらい まさみ)
客員研究員 小山内 崇 (おさない たかし)
お問い合わせ先
環境資源科学研究推進室
Tel: 048-467-9449 / Fax: 048-465-8048
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.ポリヒドロキシ酪酸(PHB)
バイオプラスチックであるポリヒドロキシアルカン酸(PHA)の1種で、主に微生物によって生産される3-ヒドロキシ酪酸のポリマー(ポリエステル)。微生物は、窒素やリンの欠乏時に、炭素およびエネルギーの貯蔵源としてPHBを合成する。 - 2.レスポンスレギュレーター
外部の環境変動を感知して、細胞を適切に変化させる役割を持つタンパク質。多くの場合、転写因子としてDNAに結合し、遺伝子の転写を制御する。 - 3.タンパク質「Rre37」
ラン藻に存在するレスポンスレギュレーターの1つ。過去の研究から、窒素欠乏時にタンパク質量が増加することが知られていた。 - 4.タンパク質「SigE」
ラン藻の1種であるシネコシスティスが有する9つのRNAポリメラーゼシグマ因子の内の1つ。シグマ因子とは、RNAポリメラーゼ内でDNAに結合し、遺伝子の転写を開始する働きを持つタンパク質。研究グループは、SigEは糖代謝の制御因子であるほか、PHBの合成を促進することを発見した。
参考: 2013年7月16日プレスリリース「ラン藻が作るバイオプラスチックの増産に成功」 - 5.ポリヒドロキシアルカン酸(PHA)
微生物が作るポリエステルの1種。生分解性を有し、側鎖の組成によってさまざまな性質を持つことができるバイオプラスチック。 - 6.Synechocystis sp. PCC 6803(シネコシスティス)
淡水性のラン藻。単細胞性の球菌で、直径が約1.5~2.5マイクロメートル。窒素固定を行わないラン藻である。ラン藻種の中で、最初に全ゲノム配列が決定された。相同組換えによる遺伝子改変が可能であることからモデルラン藻として広く研究されている。 - 7.トランスクリプトーム解析
細胞内の転写産物量(mRNA量)を網羅的に測定する解析。 - 8.クエン酸回路
トリカルボン酸回路、TCA回路、クレブス回路とも呼ばれる。アセチルCoAとオキサロ酢酸からクエン酸を合成する反応から始まる一連の代謝経路。呼吸に用いられる還元力を生産するとともに、二酸化炭素を生成する。 - 9.オルニチン回路
尿素回路とも呼ばれる。オルニチンは、グルタミン酸から2段階の反応で合成される。通常のオルニチン回路では、オルニチンからシトルリン、アルギノコハク酸を経て、フマル酸とアルギニンが合成され、アルギニンが尿素とオルニチンになり、尿素は排出され、オルニチンが代謝回路に戻る。ラン藻などの細菌では、酵素がそろっておらず、オルニチン回路が「回路」として完成していないことも多い。

図1 窒素欠乏条件でのラン藻培養とPHB
ラン藻の培養液は通常緑色をしているが、窒素が枯渇すると、集光装置であるフィコビリソームを分解して黄色になる。この時にPHBが合成される。窒素源が枯渇したラン藻を回収し、凍結乾燥した後、有機溶媒などを用いてPHBを抽出、精製した。
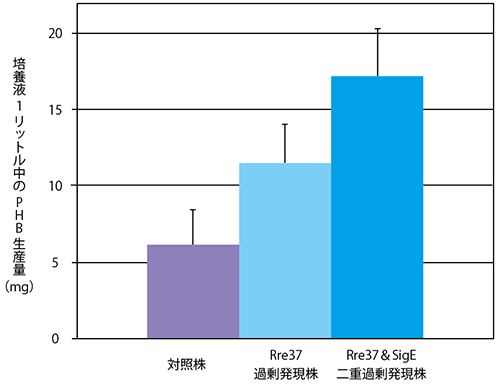
図2 Rre37タンパク質量増加によるPHB増産
窒素欠乏条件で培養したラン藻から抽出したPHB生産量の比較。Rre37過剰発現株では、対照株(野生株)の約2倍、Rre37とSigEの二重過剰発現株では約3倍に増加した。
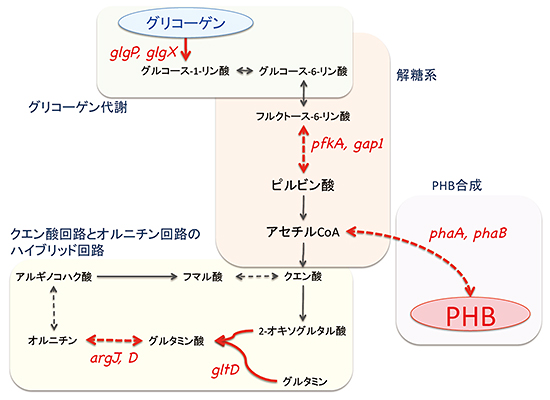
図3 Rre37によって制御される遺伝子の代謝地図
トランスクリプトーム解析より明らかになったRre37の制御下にある遺伝子を、代謝地図上に記載した。PHB合成だけでなく、グリコーゲン代謝、解糖系の遺伝子を制御している。また、クエン酸回路とオルニチン回路の遺伝子も制御していた。メタボローム解析の結果と合わせると、ラン藻は窒素欠乏時に、クエン酸回路とオルニチン回路のハイブリッド回路という新しい代謝回路を活性化する可能性が示唆された。
