2014年3月6日
独立行政法人理化学研究所
公益財団法人東京都医学総合研究所
タンパク質分解酵素複合体「プロテアソーム」の動態を解明
-蛍光相関分光法を使い生きた細胞内で直接観察-
ポイント
- 細胞内のプロテアソームはほとんどが完成した巨大な酵素複合体として存在する
- プロテアソームは細胞質で完成し核内に運ばれる
- 細胞質と核内でそれぞれ異なった相手分子と強く相互作用している
要旨
理化学研究所(理研、野依良治理事長)と東京都医学総合研究所(都医学研、田中啓二所長)は、細胞内の巨大タンパク質分解酵素複合体「プロテアソーム[1]」の細胞内動態を解析し、プロテアソームが細胞質で完成した後に核内に運ばれることを明らかにしました。これは、理研佐甲情報研究室の白燦基(ベク・チャンギ)協力研究員と、都医学研蛋白質代謝研究室の田中啓二所長、佐伯泰副参事研究員、千葉大学真菌医学研究センターの東江昭夫客員教授、東京大学大学院薬学系研究科の村田茂穂教授、愛知学院大学薬学研究科の横沢英良教授、マックスプランク研究所(ドイツ)のヴォルフガング・バウマイスター教授らの共同研究グループによる成果です。
プロテアソームは、ユビキチン化[2]されたタンパク質を選択的に分解する巨大な酵素複合体です。主に、細胞内のタンパク質恒常性の維持に中心的な役割を果たし、細胞周期制御や免疫応答、シグナル伝達などに関わっています。近年、プロテアソーム機能の破綻が神経変性疾患などさまざまな難治性疾患を引き起こすことや、プロテアソーム阻害剤[3]が血液がんに有効であることが明らかになり、臨床面からも注目されています。
プロテアソームは約66個のサブユニットタンパク質で形成されますが、細胞内のどこで完成するのか、完成した複合体がどのように存在するのかなど、細胞内における性質や動態はほとんど分かっていませんでした。
共同研究グループは、蛍光タンパク質(GFP、mCherry)をプロテアソームに結合させた酵母細胞を作製し、蛍光のゆらぎを測定する蛍光相関分光法[4]を用いて生きた細胞内で直接その動態を解析しました。その結果、ほぼ全てのサブユニットタンパク質は、完成したプロテアソームに取り込まれ、完成後は安定に存在すること、さらに細胞質や核内のプロテアソームの約半数は、何らかの細胞小器官や転写マシナリー[5]と相互作用していることが明らかになりました。また、プロテアソームは核内で形成されると考えられてきましたが、細胞質で完成した後に核に移行することが明らかとなりました。動態が解明されたことから、今後、プロテアソームの動きを阻害する物質を発見できれば、創薬にもつながるものと期待できます。
本研究成果は、英国のオンライン科学誌『Nature Communications』(3月6日付け:日本時間3月6日)に掲載されます。
背景
プロテアソームは、ユビキチン化されたタンパク質を選択的に分解する巨大な酵素複合体で、細胞内のタンパク質恒常性の維持に中心的な役割を果たしています(図1)。近年、プロテアソーム機能の破綻が神経変性疾患などさまざまな難治性疾患を引き起こすことや、プロテアソーム阻害剤が血液がんに有効なことが明らかになっており、プロテアソームは基礎研究だけでなく臨床面からも注目されています。
プロテアソームは約66個のサブユニットタンパク質で形成されていますが、プロテアソームが細胞内のどこで完成するのか、完成したプロテアソームがどの程度存在するのか、あるいはどのように存在するのかなど、細胞内における動態はほとんど分かっていませんでした。
研究手法と成果
共同研究グループは、蛍光タンパク質(GFP、mCherry)をプロテアソームに結合させた酵母細胞を作製し、蛍光のゆらぎを測定する蛍光相関分光法によって、生きた細胞内でプロテアソームの動態を解析しました(図2)。その結果、①プロテアソームのほぼ全てのサブユニットタンパク質は完成したプロテアソーム複合体に取り込まれていること、②完成したプロテアソームは安定に存在すること、③細胞質のプロテアソームの約半数は何らかの細胞小器官(ミトコンドリア、小胞体、ゴルジ体など)と相互作用していること、④核内では転写因子や染色体などの転写マシナリーと相互作用していることが明らかとなりました。また、細胞内のプロテアソームの濃度を測定した結果、細胞質では約200nM(1nMは10-9mol/ℓ)、核質では約1μM(1μMは10-6mol/ℓ)でした。
さらに、細胞質核間輸送担体インポーティン[6]の変異体などを用いて、核内にプロテアソームが運ばれない状況にして細胞質の解析を行った結果、これまで核内で形成されると考えられてきたプロテアソームは、実は細胞質で完成した後に核内に移行することが明らかになりました(図3)。
今後の期待
今回、共同研究グループは、出芽酵母のプロテアソームについて解析を行いました。その結果、核内では遺伝子の転写に関わっていることが示されました。今後、プロテアソームが細胞質でどの細胞小器官と相互作用しているか、細胞質および核内におけるプロテアソーム濃度のバランスがどのように維持されているかを解明していく予定です。将来的には、プロテアソームの細胞内動態を制御する新しいコンセプトのプロテアソーム調節剤の開発を目指します。
原論文情報
- Pack C.-G. et al. "Quantitative Live-Cell Imaging Reveals Spatio-Temporal Dynamics and Cytoplasmic Assembly of the 26S Proteasome".
Nature Communications, 2014, doi:10.1038/ncomms4396
発表者
理化学研究所
主任研究員研究室 佐甲細胞情報研究室
協力研究員 白 燦基(ベク チャンギ)
公益財団法人東京都医学総合研究所 蛋白質代謝研究室
副参事研究員 佐伯 泰(さえき やすし)
報道担当
独立行政法人理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
公益財団法人東京都医学総合研究所 事務局 研究推進課
Tel: 03-5316-3109 / Fax: 03-5316-3150
補足説明
- 1.プロテアソーム
細胞質や核内の不要なタンパク質を分解する約2.5MDa(直径20nm、長さ45nmの棒状分子)の巨大な酵素複合体。ポリユビキチン鎖により標識されたタンパク質を選択的に分解することで様々な生命現象を制御する。 - 2.ユビキチン化
タンパク質の翻訳後修飾に使われる小さいタンパク質を「ユビキチン」という。タンパク質分解、DNA修復、転写調節、シグナル伝達など広範な生命現象に関わる。「ユビキチンによるタンパク質の翻訳後修飾(ユビキチン化)」は、2004年のノーベル化学賞の受賞対象となった。複数のユビキチンが連結したユビキチン化(ポリユビキチン化)は、プロテアソームの分解シグナルとなる。 - 3.プロテアソーム阻害剤
プロテアソームの酵素活性中心を選択的に阻害する化合物のこと。Bortezomib(Velcade®;ベルケード)とCarfilzomb(Kyprolis®;カイプロリス)は、血液がんの一種である多発性骨髄腫の治療薬として用いられている。 - 4.蛍光相関分光法
共焦点光学系を用いて微小空間における蛍光のゆらぎを高感度に測定する手法。溶液中や細胞内の蛍光分子の絶対濃度や大きさ、形状などを決定する。2色の蛍光タグを用いることで2種類の異なる分子間の相互作用の強さを測定することができる。 - 5.転写マシナリー
染色体内のDNAをmRNAにコピーするために必要とされるさまざまな転写因子タンパク質群。 - 6.輸送担体インポーティン
細胞質と核は核膜によって隔てられ、核膜には核膜孔(直径約38nm)が存在する。核膜孔は分子の出入りを大きさで制御しており、核膜孔を出入りするには核局在信号(nuclear localization signal、NLS)という特定のシグナルアミノ酸配列が必要である。インポーティンはNLSに結合して、ターゲットタンパク質を細胞質から細胞核の中に運び込む役割を担う輸送タンパク質。
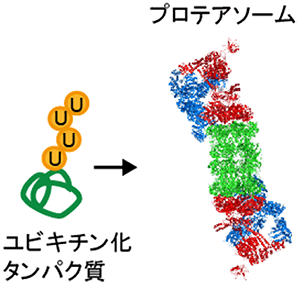
図1 プロテアソームの模式図
プロテアソームはユビキチン化されたタンパク質を分解する巨大な酵素複合体。細胞内のタンパク質恒常性の維持に中心的な役割を果たしている。
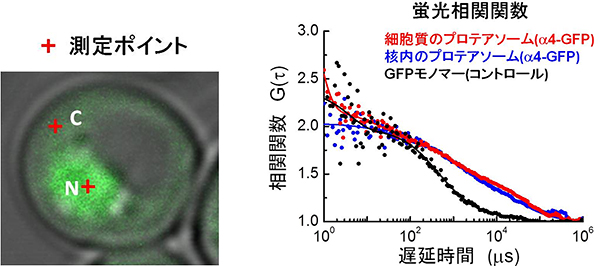
図2 蛍光相関分光法によるプロテアソームの動態解析
- 左: 蛍光タンパク質のGFPをプロテアソームに結合させた酵母細胞の蛍光顕微鏡像。Cは細胞質、Nは核内。
- 右: プロテアソーム複合体の蛍光相関関数。
相関関数の解析からGFP単体は細胞内で一種類の動態(黒)を示すことに対して、大きく右にシフトしたプロテアソームの細胞質(赤)と核内(青)の相関関数からはそれぞれ二種類の動態が示された。一種類目は完成したプロテアソームの自由拡散運動、二種類目は細胞小器官または核内の転写因子とのそれぞれの相互作用による遅い拡散運動を示す。これらのことから、細胞質のプロテアソームは何らかの細胞小器官と相互作用していること、核内のプロテアソームは転写因子や染色体などの転写マシナリーと相互作用していることが分かった。
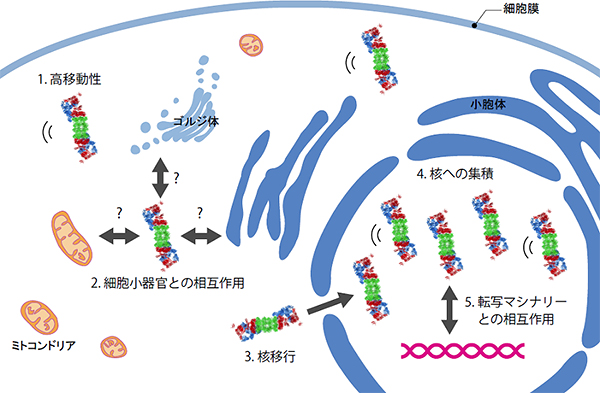
図3 今回明らかとなったプロテアソームの細胞内動態
- 1.細胞質で完成したプロテアソームは速い拡散運動で細胞全体に広がる
- 2.さまざまな細胞質の細胞小器官と相互作用しながら拡散する。
- 3.4.横になって核膜孔を通って核内まで運ばれる。
- 5.核内では転写因子と常に相互作用している。
