ポイント
- 植物の免疫センサーが活性酸素を生成する酵素と複合体を形成することを発見
- 免疫センサーはリン酸化酵素を介して活性酸素生成酵素をリン酸化し活性化する
- 防御応答時における活性酸素生成の発見から約30年、分子機構が初めて明らかに
要旨
理化学研究所(理研、野依良治理事長)は、植物が病原菌侵入を認識した後に、迅速に活性酸素[1]を生成し、病原菌を撃退する仕組みを分子レベルで解明しました。これは理研環境資源科学研究センター(篠崎一雄センター長)植物免疫研究グループの白須賢グループディレクターと、英国セインズベリー研究所の門田康弘研究員(元 理研植物免疫研究グループ基礎科学特別研究員)、シリル・ジップフェル シニアグループディレクターらとの共同研究グループによる成果です。
将来予想される爆発的な人口増加などの問題から、耐病性作物の創出による食糧生産の増大に大きな期待が寄せられています。植物は細胞膜型免疫センサー[2]で病原菌の侵入を認識し、活性酸素の生成や病原菌の侵入経路の閉鎖、抗菌性物質の合成といったさまざまな防御応答を誘導します。しかし、この免疫センサーがどのように細胞内で情報を流し、これらの防御応答を誘導するのか、その詳細な仕組みは解明されていませんでした。
共同研究グループが、免疫センサーと複合体を形成する因子を探索したところ、活性酸素を生成する酵素「RBOHD[3]」が見つかりました。病原菌の感染直後に活性酸素の生成が誘導されることはおよそ30年前に発見されました。活性酸素の生成は、病害抵抗性に重要な役割を担うことが示唆されていましたが、その仕組みの全貌は長年謎のままでした。そこで、免疫センサーから活性酸素生成までの情報の流れを詳細に解析したところ、免疫センサーは「BIK1[4]」という因子を介してRBOHDをリン酸化し活性化させ、活性酸素を生成する防御応答を誘導することが分かりました。さらに、BIK1を介してRBOHDにより生成された活性酸素は、毒性因子として直接病原菌を攻撃するだけでなく、情報を伝達する因子として働き、病原菌の主な侵入経路である気孔を閉じて病原菌の侵入を防ぐことが分かりました。
本研究で、免疫センサーから防御反応の1つである活性酸素生成までの情報の流れを解明したことは、今後の免疫センサーの情報伝達研究の根幹をなす重要な知見になります。成果は、米国の科学雑誌『Molecular Cell』(4月10日号)に掲載されるに先立ち、オンライン版(3月12日付け:日本時間3月13日)に掲載されます。
背景
植物は、病原菌が共通に持つべん毛タンパク質や細胞壁構成因子などの物質を細胞膜型免疫センサーで認識し、病原菌の侵入を感知します。植物は病原菌の侵入を認識すると、数分以内に感染部位に活性酸素を生成します。その後、数時間以内に病原菌の主な侵入経路である気孔を閉鎖するとともに、感染部位の細胞壁を強化することで感染の拡大を阻止します。さらに数時間から数十時間で抗菌性物質を合成し、感染部位に放出して病原菌を撃退すると考えられています。しかし、免疫センサーがどのように細胞内で情報を流し、これらの防御応答を誘導するのか、その仕組みについては明らかになっていませんでした。そこで、共同研究グループは、免疫センサーと複合体を形成する因子を探索し、免疫センサーからの情報の流れの解明を試みました。
研究手法と成果
アブラナ科の植物では、免疫センサー「EFR(EF-Tu receptor)[5]」が病原細菌の伸長因子Tu(EF-Tu:elongation factor Tu)由来のペプチドelf18を認識します(図1①)。EFRはリン酸化酵素としての活性を持ち、elf18を認識するとリン酸化酵素「BAK1[6]」と結合して互いにリン酸化し合うことで活性化されます(図1②)。活性化されたEFRとBAK1は、リン酸化酵素「BIK1」をリン酸化し、活性化することが報告されています(図1③)。
共同研究グループは、共免疫沈降法[7]と液体クロマトグラフィー質量分析法(LCMSMS)[8]解析を用いてEFRと複合体を形成する因子を探索しました。その結果、活性酸素生成を担う「RBOHD (Respiratory Burst Oxidase Homologue D)」が見つかりました。次に、生化学的解析を行ったところ、EFRとBAK1により活性化されたBIK1がRBOHDに直接結合してリン酸化することが分かりました。さらに、LCMSMS解析により、BIK1によるRBOHDのリン酸化部位の同定を行い、BIK1はRBOHDの3カ所のセリン[9](S39、S339、S343)を特異的にリン酸化することを発見しました(図1④)。そこで、これらのリン酸化部位をアラニン[9]に置換したところ、EFRがelf18を認識することにより誘導される活性酸素生成は起こらなくなりました(図2)。これらの結果から、活性酸素生成にはBIK1によるRBOHDのリン酸化が必須であることが明らかとなり(図1⑤)、免疫センサーから防御反応の1つである活性酸素の生成までの情報の流れが、初めて分子レベルで解明されました。
また、RBOHDにより生成された活性酸素は毒性因子として病原菌を直接攻撃するだけでなく、情報を伝達する因子として病原菌の主な侵入経路である気孔を閉じさせるのに重要な役割も担います(図1⑥)。実際に、BIK1によりリン酸化されるRBOHDの3カ所のセリンをアラニンに置換した植物は、elf18や細菌のべん毛タンパク質由来のペプチドflg22を認識しても気孔を閉鎖できませんでした(図3)。また、病原細菌に対する抵抗性も低下し、細菌の増殖を抑えられませんでした(図4)。このことから、免疫センサーによるBIK1を介したRBOHDのリン酸化は、活性酸素の生成、及び植物の病害抵抗性に極めて重要であることが分かりました。
今後の期待
本研究により、免疫センサーから防御反応の1つである活性酸素の生成までの情報の流れが、初めて分子レベルで解明されました。この成果は、免疫センサーからの情報伝達経路を研究する上で根幹となる重要な知見になります。また、RBOHを介した活性酸素生成は病害応答だけでなく、さまざまな器官形成、環境ストレス応答(乾燥、塩害、高温、傷害など)や病害虫応答などにも重要な役割を果たします。解明されたRBOHの新規制御機構はこれらの生理現象を誘導する分子機構の解明にも貢献すると期待できます。今後、BIK1によるRBOHDのリン酸化が、RBOHDの立体構造やその他の制御に及ぼす影響を調べることにより、BIK1によるリン酸化からRBOHDの活性化までの詳細な分子機構が明らかになると思われます。
原論文情報
- Yasuhiro Kadota, Jan Sklenar, Paul Derbyshire, Lena Stransfeld, Shuta Asai, Vardis Ntoukakis, Jonathan DG Jones, Ken Shirasu, Frank Menke, Alexandra Jones, Cyril Zipfel1."Direct regulation of the NADPH oxidase RBOHD by the PRR-associated kinase BIK1 during plant immunity" Molecular Cell, 2014,doi:10.1016/j.molcel.2014.02.021
発表者
理化学研究所
環境資源科学研究センター 植物免疫研究グループ
グループディレクター 白須 賢(しらす けん)
お問い合わせ先
環境資源科学研究推進室
Tel: 045-503-9471 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.活性酸素
酸素分子がより反応性の高い化合物に変化したもの(O2¯、H2O2など)。生体内のエネルギー代謝や感染防御過程で発生する。毒性因子として、脂質の酸化、DNAやタンパク質の損傷を引き起こす一方、情報伝達因子としてさまざまな生命現象に重要な役割を果たす。1983年に名古屋大学の道家紀志博士により、植物が病原菌を感染すると活性酸素を生成することが発見された (Doke, Physiol. Plant Pathol. 23, 345–357,1983)。その後、世界中で研究が行われ、現在では活性酸素生成は病害応答の最も特徴的な反応の1つと考えられている。 - 2.細胞膜型免疫センサー
細胞膜に局在するPRR ( Pattern Recognition Receptors) のこと。病原菌が共通に持つPAMPs ( Pathogen- Associated Molecular Pattern s) と総称される物質(べん毛タンパク質、細胞壁構成因子など)を認識し防御反応を誘導する。この防御システムにより、植物は自然界の大多数の微生物に対して耐性を持つ。 - 3.RBOHD
RBOHは R espiratory Burst Oxidase Homolog Dの略。活性酸素の一種であるスーパーオキシドアニオン(O2¯)を生成する酵素。モデル実験植物のシロイヌナズナは10個の Rboh遺伝子を持ち、そのうち病原菌応答における活性酸素生成にRBOHDが主要な役割を果たす。また、RBOHによる活性酸素生成は病原菌応答だけではなく、種子の成熟、側根や根毛の形成、花粉の発芽や成長、植物ホルモンのアブシジン酸による気孔の閉鎖、環境ストレス応答(乾燥、塩害、高温、傷害など)や害虫に対する防御反応など、多様な生理現象に関わることが知られている。 - 4.BIK1
受容体型細胞質タンパク質リン酸化酵素(RLCK: receptor- like cytoplasmic kinase)の1つ。 Botrytis- Induced Kinase 1の略。Botrytis cinereaという糸状菌の感染により、迅速に発現するリン酸化酵素として同定された。その後の研究によって、BIK1は細胞膜型免疫センサーと結合し、病原菌の認識後には細胞膜型免疫センサー複合体によりリン酸化され活性化されることが明らかとなり、細胞膜免疫センサーの情報伝達系において重要な役割を果たすと考えられている。しかし、これまでBIK1によりリン酸化される情報伝達系の下流因子は同定されておらず、本研究で解明したRBOHDが最初の例となる。 - 5.EFR (EF-Tu receptor)
モデル植物であるシロイヌナズナが持つ細胞膜型免疫センサーの1つ。EFRは細胞膜に局在し、細胞外にロイシンリッチリピートを、細胞内にタンパク質リン酸化ドメインを持つ。細菌の伸長因子Tuに高度に保存されている18個のアミノ酸残基からなるペプチドelf18を認識する。 - 6.BAK1
BRI1 Associated receptor Kinase 1の略。受容体型タンパク質リン酸化酵素の1つで、植物ホルモン、ブラシノステロイド受容体と結合する因子として同定された。その後の研究により、BAK1は病原菌認識時に細胞膜型免疫センサーと結合して、免疫センサーの活性化やBIK1などの下流因子の活性化に重要な役割を果たすことが明らかにされた。 - 7.共免疫沈降法
特異抗体を用いて細胞抽出液から目的とするタンパク複合体を精製する方法。タンパク質相互作用因子の探索や相互作用の確認などに一般的に用いられる。 - 8.液体クロマトグラフィー質量分析法(LCMSMS)
固定相と移動相との親和性の差を利用して物質を分離し、分離したものを質量分析器で検出することで定性・定量を行う分析手法。タンパク質をトリプシンというタンパク質分解酵素で分解し、液体クロマトグラフィー質量分析法で解析することでペプチドの質量や部分配列情報を得られ、これをもとにタンパク質の同定を行うことができる。 - 9.セリン、アラニン
セリンとアラニンはアミノ酸の1つ。リン酸化とはタンパク質にリン酸基を付加する反応であり、生物に存在する重要なタンパク質の調節機構の1つである。真核生物において、リン酸化はタンパク質を構成するセリン、スレオニン、そしてチロシンの残基に起きる。このリン酸化が及ぼす影響を調べる方法の1つとして、リン酸化されるアミノ酸残基の置換がある。リン酸化されるアミノ酸残基をアラニンなどの他のアミノ酸残基へと置換してリン酸化反応を阻害し、その影響を調べることでリン酸化が及ぼす影響を明らかにする。
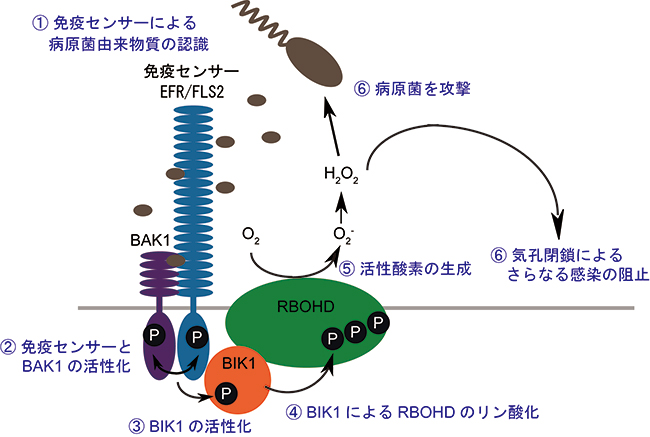
図1 病原菌侵入の認識から活性酸素生成までの仕組み
- ① 免疫センサー「EFR」が病原菌由来物質を認識する。
- ② EFRはリン酸化酵素「BAK1」と結合し互いにリン酸化することで活性化される。
- ③ EFRとBAK1はリン酸化酵素「BIK1」をさらにリン酸化して活性化する。
- ④ 活性化されたBIK1はRBOHDと強く結合し、RBOHDの3カ所のセリン(S39, S339, S343)をリン酸化する。
- ⑤ このリン酸化が引き金となってRBOHDが活性化され、活性酸素が生成される。
- ⑥ 生成された活性酸素は毒性因子として直接病原菌を攻撃するとともに、気孔の閉鎖を誘導してさらなる感染を阻止する。
※④~⑥が今回解明した分子機構と活性酸素の役割。この情報伝達は、細菌のべん毛タンパク質を認識する免疫センサー「FLS2」でも同じである。
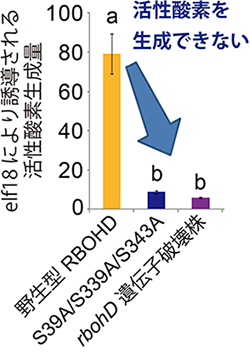
図2 BIK1によるRBOHDのリン酸化部位に変異を導入した植物体の活性酸素生成
BIK1によるRBOHDのリン酸化部位である3カ所のセリン(S39, S339, S343)をアラニンに置換した植物体(S39A/S339A/S343A)は、病原細菌の伸長因子Tu由来のペプチドelf18を認識しても活性酸素を生成しなかった。また、RBOHDを作る遺伝子を破壊した植物体も同様の結果となった。
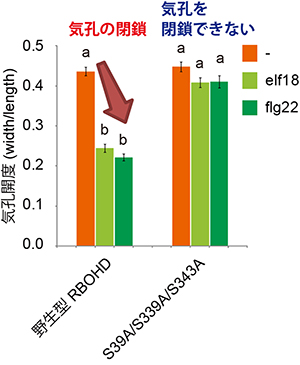
図3 BIK1によるRBOHDのリン酸化部位に変異を導入した植物体の気孔の閉鎖
BIK1によるRBOHDのリン酸化部位に変異を持つ植物(S39A/S339A/S343A)は、病原細菌の伸長因子Tu由来のペプチドelf18やべん毛タンパク質由来のペプチドflg22を認識しても気孔の閉鎖を誘導しなかった。
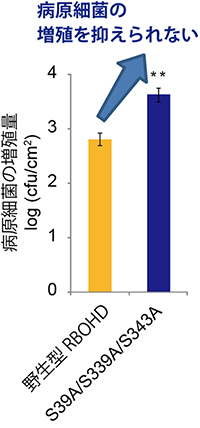
図4 BIK1によるRBOHDのリン酸化部位に変異を導入した植物体の病原体への抵抗性
BIK1によるRBOHDのリン酸化部位に変異を持つ植物(S39A/S339A/S343A)は、病原菌(Pseudomonas syringaepv. cilantro)に対する抵抗性が低下し、細菌の増殖を抑えられなかった。
