2014年6月24日
理化学研究所
ヒトiPS細胞の分化多能性を維持・向上させる新たな因子を発見
-フィーダー細胞を使わずヒトiPS細胞の安定した培養を可能に-
ポイント
- ヒトiPS細胞の分化多能性を向上させるタンパク質CCL2を発見
- 低酸素状態で働く遺伝子群の活性化が多能性に関与している可能性を示唆
- ヒトiPS細胞の基礎研究や医療技術への応用に期待
要旨
理化学研究所(理研、野依良治理事長)は、「CCL2」と呼ばれるタンパク質がヒトiPS細胞(人工多能性幹細胞)[1]の分化多能性[2]を維持、向上させることを発見し、その機能に関与する遺伝子群の存在を明らかにしました。これは、理研ライフサイエンス基盤研究センター(渡辺恭良センター長)機能ゲノム解析部門(ピエロ・カルニンチ部門長)の鈴木治和グループディレクター、長谷川由紀副チームリーダーらの研究グループによる成果です。
ヒトiPS細胞とマウスiPS細胞では、性質に大きな違いがあります。マウスiPS細胞は分化多能性が高く、白血病阻止因子(LIF)[3]を培養液中に添加することで、幹細胞の培養条件を整えるフィーダー細胞[4]を使わずに分化多能性を維持したまま培養可能です。一方、ヒトiPS細胞は、塩基性線維芽細胞増殖因子(bFGF)[5]を添加し、さらにフィーダー細胞上で培養しないと分化多能性を失ってしまいます。
これまでに研究グループは、マウスiPS/ES細胞でフィーダー細胞の有無で発現に違いがあった遺伝子を調べ、CCL2を見いだしており、CCL2を培地に添加すると分化多能性が向上することを確認していました。
今回、ヒトiPS細胞の培養においてbFGFの代わりにCCL2を添加したところ、bFGFの場合に比べて多能性マーカー遺伝子[6]の発現が顕著に上昇しました。次に、CCL2添加下、bFGF添加下で培養したそれぞれのヒトiPS細胞での遺伝子発現の変化を、理研が開発した「CAGE法[7]」で詳しく調べました。その結果、CCL2は多能性マーカー遺伝子だけでなく、細胞が低酸素の状態に置かれた際に働く遺伝子群も活性化させていることが分かりました。低酸素環境では、iPS/ES細胞の分化が抑制されます。つまり、CCL2は低酸素に対する細胞応答と似た状態を誘導することで、分化多能性の維持・向上に関わる可能性が示唆されました。さらに、CCL2とLIFをそれぞれプロテインビーズに取り込ませて培養に使用することで、フィーダー細胞なしで分化多能性を維持したままヒトiPS細胞の培養に成功しました。
分化多能性を向上させる技術の確立は、より簡便に効率よく目的の細胞に分化誘導させることを可能にし、ヒトiPS細胞の基礎研究や医療応用への発展を促進すると期待できます。本研究成果は、英国の科学雑誌『Scientific Reports』のオンライン版(6月24日付け:日本時間6月24日)に掲載されます。
背景
多様な細胞に分化できる能力を持つ多能性幹細胞であるiPS細胞(人工多能性幹細胞)とES細胞(胚性幹細胞)[8]の性質は、同じ哺乳類でもマウスとヒトで大きく異なっています。マウスiPS/ES細胞は、未分化のブラストシスト[9]の性質を持ち、白血病阻止因子(LIF)を培養液中に添加することで、幹細胞の培養条件を整えるフィーダー細胞なしでも分化多能性を維持したまま培養可能です。一方、ヒトiPS/ES細胞は分化がより進んだエピブラスト[9]に近く、LIFを添加しても分化多能性を維持できません。分化多能性の維持には、無血清培地に塩基性線維芽細胞増殖因子(bFGF)またはアクチビンなどの細胞増殖因子を添加し、さらにフィーダー細胞上で培養する必要があります。通常用いられるフィーダー細胞はヒト以外の生物から得た細胞に由来するため、異種細胞の混入の危険性があります。また、質の良いフィーダー細胞の調整には時間がかかります。従ってiPS細胞の臨床応用に適した培養法として、フィーダー細胞なしで分化多能性を維持できる方法の確立が求められています。近年、フィーダー細胞の代わりに、細胞外基質のラミニンなどで培養皿をコーティングする培養方法が開発されていますが、bFGFやアクチビンを添加しただけでは、フィーダー細胞なしに分化多能性を維持することは多くの場合困難です。
これまでに研究グループは、マウスiPS/ES細胞でフィーダー細胞の有無で発現に違いがあった遺伝子を調べ、CCL2遺伝子を見いだしていました注1)。CCL2遺伝子を過剰発現またはCCL2遺伝子から作られるタンパク質「CCL2」を培地に添加すると、マウスiPS/ES細胞の分化多能性が向上することを確認していましたが、ヒトiPS細胞に対しても同様の効果があるかは明らかではありませんでした。
注1)2011年7月11日プレスリリース「マウス由来ES/iPS細胞の万能性を「CCL2タンパク質」が維持」
研究手法と成果
研究グループは、ヒトiPS細胞の分化多能性におけるCCL2の効果を調べるため、無血清培地にbFGFを添加した場合と、CCL2を添加した場合について、多能性マーカー遺伝子の発現を比較しました。その結果、CCL2を添加したヒトiPS細胞は、bFGFを添加したヒトiPS細胞に比べて多能性マーカー遺伝子の発現が顕著に上昇していることが分かりました(図1)。さらにゲノムワイドに遺伝子発現の変化を見るため、CCL2を添加して培養したヒトiPS細胞と、bFGFを添加して培養したヒトiPS細胞それぞれからRNAを抽出し、DNAからRNAへの転写開始点を網羅的に定量解析するCAGE解析を行いました。その結果、CCL2を添加して培養したヒトiPS細胞は、低酸素環境で誘導される遺伝子群が顕著に活性化していました(図2)。低酸素環境で活性化する遺伝子と幹細胞で特異的に機能する遺伝子は一部が共通しており、また低酸素環境下では、iPS細胞やES細胞の分化が抑制されることが知られています。これらの知見から、CCL2は低酸素に対する細胞応答と似た状態、つまり幹細胞の性質に関わる転写制御ネットワークを活性化させることで、分化多能性の維持・向上に寄与する可能性が示唆されました。
以上の実験は、通常のヒトiPS細胞培養と同様にフィーダー細胞をまいた培養皿を用いて行いました。そこで、フィーダー細胞がなくても、CCL2が分化多能性維持に効果を示すかを検証するため、LIFとCCL2をそれぞれプロテインビーズに取り込ませ、ゼラチン溶液とともにコーティングした培養皿でヒトiPS細胞を培養しました。その結果、フィーダー細胞なしで分化多能性を維持したまま培養することに成功しました(図3)。
今後の期待
ヒトiPS細胞から分化させた細胞を用いた再生医療の実用化が進んできている今、フィーダー細胞など異種由来の成分を用いずに安定してヒトiPS細胞を培養する方法の確立が求められています。CCL2が持つ分化多能性の維持・向上作用を利用することで、現時点ではiPS細胞からの分化誘導効率があまり高くない標的細胞も、短時間で高効率に作成できるようになると期待できます。
原論文情報
- Yuki Hasegawa, Dave Tang, Naoko Takahashi, Yoshihide Hayashizaki, Alistair R.R. Forrest, the FANTOM consortium, Harukazu Suzuki, "CCL2 enhances pluripotency of human induced pluripotent stem cells by activating hypoxia related genes" Scientific Reports, 2014, doi: 10.1038/srep05228
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 機能性ゲノム解析部門 オミックス応用技術研究グループ
グループディレクター 鈴木 治和 鈴木 治和(すずき はるかず)
ライフサイエンス技術基盤研究センター 機能性ゲノム解析部門 オミックス応用技術研究グループ 細胞機能変換技術研究チーム
副チームリーダー 長谷川 由紀(はせがわ ゆき)
お問い合わせ先
独立行政法人理化学研究所
ライフサイエンス技術基盤研究センター
チーフ・サイエンスコミュニケーター 山岸 敦(やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.iPS細胞(人工多能性幹細胞)
体細胞に特定の遺伝子を導入することで得られる、多様な細胞に分化できる分化多能性と自己複製能を獲得した細胞。京都大学の山中伸弥教授らのグループにより最初に樹立された。 - 2.分化多能性
生体を構成する多様な細胞に分化できる能力。 - 3.白血病阻止因子(LIF)
LIFはLeukemia Inhibitory Factorの略。iPS/ES細胞など分化多能性のある幹細胞の分化を阻止する。 - 4.フィーダー細胞
培養下の細胞の増殖や分化を起こさせるために共培養される補助的な細胞。ヒトiPS細胞の場合はマウス胚の線維芽細胞が用いられることが多い。 - 5.塩基性線維芽細胞増殖因子(bFGF)
細胞培養や生体内において、細胞の増殖を刺激する活性を有する因子の1つ。線維芽細胞の増殖を促進し、電荷が塩基性側にあるタンパク質。 - 6.多能性マーカー遺伝子
多能性幹細胞の未分化性を決定する遺伝子。 - 7.CAGE法
Cap Analysis of Gene Expressionの略。理研が独自に開発した方法で耐熱性逆転写酵素やCap捕捉法を組み合わせて転写物の5’末端の塩基配列を決定する実験手法。この塩基配列を読み取ってゲノム配列と照らし合わせ、どこから転写が始まっているかを調べることができる。遺伝子の転写開始点をゲノムワイドに同定できる。 - 8.ES細胞(胚性幹細胞)
哺乳類の着床前胚(胚盤胞=ブラストシスト)に存在する多能性細胞(内部細胞塊)から樹立した細胞。分化多能性と自己複製能を持つ。 - 9.ブラストシスト、エピブラスト
マウスの研究から、着床前の胚盤胞(ブラストシスト)の内部細胞塊から樹立するES細胞に対して、着床後に内部細胞塊から生じるエピブラストを用いて、ES細胞よりも分化の進んだ状態の多能性幹細胞(EpiSCs)が得られることが分かった。ヒトiPS/ES細胞は、マウスエピブラスト由来の幹細胞に近い性質を持つ。
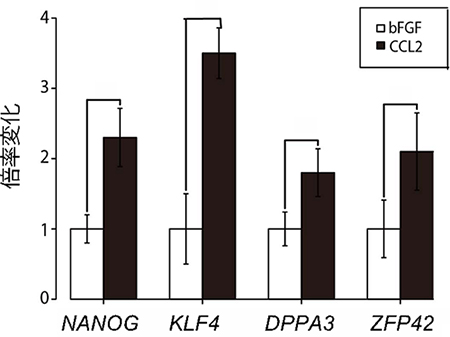
図1 bFGF/CCL2添加下のヒトiPS細胞の多能性マーカー遺伝子発現レベル
bFGFを添加した場合の多能性マーカー遺伝子(NANOG、KLF4、DPPA3、ZFP42)の発現量(白棒グラフ)に対して、CCL2を添加した場合の発現量の割合を縦軸で示す。調べた4つの遺伝子全てにおいて、CCL2を添加した場合の発現量が有為に上昇した。
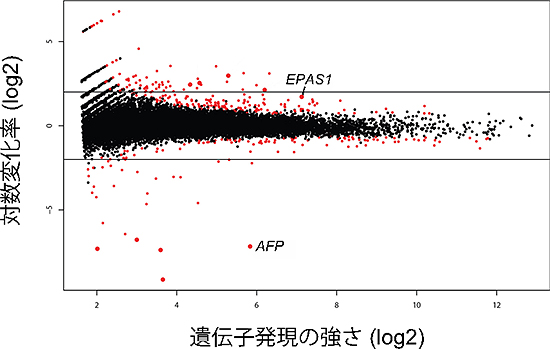
図2 CCL2/bFGFを添加して培養したヒトiPS細胞のCAGE解析結果
CCL2、bFGFを添加して培養したそれぞれのヒトiPS細胞の遺伝子発現量をCAGE解析で定量し、両者を比較した。対数グラフの横軸は2つの培養条件での遺伝子発現量の平均を示し、縦軸はCCL2添加条件での変化の大きさを示す。点は個々の遺伝子を表し、統計上有為な差が観察された遺伝子を赤で示した。縦軸の値が0より上にあるものは、bFGF添加比べてCCL2添加での発現が強いものを示している。EPAS1は低酸素環境で誘導される遺伝子の1つ。一方、0より下にあるものは、bFGF添加比べてCCL2添加で発現が弱いものを示している。AFPは低酸素環境で抑制される遺伝子の1つ。
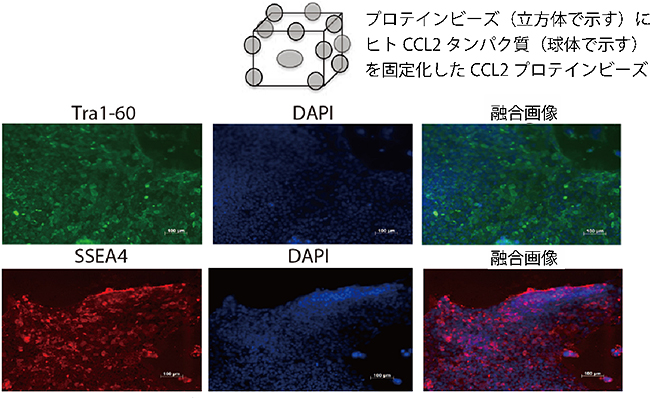
図3 CCL2およびLIFのプロテインビーズでコーティングした培養皿上でのヒトiPS細胞
- 上: CCL2プロテインビーズの模式図。遺伝子組換えで昆虫細胞に発現させたヒトCCL2タンパク質を、タンパク質性の支持体に固定した。このビーズを培養皿に敷くことで、CCL2を定期的に培養液に添加する手間を省くことができる。LIFタンパク質も同様の方法でプロテインビーズに固定した。
- 下: CCL2およびLIFプロテインビーズを用いて培養したヒトiPS細胞コロニー。左は、多能性マーカーであるTra1-60およびSSEA4タンパク質を免疫染色法で可視化した画像。中央は、蛍光色素(DAPI)でDNAを染色したもので、細胞核の位置を示す。右は、左と中央を重ね合わせた融合画像。Tra1-60とSSEA4タンパク質の存在が確認されたことから、分化多能性を維持したままヒトiPS細胞の培養に成功したことが分かる。
