2014年11月20日
理化学研究所
シナプス接着分子は神経回路の可塑性機能に多様性をもたらす
-高等脊椎動物の脳機能高度化を担ってきた分子機構の一端が明らかに-
ポイント
- 神経回路の情報処理機能を支える2対のシナプス接着分子群の働きを明らかに
- ネトリンG1/NGL1とネトリンG2/NGL2はそれぞれ別の神経回路に貢献
- ヒトの脳機能高度化の解明、精神疾患などの治療法開発への寄与に期待
要旨
理化学研究所(理研、野依良治理事長)は、遺伝子欠損マウスを用い、2対のシナプス接着分子群[1]の結合が、それぞれ異なる情報を担う神経回路のシナプス可塑性[2]を制御し、脳機能高度化に貢献してきたことを明らかにしました。これは、理研脳科学総合研究センター(利根川進センター長)行動遺伝学技術開発チームの糸原重美チームリーダー、松川浩リサーチアソシエイトらの研究チームの成果です。
ヒトの脳の働きは、高度に統制された神経回路の情報処理機能によって成り立っています。この処理機能を支える仕組みの1つとして、ヒトなどの高等脊椎動物に固有な分子メカニズムの存在が挙げられています。研究チームはこれまでに、高等脊椎動物に特有な膜タンパク質「ネトリンG1[3]」と「ネトリンG2[3]」が個別の神経細胞の軸索[4]に発現し、投射先の神経細胞の樹状突起[5]に発現する受容体「NGL1[6]」と「NGL2[6]」に結合して、神経細胞の中で情報を受け取る領域(区画)を決定していることを明らかにし、高等脊椎動物に特有の脳の層構造[7]に依存した情報処理機能に関与する可能性を示唆していました。しかし、電気生理学的データや、形態学的データなど、シナプスの機能を直接調べたデータによる機能的証拠は示すことはできませんでした。
今回、研究チームは、免疫電子顕微鏡法[8]を用いてマウスの海馬[9]を観察し、ネトリンG1とネトリンG2が、それぞれ別々の神経回路のシナプス前膜に集積していること、およびNGL1とNGL2がネトリンG1とネトリンG2に対応したシナプス後膜に集積していることを明らかにし、これらの分子のシナプス局在が相互依存的であることを明らかにしました。さらに、海馬の厚切り切片を用いた電気生理学的解析を行い、シナプス接着分子であるネトリンG1/NGL1とネトリンG2/NGL2のシナプスでの結合が、脳の層構造と関連する神経回路の可塑性機能に多様性をもたらすことを示しました。
この発見は、ヒトの脳の高次機能がどのようにして高度化されたかの解明につながり、精神疾患などの治療法開発への寄与が期待できます。
本研究成果は、米国の科学雑誌『The Journal of Neuroscience』オンライン版(11月19日付け:日本時間11月20日)に掲載されます。
背景
脳の働きは、高度に統制された神経回路の情報処理機能によって成り立っています。ヒトを含めた高等脊椎動物は、高度な情報処理を行うために神経系が複雑に発達しており、その特徴の1つが神経細胞や神経突起の束が平行に配置された「層構造」です。この構造は、情報を種類ごとに仕分けし、複数の情報を効率良く適切に処理・統合していると考えられています。脳の高度な神経回路機能が層構造に依存することは、解剖学的には示唆されていましたが、どのような遺伝子が働くのかなど、その分子メカニズムはほとんど分かっていませんでした。
研究チームはこれまでに、高等脊椎動物に特有な膜タンパク質であるネトリンG1とネトリンG2を発見しました。さらに、これらが個別の軸索に発現し、投射先の神経細胞に発現する受容体であるNGL1とNGL2に結合して、神経細胞の中で情報を受け取る領域(区画)を決定していることを明らかにしています注)(図1)。この発見は、ネトリンG1とネトリンG2が高等脊椎動物に見られる脳の層構造に依存した情報処理機能に関与している可能性を示唆するものです。しかし、ネトリンG1とネトリンG2、およびそれらの受容体であるNGL1とNGL2が、どこで、どのような役割を担っているのか、その役割に相互の結合が必要なのかなどについて、電気生理学的データや形態学的データなど、シナプスの機能を直接調べたデータで機能の根拠を示すことはできていませんでした。
注)2007年9月4日のプレスリリース
「2組のタンパク質のペアが脳の神経回路を“区画化”していることを発見」
研究手法と成果
1)ネトリンGおよびNGLのシナプス局在と相互依存性
研究チームは、まず、海馬CA1領域の放線層と分子層(図1)におけるネトリンG1、ネトリンG2と、NGL1、NGL2の分布を調べるため、免疫電子顕微鏡法を使って観察しました。野生型マウス海馬の超薄切片を、それぞれの分子特異的抗体と二次抗体で標識した金粒子で反応させ、電子顕微鏡下で金粒子の分布を観察しました。その結果、ネトリンG1は分子層のシナプス前膜側、ネトリンG2は放線層のシナプス前膜側、NGL1は分子層のシナプス後膜側、NGL2は放線層のシナプス後膜側に局在することが明らかになりました(図2)。
また、NGL1欠損変異マウス、NGL2欠損変異マウスでも同様の観察を行いました。その結果、NGL1欠損変異マウスでは分子層のシナプス前膜からネトリンG1が消失し、NGL2欠損変異マウスでは放線層のシナプス前膜からネトリンG2が消失することが分かりました。これまでの研究で得られた①ネトリンG1欠損マウスではNGL1が樹状突起全体に拡散する、②ネトリンG2欠損マウスではNGL2が樹状突起全体に拡散する、という成果と併せ、これらの分子の間には図2に示す相互依存的関係があることが示されました。さらに、ネトリンG1/NGL1とネトリンG2/NGL2は、それぞれ別々の神経回路のシナプス接着分子であることも分かりました。
2)ネトリンG1欠損変異マウスとネトリンG2欠損変異マウスのシナプス可塑性の異常
海馬のCA3領域の軸索であるシャーファー繊維(SC)はネトリンG2を発現し、CA1領域の錐体細胞とシナプスを形成します。また、嗅内皮質第3層の軸索(TA)はネトリンG1を発現し、CA1錐体細胞とシナプスを形成します(図1)。それぞれの個別の回路についてシナプス可塑性を調べたところ、ネトリンG1欠損マウスでは、TA/CA1シナプスの可塑性が低下しましたが、SC/CA1シナプスは正常でした。一方、ネトリンG2欠損変異マウスでは、SC/CA1シナプスの可塑性が高まりましたが、TA/CA1シナプスは正常でした(図3)。また、可塑性の異常は、主にシナプス前膜側の機構が担っていることが示唆されました。
3)NGL1欠損変異マウスとNGL2欠損変異マウスのシナプス可塑性の異常
研究チームは、ネトリンG1欠損変異マウスとネトリンG2欠損変異マウスの神経回路に特有のシナプス可塑性の異常が、ネトリンGとNGLの結合に依存するとしたら、NGL1欠損変異マウスにはネトリンG1欠損マウスに、NGL2欠損変異マウスにはネトリンG2欠損変異マウスに類似した、神経回路に特有のシナプス可塑性の異常が認められるはず、という仮説を立てました。そこで海馬の厚切り切片を用いた電気生理学的実験を行い、この仮説が正しいことを示しました。
これらの結果は、ネトリンG1/NGL1の相互作用、およびネトリンG2/NGL2の相互作用が、層構造と関連する神経回路の可塑性機能の多様性をもたらすことを示しています(図4)。
今後の期待
ヒトの遺伝学的研究によると、ネトリンG1およびネトリンG2は、統合失調症や双極性障害、自閉症など多様な精神疾患への関与が指摘されています。本成果は、ネトリンG1/NGL1の相互作用と、ネトリンG2/NGL2の相互作用がそれぞれ個別の神経回路を介した高度な情報処理機能に関わっていることを示しています。この機能の詳細な分子メカニズムの解析は、多様な精神疾患の病理機構の理解を深め、新たな治療法の開発につながると期待されます。
原論文情報
- Hiroshi Matsukawa, Sachiko Akiyoshi-Nishimura, Qi Zhang, Rafael Luján, Kazuhiko Yamaguchi, Hiromichi Goto, Kunio Yaguchi, Tsutomu Hashikawa, Chie Sano, Ryuichi Shigemoto, Toshiaki Nakashiba, and Shigeyoshi Itohara. "Netrin-G/NGL complexes encode functional synaptic diversification",The Journal of Neuroscience,2014,doi: 10.1523/JNEUROSCI.1141-14.2014
発表者
理化学研究所
脳科学総合研究センター 行動遺伝学技術開発チーム
チームリーダー 糸原 重美(いとはら しげよし)
お問い合わせ先
脳科学研究推進室
Tel: 048-467-9757 / Fax: 048-467-4914
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.シナプス接着分子群
シナプスの形成と機能の獲得には、シナプス前膜とシナプス後膜に局在し、相互に結合するシナプス接着分子群が寄与する。これには、カドヘリン分子のような同一種分子間の接着機構とネトリンGとNGLのようなリガンドと受容体間の接着機構が存在する。 - 2.シナプス可塑性
シナプスの伝達効率は刺激依存的に変化する。脳の厚切り切片を用いた電気生理学的実験では、ミリ秒単位での変化から数時間におよぶ変化まで測定が可能。一般的に、数分までの変化の持続を短期可塑性とし、数十分を越えて持続する変化を長期可塑性と呼ぶ。生体内では、数日から数カ月におよぶ可塑性の存在が知られ、学習記憶機構を担うと考えられている。 - 3.ネトリンG1とネトリンG2
分泌タンパク質ネトリンと似た構造を持ち、GPIと呼ばれるリン脂質を介して細胞膜の外側表面に結合する膜タンパク質。研究チームが独自に発見した分子で、GPI結合のGをとって命名された。分泌タンパク質ネトリンはそれらの受容体とともに無脊椎動物からヒトまで保存され、軸索誘導因子として働き、神経回路形成の初期段階で軸索伸張の向きを決める。ネトリンGは脊椎動物にのみ存在し軸索誘導活性は持たない。脊椎動物の進化の過程でゲノム重複により、ネトリンG1とネトリンG2が形成され、次第に相互排他的な脳領域で発現する特徴を獲得した。 - 4.軸索
神経細胞の細胞体から伸びる細長い突起で電気的信号を伝える。軸索終末部分には神経伝達物質を含む分泌小胞があり、電気的信号依存的に神経伝達物質をシナプス間隙に分泌する。電気的信号を化学的信号に変換し、次の神経細胞に情報を伝達する。 - 5.樹状突起
神経細胞の細胞体から伸びる軸索とは異なった突起で、樹の枝のように分岐する複雑な形態を持つ。他の神経細胞の軸索終末とシナプスを形成し、神経伝達物質受容体でシナプス間隙に放出された化学的情報を受け取り、電気的信号に変換する。 - 6.NGL1とNGL2
NGL1とNGL2は、ロイシンリッチリピートを持つ類縁の膜タンパク質。膜を1回貫通する構造で、細胞外ドメインでNGL1はネトリンG1と、NGL2はネトリンG2と結合する。細胞内ドメインはシナプス関連分子と結合することが知られている。 - 7.層構造
ほ乳類の大脳や海馬などで認められる構造。異なった細胞群の細胞体が層を形成している一方で、それらの樹状突起は層を越えて広がっている。また、異なった脳領域に由来する軸索が異なった層に集積し、そこで樹状突起とシナプスを形成する。したがって、脳層構造は多種類の情報を統合する機構を担う。 - 8.免疫電子顕微鏡法
脳の超薄切片に金粒子に結合した分子特異的抗体を反応させ、良く洗った後で電子顕微鏡を用いて観察すると、超薄切片に結合した金粒子は電子線の通過を阻害するので、その存在を検出することができる。金粒子は用いた抗体が結合する分子の存在を意味する。最も高い解像度(ナノメーターレンジ)で任意の分子の局在を知ることができる。 - 9.海馬
大脳側頭葉の内下部にあり、両側を合わせた形がギリシャ神話の海神がまたがる海馬に似ている、あるいはタツノオトシゴに似ていることからこの名称がついたとされる。経験記憶の形成と保存に役割を発揮する領域で、両側を破壊すると記憶障害が起きる。
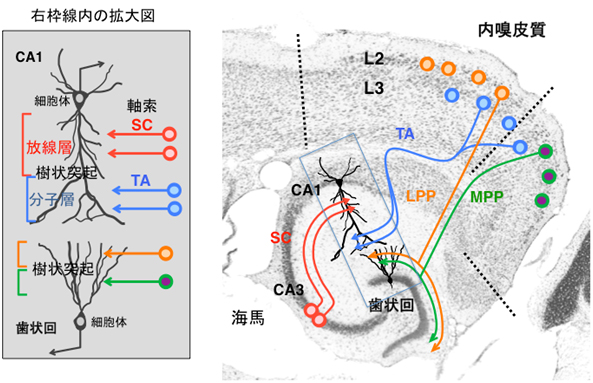
図1 海馬の神経回路と層構造
右図は、マウス脳の右半球後部の水平断面の組織写真に、模式的に海馬CA1錐体細胞1個と歯状回の顆粒細胞1個、それらに投射している軸索の走行を示している。左図は右図の青い枠線で囲った領域の拡大像。CA3細胞からの軸索(シャーファー繊維:SC)は、海馬CA1の放線層でCA1錐体細胞の近位樹状突起にシナプスを形成する。内嗅皮質第3層からの軸索(TA)はCA1の分子層に投射し、CA1錐体細胞の遠位樹状突起にシナプスを形成する。
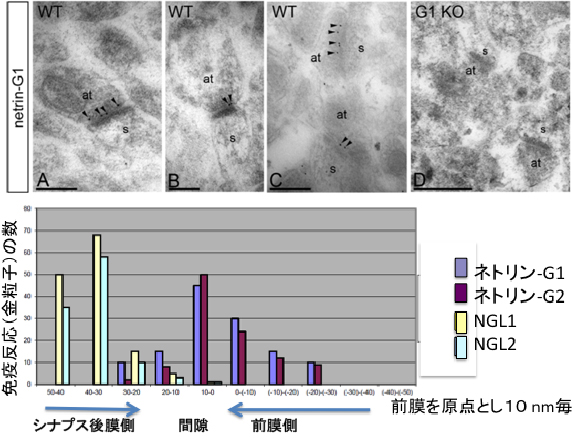
図2 ネトリンGとNGLのシナプス局在
- 上段:抗ネトリンG1抗体を用いた免疫電子顕微鏡観察の例
野生型(WT)マウスの脳では、シナプス前膜側に金粒子(矢頭)が分布している。後膜側は電子密度の高い分子が集積するので、濃く染まっている。ネトリンG1欠損マウス(G1KO)の脳切片では野生型のような金粒子の分布が認められないので、反応の特異性が示されている。(at:軸索終末、s:樹状突起上の小さな棘突起でシナプス後膜側の構造) - 下段:免疫反応のシナプスでの位置
ネトリンG1およびネトリンG2はそれぞれ異なった回路ではあるが、共通してシナプス前膜側に分布し、NGL1とNGL2は共通して後膜側に分布することが示された。
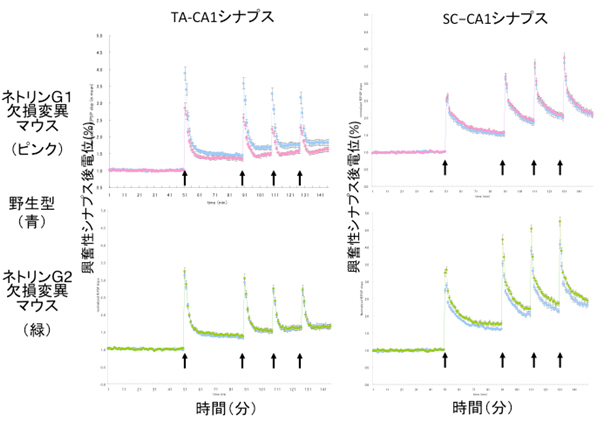
図3 ネトリンG1欠損変異マウスとネトリンG2欠損変異マウスのシナプス可塑性異常
海馬CA1の分子層に形成されるTA-CA1シナプスと、放線層に形成されるSC-CA1シナプスにシーターバースト刺激(矢印)を繰り返し与え、誘導された長期可塑性の結果を示す。刺激依存的に興奮性シナプス後電位(シナプス伝導効率)が上昇するが、ネトリンG1欠損マウスのTA-CA1シナプスでは、その効果が野生型に比べ低下していた。一方、ネトリンG2欠損変異マウスではSC-CA1シナプスの長期可塑性は野生型に比べ向上していた。野生型マウスのTA-CA1シナプスではネトリンG1が、SC-CA1ではネトリンG2が働く。
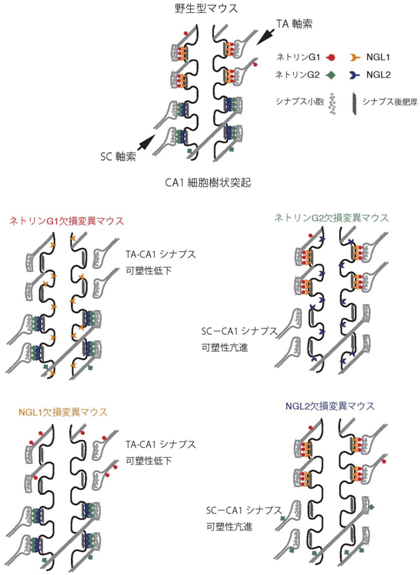
図4 ネトリンG1/NGL1相互作用とネトリンG2/NGL2相互作用の相互依存性とシナプス可塑性の制御機能のパターン
CA1錐体細胞に入力する2つの回路(SCとTA)でのネトリンGとNGLの相互作用の特異性と、この相互作用がシナプス可塑性に及ぼす影響のパターンを模式的に示す。2組のシナプス性接着分子の分子進化が神経回路の可塑性機能に多様性をもたらし、高等脊椎動物の脳の情報処理機構の発達に重要な役割を果たしていることが示されている。
