要旨
理化学研究所(理研)グローバル研究クラスタシステム糖鎖生物学研究グループ糖鎖代謝学研究チームの鈴木匡チームリーダー、原田陽一郎特別研究員(研究当時、現鹿児島大学大学院医歯学総合研究科特任准教授)らの共同研究グループ※は、リン酸化された糖鎖の新しい代謝機構を解明しました。
タンパク質の翻訳後修飾[1]の1つに、アスパラギン残基(N)に付加される糖鎖(N型糖鎖[2])があります。N型糖鎖は、タンパク質の安定性や輸送、機能などの制御に重要な役割を果たしています。役目を終えた糖タンパク質(N型糖鎖で修飾されたタンパク質)は細胞内のリソソーム[3]に運ばれた後、アミノ酸と糖にまで分解されます。しかし、N型糖鎖の分解が正しく行われないと、さまざまな病気が引き起こされることが分かっています。また、近年、糖鎖の分解がリソソーム以外の場所でも起こる「糖鎖の非リソソーム分解機構」の存在が明らかになってきました。しかし、その仕組みはよく分かっていません。
N型糖鎖は、ドリコールピロリン酸と呼ばれる脂質上に結合した状態で存在します。このドリコール結合型糖鎖[4]は、未知の酵素によって分解されて「リン酸化糖鎖[5]」を生じます。今回、共同研究グループは、非リソソーム分解機構に関与する細胞質「エンド-β-N-アセチルグルコサミニダーゼ(ENGase)[6]」の欠損細胞においてリン酸化糖鎖が蓄積することを発見しました。生化学的な解析から、ENGaseがリン酸化糖鎖を分解すること、さらにその基質特異性[7]がENGaseの欠損細胞で蓄積するリン酸化糖鎖の構造と一致することを明らかにしました。また、リン酸化糖鎖を単離精製し、質量分析[8]による検出にも成功し、リン酸化糖鎖の構造を正確に把握できました。これらの結果は、ENGaseがリン酸化糖鎖の代謝(分解)に関わることを示しています。糖鎖分解の分子機構の全容解明に、一歩前進したといえます。
本研究は、米国の科学雑誌『Journal of Biological Chemistry』に掲載されるのに先立ち、オンライン版(2月8日付け)に掲載されました。
※共同研究グループ
理化学研究所
グローバル研究クラスタ
システム糖鎖生物学研究グループ 糖鎖代謝学研究チーム
チームリーダー 鈴木 匡(すずき ただし)
特別研究員(研究当時)原田 陽一郎(はらだ よういちろう)(現 鹿児島大学大学院医歯学総合研究科システム血栓制御学講座 特任准教授)
国際特別研究員 黄 澄澄(ホアン・チェンチェン)
環境資源科学研究センター 技術基盤部門 生命分子解析ユニット
ユニットリーダー 堂前 直(どうまえ なおし)
島津製作所 分析計測事業部
課長 八巻 聡(やまき さとし)
背景
糖鎖修飾は、生物にとって最も普遍的なタンパク質の翻訳後修飾反応の1つです。タンパク質に糖鎖が付くことでタンパク質の安定性を高めたり、その機能や局在性に影響を与えたりする例が数多く知られています。中でも、タンパク質のアスパラギン残基(N)に結合するN型糖鎖は、バクテリアを含めた全ての細胞にみられる代表的な糖鎖修飾です。
ほ乳動物において、N型糖鎖とその前駆体であるドリコール結合型糖鎖の生合成機構のほとんどは解明されたといえます。一方で、ドリコール結合型糖鎖の分解機構の研究は遅れており、多くの謎が残されています。共同研究グループは、その全容解明を目指して研究を行っています。
ドリコール結合型糖鎖の分解産物として、「リン酸化糖鎖」が動物細胞の細胞質に存在することは古くから知られていました(図1、分解)。しかし、リン酸化糖鎖は微量しか存在せず、その検出には放射性同位体標識が必要だったため、リン酸化糖鎖の生成・分解機構はほとんど調べられていませんでした。この問題を解決するために共同研究グループは、2013年にリン酸化糖鎖を蛍光標識し、高速液体クロマトグラフィー(HPLC)[9]によって定量分析する方法を確立しました注1)。しかし、この方法はリン酸化糖鎖のリン酸部分を除去した後で蛍光基を導入することから、脱リン酸化したあとの糖鎖の定量には適するものの、リン酸化糖鎖の構造を正確に把握することはできませんでした。また、細胞質には糖鎖を分解する酵素がいくつか存在することが知られていますが、それらの酵素がリン酸化糖鎖の分解・代謝にどのように関わっているのか不明でした。
注1)2013年11月12日プレスリリース「不完全な糖鎖をきれいに分解するメカニズムを発見」
研究手法と成果
まず、共同研究グループは既存の方法でリン酸化糖鎖を単離し、質量分析によってその構造を正確に把握することを試みました。既存の方法では、リン酸化糖鎖に脱リン酸化処理を施した後、生じた糖鎖に蛍光標識をして定量していました。しかし、この方法では、リン酸化糖鎖のリン酸基の数の情報が失われてしまうため、リン酸基の数を正確に把握することは不可能でした(図1、脱リン酸化および蛍光標識)。
そこで、共同研究グループはリン酸化糖鎖が持つリン酸基の数を決定するため、単離したリン酸化糖鎖を脱リン酸化せず、そのまま質量分析計で計測することを試みました。その結果、イオンペア剤を用いた液体クロマトグラフィーと質量分析を組み合わせることで、リン酸化糖鎖の検出に成功しました。解析ではリン酸基が1個結合したリン酸化糖鎖は観察されたものの、2個結合したものは検出されませんでした。このことから、リン酸化糖鎖に結合するリン酸基は1個であることを実験的に証明できました。しかし、リン酸化糖鎖の分解機構は分からないままでした。
これまで共同研究グループは、細胞質に存在する脱糖鎖酵素、エンド-β-N-アセチルグルコサミニダーゼ(ENGase)の生理機能の解析を行ってきました。ENGaseは、その反応機構からリン酸化糖鎖の分解に関与する可能性は知られていましたが、リン酸化糖鎖の検出の難しさから、厳密な検証はされていませんでした。そこで、共同研究グループが以前樹立した「ENGaseノックアウトマウス[10]由来繊維芽細胞(結合組織を構成する細胞の1つ)」を用いて、細胞質に蓄積するリン酸化糖鎖を解析しました。その結果、野生型マウス由来繊維芽細胞に比べて、ENGaseノックアウトマウス由来繊維芽細胞では、はるかに多くのリン酸化糖鎖が蓄積することが分かりました。しかし、比較的大きいリン酸化糖鎖(マンノースが4~7個)は著しい蓄積がみられたのに対し、小さいリン酸化糖鎖(マンノースが0~3個)はほとんど量が変化しませんでした。比較的大きいリン酸化糖鎖がENGaseノックアウトマウス由来線維芽細胞の細胞質に蓄積するということは、ENGaseがこれらのリン酸化糖鎖の分解酵素として働いていることを示唆しています。
次に、共同研究グループは、ENGaseがリン酸化糖鎖を分解できるどうかを生化学的に調べました。その結果、ENGaseがリン酸化糖鎖を分解できること、およびその基質特異性が、ENGaseノックアウトマウス由来線維芽細胞で蓄積するリン酸化糖鎖の構造と合致することが分かりました。
以上の結果から、脱糖鎖酵素ENGaseは比較的大きいリン酸化糖鎖の分解に関わる一方、小さいリン酸化糖鎖の分解は効率的に行わないことが明らかとなりました(図2)。
今後の期待
糖タンパク質における糖鎖の分解・代謝機構には、まだ不明な経路が多く存在します。このうち、細胞質などリソソーム以外で起こる新たな分解機構である「非リソソーム糖鎖代謝機構」に関わる細胞質ペプチド:N-グリカナーゼ(PNGase)[11]の欠損によって重篤な遺伝疾患が起こることが最近明らかになりました。さらに、PNGase欠損の治療にENGaseの阻害剤が有効である可能性が提唱されています注2)。このように、当初機能が不明であった酵素でも、後に非常に重要な役割を果たしたり、疾患治療の標的タンパク質になる可能性が明らかになったりする場合があります。
本研究では、ほ乳動物に蓄積するリン酸化糖鎖の構造を正確に把握することに成功しました。また、リン酸化糖鎖の細胞内分解機構の一端を解明しました。糖鎖分解の分子機構は、基本的な生物学的素過程です。本成果はその全容解明に向けて、一歩前進したと捉えることができます。
注2)2015年1月20日プレスリリース「Ngly1タンパク質の欠損によりタンパク質分解反応に異常」
原論文情報
- Yoichiro Harada, Chengcheng Huang, Satoshi Yamaki, Naoshi Dohmae and Tadashi Suzuki, "Non-lysosomal degradation of singly phosphorylated oligosaccharides initiated by the action of a cytosolic endo-β-N-acetylglucosaminidase", Journal of Biological Chemistry, doi: 10.1074/jbc.M115.685313
発表者
理化学研究所
グローバル研究クラスタ 理研-マックスプランク連携研究センター システム糖鎖生物学研究グループ 糖鎖代謝学研究チーム
チームリーダー 鈴木 匡(すずき ただし)
特別研究員(研究当時) 原田 陽一郎(はらだ よういちろう)
(現 鹿児島大学大学院医歯学総合研究科システム血栓制御学講座 特任准教授)
 糖鎖代謝学研究チームのメンバー。上段中央が鈴木 匡。
糖鎖代謝学研究チームのメンバー。上段中央が鈴木 匡。
 原田 陽一郎
原田 陽一郎
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.翻訳後修飾
タンパク質がDNAの情報を基に生合成(翻訳)された後、生体内の多くの酵素によって受けるリン酸化、糖鎖付加、脂質付加、メチル化、アセチル化などの修飾のこと。これらの修飾によってタンパク質の機能や活性が調節される。 - 2.N型糖鎖
今発表では、アスパラギン残基(N)に付加される糖鎖で、細胞内小器官の1つである小胞体で合成されるタンパク質の翻訳後修飾の1つ。コンセンサス配列(共通配列)中(アスパラギン-X-セリン/スレオニン、Xはプロリン以外のアミノ酸残基)のアスパラギン残基に糖鎖が付加される。 - 3.リソソーム
真核生物が持つ細胞小器官の1つ。糖タンパク質も含めた生体高分子の細胞内分解、代謝の場として機能する。 - 4.ドリコール結合型糖鎖
N型糖鎖修飾の糖鎖供与体基質。ほ乳動物細胞や出芽酵母では、3個のグルコース、9個のマンノースおよび2個の N-アセチルグルコサミンから構成される糖鎖が、2個のリン酸基(ピロリン酸)を介してドリコール脂質に結合している。ドリコール脂質はポリプレノール類の1種で、小胞体膜に挿入されている。 - 5.リン酸化糖鎖
ドリコール結合型糖鎖の2個のリン酸基の間が未知の酵素によって分解されて生成する糖鎖。細胞質にのみ検出される。 - 6.エンド-β- N-アセチルグルコサミニダーゼ(ENGase)
細胞質における糖鎖の非リソソーム分解機構に関与する脱糖鎖酵素。 - 7.基質特異性
酵素の作用を受けて反応を起こす物質を、その酵素の基質という。酵素が反応する基質は決まっており、他の基質では反応が進まない。このように、酵素がある特定の基質を選んで反応する性質を基質特異性という。 - 8.質量分析
分子、原子の質量を測定する分析方法。原子や分子などを気体状のイオンにして分析することにより、原子や分子の種類を推定することができる。また、そのイオンの検出量から、原子や分子の含有量を調べることができる。 - 9.高速液体クロマトグラフィー(HPLC)
化学分析法であるクロマトグラフィー(測定法)の1つ。分析能、分析速度を高めるため,固定相を耐圧管に入れ,移動相の液体を高圧で流して分離分析する。 - 10.ノックアウトマウス
特定の遺伝子を人為的に欠損させたマウス。特定の遺伝子の個体や細胞における機能の解明に用いる。 - 11.細胞質ペプチド: N-グリカナーゼ(PNGase)
糖タンパク質からN型糖鎖を切り出す脱糖鎖酵素。バクテリア由来の酵素は糖鎖研究用の試薬として重要であるが、ヒトや酵母の細胞質に存在するPNGaseは異常糖タンパク質の分解にかかわっている。
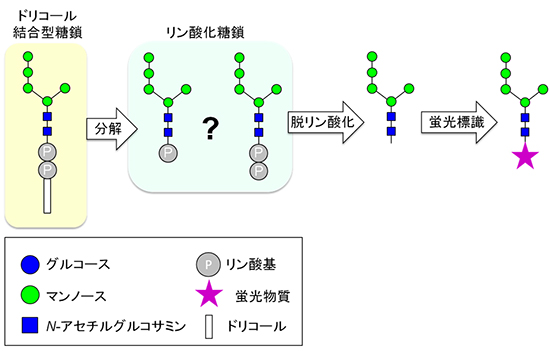
図1 従来のリン酸化糖鎖の検出法
小胞体膜に存在するドリコール結合型糖鎖の糖鎖とドリコール脂質の間には、2個のリン酸基が存在する。それが分解されると、リン酸化糖鎖になるが、正確なリン酸基の数は分かっていなかった。リン酸化糖鎖を脱リン酸化後、蛍光物質を付加し、高速液体クロマトグラフィー(HPLC)を用いれば、脱リン酸化糖鎖の定量分析は可能であった。しかし、この方法ではリン酸化糖鎖のリン酸基の数の情報が失われてしまっていた。なお、本図で示したドリコール結合型糖鎖は生合成中間体の一例で、マンノースは5個である。
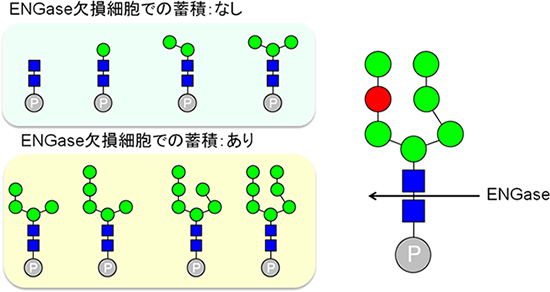
図2 ENGase欠損細胞で蓄積するリン酸化糖鎖の構造と脱糖鎖酵素ENGaseの基質特異性
左上:リン酸化糖鎖のマンノース(緑丸)が0~3個の場合は、脱糖鎖酵素ENGase(エンド-β-N-アセチルグルコサミニダーゼ)欠損細胞でのリン酸化糖鎖の蓄積はない。つまり、ENGaseによるリン酸化糖鎖の分解は効率的に行われないことを示す。
左下:リン酸化糖鎖のマンノースが4~7個の場合は、ENGase欠損細胞でのリン酸化糖鎖の蓄積がある。つまり、ENGaseによるリン酸化糖鎖の分解が行われることを示す。
右:ENGaseは矢印の部分(N-アセチルグルコサミンの間)に働いて、リン酸化糖鎖を分解する。赤丸は、分解の際のENGaseの基質特異性に重要なマンノース残基。
