要旨
理化学研究所(理研)統合生命医科学研究センター骨関節疾患研究チームの池川志郎チームリーダー、飯田有俊上級研究員、横浜市立大学学術院医学群の松本直通教授、東京医科歯科大学大学院の中島友紀教授らの共同研究グループ※は、骨密度が異常に上昇する骨硬化性骨幹端異形成症の原因遺伝子の1つ「LRRK1」[1]を発見しました。さらに、LRRK1の機能喪失変異により、骨吸収作用を担っている破骨細胞[2]が機能不全を起こし、異常に骨密度が上昇するメカニズムを明らかにしました。
骨硬化性骨幹端異形成症は、大理石骨病[3]の1種で、常染色体劣性遺伝病[4]です。管状骨(内部が空洞で細長い棒状の骨)の骨幹端[5]を中心とする全身の骨密度の上昇、発達遅滞、筋緊張低下などの症状を示します。共同研究グループは、国内外の医師・研究者らの協力により、骨硬化性骨幹端異形成症の患者3人の臨床情報とDNAを収集しました。次世代シーケンサー[6]によるエクソーム解析[7]により、1人の患者においてLRRK1に7塩基の欠失変異を発見しました。この変異により、C末端[8]が延長した異常なLRRK1タンパク質が作られると考えられます。
過去の研究で、LRRK1を人為的に欠損させたマウス(LRRK1ノックアウトマウス)は、重度の大理石骨病に似た表現型を示すことが知られていました。しかし、この表現型がヒトの大理石骨病のうちのどの疾患に対応するかは不明でした。共同研究グループがLRRK1ノックアウトマウスのX線像、組織像を詳しく調べた結果、骨硬化性骨幹端異形成症患者とLRRK1ノックアウトマウスの表現型(骨格異常)が極めて類似していることが分かりました。また、正常マウスを使った解析によりLRRK1は破骨細胞に極めて強く発現し、破骨細胞の分化後期で発現が増強することを発見しました。さらに、LRRK1ノックアウトマウス由来の破骨細胞に正常なLRRK1を導入したところ骨吸収活性が回復しましたが、変異したLRRK1を導入しても骨吸収活性は回復しませんでした。このことから、LRRK1は破骨細胞の骨吸収機能に必須で、変異したLRRK1タンパク質ではその機能が消失していることを証明しました。
今回、原因遺伝子を発見したことによって、骨硬化性骨幹端異形成症の遺伝子診断、保因者診断が可能となります。また、LRRK1の機能解析を通じて、骨硬化性骨幹端異形成症や類縁疾患の治療法の開発が期待できます。さらに近年、いくつかの大理石骨病関連疾患の遺伝子の研究から骨粗鬆症治療薬の開発が成功しており、本症の研究もまた、骨粗鬆症の治療薬の開発へとつながると期待できます。
本研究は、2014年度から開始され、国立研究開発法人日本医療研究開発機構(2015年度~)の難治性疾患実用化研究事業のプロジェクト『遺伝性難治疾患の網羅的遺伝子解析拠点研究』(研究開発担当者:池川志郎チームリーダー、班長:横浜市立大学遺伝学 松本直通教授)の一環として行われました。
成果は、英国の科学雑誌『Journal of Medical Genetics』に掲載されるのに先立ち、オンライン版(4月7日付け)に掲載されました。
※共同研究グループ
理化学研究所 統合生命医科学研究センター
骨関節疾患研究チーム
チームリーダー 池川 志郎(いけがわ しろう)
上級研究員 飯田 有俊(いいだ ありとし)
研究員 王 铮(ワン・ゼン)
横浜市立大学学術院医学群(遺伝学)
准教授 三宅 紀子(みやけ のりこ)
教授 松本 直通(まつもと なおみち)
東京医科歯科大学大学院 医歯学総合研究科
教授 中島 友紀(なかしま ともき)
東京都立小児総合医療センター 放射線科
西村 玄(にしむら げん)
埼玉県立小児医療センター 遺伝科
部長 大橋 博文(おおはし ひろふみ)
背景
理研の骨関節疾患研究チームは、これまで次世代シーケンサーを用いたゲノム解析により、短体幹症、Beighton型脊椎骨端骨幹端異形成症、Ehlers-Danlos症候群早老型、軸性脊椎骨幹端異形成症など、数多くの骨や関節の遺伝性疾患、希少難病の原因遺伝子を発見してきました注1)。
今回、研究対象とした骨硬化性骨幹端異形成症は、骨密度の異常な上昇を特徴とする大理石骨病の1種で、常染色体劣性の遺伝形式をとる希少難病です。管状骨(内部が空洞で細長い棒状の骨)の骨幹端を中心とする全身の骨密度の上昇、発達遅滞、筋緊張低下などの症状を示します。発症原因や発症メカニズムは全く分かっておらず、その解明を通じて、予防や治療法の確立が望まれていました。そこで共同研究グループは、骨硬化性骨幹端異形成症の原因遺伝子の発見に挑みました。
注1)2016年3月15日プレスリリース「軸性脊椎骨幹端異形成症の原因遺伝子を発見」
2013年5月10日プレスリリース「骨・関節、皮膚を広範に犯す難病の原因遺伝子を発見」
2012年7月12日プレスリリース「難治性の骨疾患「短体幹症」の原因遺伝子を発見」
研究手法と成果
共同研究グループは、「骨系統疾患コンソーシアム[9]」と日本、ベルギー、ドイツの医師、医科学研究者の協力により、骨硬化性骨幹端異形成症3家系3例の臨床情報とDNAを収集しました。そのうち2例は、血族結婚家系の患者でした。その2例について、次世代シーケンサーを用いたエクソーム解析を行いました。その結果、1人の患者においてLRRK1の最終エキソン(タンパク質合成の情報を持つ部分)に7塩基の欠失変異を発見しました。この欠失変異はヒトの遺伝子多型[10]と遺伝子変異のデータベースにはない新しい遺伝子変異でした。LRRK1の最終エキソンは、他のタンパク質との相互作用に重要な領域である「WD40ドメイン」をコードします。この変異により、C末端にあるWD40ドメインが部分的に欠失し、かつタンパク質のC末端が延長した異常なLRRK1タンパク質が作られると考えられました(図1)。共同研究グループはサンガー法[11]によって、患者が保因者の両親から変異を受け継いでいることを確認しました。
また、共同研究グループは、以前の研究でLRRK1を人為的に欠損させたマウス(LRRK1ノックアウトマウス)を作製し、そのマウスが重度の大理石骨病に似た表現型を示すことを報告していました注2)。しかし、この表現型が数多くのヒトの大理石骨病およびその類縁疾患のうちのどの疾患に対応するかは不明でした。そこで、共同研究グループが、改めてLRRK1ノックアウトマウスのX線像と組織像を詳しく調べたところ、LRRK1の遺伝子変異を持つ骨硬化性骨幹端異形成症患者とLRRK1ノックアウトマウスの表現型(骨格異常)が極めて類似していることが分かりました(図2)。
さらに、LRRK1タンパク質の機能を調べるために、骨の細胞におけるLRRK1の発現を定量的に解析しました。その結果、LRRK1は骨の吸収に関与する破骨細胞に極めて強く発現していることを確認しました。そこで、破骨細胞の分化段階での発現量の変動について調べたところ、LRRK1は破骨細胞分化の後期の多核破骨細胞で発現が増していることが分かりました。これらの結果からLRRK1は、成熟した破骨細胞の機能(骨吸収)に関与する遺伝子と考えられます。
LRRK1ノックアウトマウスの破骨細胞は、機能不全を起こし、骨吸収ができなくなります。共同研究グループはLRRK1ノックアウトマウスの破骨細胞を用いて、患者の欠失変異が破骨細胞の骨吸収能に及ぼす影響を調べました。LRRK1ノックアウトマウスの破骨細胞に正常なヒトLRRK1を導入すると、破骨細胞の骨吸収能が回復しました。しかし、変異したヒトLRRK1を導入した場合は、骨吸収能は回復しませんでした。以上の結果から、LRRK1タンパク質の機能喪失変異により、破骨細胞の骨吸収に機能不全が生じ、骨硬化性骨幹端異形成症が発症することが分かりました。
さらに共同研究グループは、エクソーム解析でLRRK1の変異が見つからなかった2症例について、サンガー法でLRRK1の遺伝子変異の有無を調べました。しかし、両者ともLRRK1の遺伝子変異は見つかりませんでした。また、LRRK1変異が見つからなかった血族結婚家系例で、homozygosity mapping[12]による連鎖解析を行ないましたが、LRRK1が原因遺伝子であることは確認できませんでした。これらの結果から、骨硬化性骨幹端異形成症にはLRRK1以外の原因遺伝子が存在すると考えられます。
注2)Xing W, Liu J, Cheng S, Vogel P, Mohan S, Brommage R. Targeted disruption of leucine-rich repeat kinase 1 but not leucine-rich repeatkinase 2 in mice causes severe osteopetrosis. J Bone Miner Res 28(9):1962-74, 2013.
今後の期待
骨硬化性骨幹端異形成症の原因遺伝子の1つを発見したことによって、遺伝子診断、早期発見、保因者診断が可能になります。また、LRRK1タンパク質の機能解析を通じて、本症や類縁疾患の治療法開発が期待できます。
現在、大理石骨病関連疾患の原因遺伝子を分子標的として骨粗鬆症治療薬の開発が進み、カテプシンK阻害薬、抗RANKL抗体、抗スクレロスチン抗体などたくさんの成功例が出ています。LRRK1ノックアウトマウスは、大理石骨病関連疾患の原因遺伝子のノックアウトマウスの中でも、最も強い骨密度の上昇を呈します注2)。このマウスを使うことでLRRK1タンパク質を分子標的とした創薬研究による新たな骨粗鬆症の治療薬の開発が期待できます。
原論文情報
- Aritoshi Iida, Weirong Xing, Martine KF Docx, Tomoki Nakashima, Zheng Wang, Mamori Kimizuka, Wim Van Hul, Dietz Rating, Jürgen Spranger, Hirohumi Ohashi, Noriko Miyake, Naomichi Matsumoto, Subburaman Mohan, Gen Nishimura, Geert Mortier, and Shiro Ikegawa., "Identification of bi-allelic LRRK1 mutations in osteosclerotic metaphyseal dysplasia and evidence for locus heterogeneity", Journal of Medical Genetics, doi: 10.1136/jmedgenet-2016-103756
発表者
理化学研究所
統合生命医科学研究センター 骨関節疾患研究チーム
チームリーダー 池川 志郎(いけがわ しろう)
上級研究員 飯田 有俊(いいだ ありとし)
横浜市立大学学術院医学群(遺伝学)
教授 松本 直通(まつもと なおみち)
東京医科歯科大学大学院 医歯学総合研究科
教授 中島 友紀(なかしま ともき)
 左から飯田 有俊、池川 志郎
左から飯田 有俊、池川 志郎
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
横浜市立大学 研究企画・産学連携推進課長 渡邊 誠
Tel: 045-787-2510 / Fax: 045-787-2509
sentan [at] yokohama-cu.ac.jp(※[at]は@に置き換えてください。)
東京医科歯科大学 広報部広報課広報係
Tel: 03-5803-5833
kouhou.adm [at] tmd.ac.jp(※[at]は@に置き換えてください。)
補足説明
- 1.LRRK1
ロイシンリッチリピートキナーゼ1(Leucin-rich repeat kinase 1)遺伝子。細胞内Src(がん原遺伝子チロシンプロテインキナーゼ)経路において骨吸収を負に調節する。 - 2.破骨細胞
骨は常に新陳代謝が行われ、破骨細胞と骨芽細胞によって常に壊され新しく作り直されている。破骨細胞は骨を破壊(骨吸収)する役割を担っている。 - 3.大理石骨病
骨系統疾患(骨関節を犯す遺伝病)の1つ。遺伝的、臨床的に異なるいくつかの疾患からなる疾患のグループ名。レントゲン写真で、骨密度が上昇して見える疾患の代表で、堅く白いレントゲン像を示すので、この名前が付いた。骨密度は上昇しているが、骨折を起こしやすい。 - 4.常染色体劣性遺伝病
原因遺伝子が常染色体上に存在し、父母よりそれぞれ1つずつ受け継ぐ遺伝子の両方に異常があった場合に発症する疾患。一方の遺伝子のみに異常があっても、疾患は発症せず、保因者となる。 - 5.管状骨の骨幹端
解剖学の用語。四肢や指趾(しし、手や足の指)の骨、脛骨、中手骨など。管状骨は成長軟骨を基準に骨端、骨幹端、骨幹の3つの部分からなる。 - 6.次世代シーケンサー
最近まで標準的に使われていたサンガー法に基づくDNAシーケンサーに対して、それと異なる原理に基づく、より高速・大量にDNA配列を解析できるシーケンサーのこと。多くの種類のシーケンサーが開発されている。 - 7.エクソーム解析
ゲノムの中のタンパク質合成に関する情報を含むエキソン部分(ゲノム全体の約3%)を、次世代シーケンサーを用いて包括的に解析する方法。 - 8.C末端
タンパク質はアミノ酸同士が脱水縮合して形成されたポリマーであり、隣接するアミノ酸は、それぞれのアミノ基とカルボキシル基がペプチド結合をしている。このポリマーの末端のフリーのアミノ基側をN末端、カルボキシル基側をC末端と呼ぶ。 - 9.骨系統疾患コンソーシアム
骨関節の単一遺伝病である骨系統疾患の医療の改善・発展を目指して立ち上げられた非営利組織。
骨系統疾患コンソーシアムホームページ - 10.遺伝子多型
私たちの顔が個々人で異なるように、ヒトゲノムの全配列約30億塩基対は一人一人を比較すると、塩基配列に違いがみられる。このうち、集団内での頻度が1%以上のものを遺伝子多型と呼ぶ。 - 11.サンガー法
DNAのシーケンス(DNAを構成するヌクレオチドの塩基の結合順序)の決定法の1つ。次世代シーケンサーの出現以前は、標準的に使われていた。 - 12.homozygosity mapping
疾患遺伝子の遺伝子座位を決定することをmapping(マッピング)という。homozygosity mapping はマッピングの方法である連鎖解析の方法の1つ。常染色体劣性遺伝の疾患で血族結婚の家系では、罹患者は、両親の共通の祖先から疾患遺伝子を受け継いでいることを利用して、マッピングを行なう。
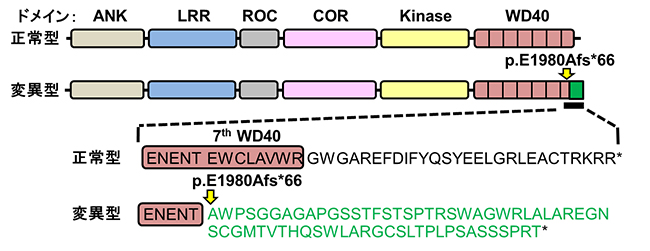
図1 骨硬化性骨幹端異形成症患者におけるLRRK1タンパク質の変異
正常型LRRK1タンパク質(上段)と患者で生じている異常型LRRK1タンパク質(下段)の構造。矢印は、変異の位置。欠失変異は、LRRK1タンパク質のC末端にあるWD40ドメイン内に生じていた。緑色のボックスと緑色字のアミノ酸配列は、フレームシフト変異(翻訳時の3つ組の読み枠がずれること)によって付加された66アミノ酸を示す。
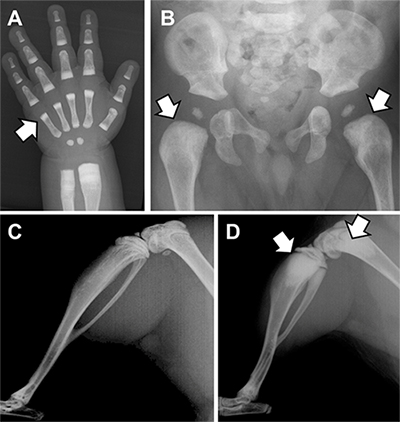
図2 骨硬化性骨幹端異形成症とLRRK1ノックアウトマウスのX線像
AとBは患者、Cは正常マウス、DはLRRK1ノックアウトマウス。患者とマウスの骨格異常が極めて似ていることが分かる。
A:左手正面像。短管骨の骨幹端(矢印)に硬化を認める。
B:骨盤正面像。大腿骨近位の骨幹端(矢印)が幅広で硬化を認める。
C:正常マウスの下肢側面像。
D:LRRK1ノックアウトマウスの下肢側面像。長管骨の骨幹端(矢印)に重度な硬化を認める。
