要旨
理化学研究所(理研)統合生命医科学研究センター骨関節疾患研究チームの池川志郎チームリーダー、中島正宏研究員らの研究チームは、後縦靭帯骨化症(OPLL:ossification of the posterior longitudinal ligament of the spine)の発症に関わる遺伝子「RSPO2(R-spondin 2)」を発見し、分子レベルでその作用を明らかにしました。
OPLLは、背骨を上下に連結し背骨の中を縦に走る後縦靭帯が骨になった結果、脊髄の入っている脊柱管が狭くなることで脊髄や神経を圧迫し、手や足のしびれや痛み、運動障害などを引き起こす疾患です。日本での患者数は潜在的な患者も含めると100万人以上と考えられていますが注1)、現在は根本的な治療法がありません。OPLLの発症には遺伝的要因が関与すると考えられ、日本を中心に原因遺伝子の探索が行われてきました。研究チームはゲノムワイド相関解析(GWAS)[1]を行い、OPLLの発症しやすさ(疾患感受性)に関わる6つのゲノム領域を2014年に世界に先駆けて発見しています注2)。今回、研究チームは6つのゲノム領域の1つから、OPLLの発症に関わる遺伝子、RSPO2を同定しました。
研究チームは理研のFANTOM5[2]などのビッグデータを利用して、OPLLの発症に関わる6つのゲノム領域の内の1つの8q23.1領域から疾患感受性一塩基多型(SNP)[3]の候補を絞り込み、それらのSNPを含む配列が発現量に影響を及ぼす遺伝子を推定しました。RSPO2、EIF3E、EMC2の3つが疾患感受性遺伝子[4]の候補に挙がりました。RSPO2は靭帯、軟骨、骨に特異的に発現しており、OPLLの骨化メカニズムとして考えられている内軟骨性骨化[5]の軟骨初期分化過程において発現が低下していましたが、他の2つの遺伝子には変化がありませんでした。
RSPO2にコードされるタンパク質であるRSPO2はWnt/β-カテニンシグナル[6]を活性化することにより、内軟骨性骨化の軟骨初期分化を抑制しました。また、疾患感受性SNPはRSPO2の発現量を制御し、OPLLに罹りやすいタイプのSNPを持つ人は、RSPO2の発現量が低下していることを発見しました。このことから、RSPO2は靭帯細胞の分化を制御するゲートキーパー[7]で、RSPO2の発現量の低下は、靭帯になるべき間葉系幹細胞[8]を軟骨に分化させ、内軟骨性骨化を引き起こし、OPLLを発症すると考えられます。
本成果は、今後、RSPO2をターゲットした新しいタイプのOPLL治療薬の開発へとつながると期待できます。
本研究は、日本医療研究開発機構難治性疾患実用化研究事業「後縦靭帯骨化症の病態解明・治療法開発に関する研究」(研究代表者 慶應義塾大学医学部整形外科 松本守雄教授)、および、全国脊柱靭帯骨化症患者家族連絡協議会(増田靖子会長)からの支援を受けて行われました。
成果は、アメリカ人類遺伝学会の機関誌『American Journal of Human Genetics』に掲載されるのに先立ち、オンライン版(6月30日付け:日本時間7月1日)に掲載されます。
注1)Sasaki E, Ono A, Yokoyama T, Wada K, Tanaka T, Kumagai G, Iwasaki H, Takahashi I, Umeda T, Nakaji S, Ishibashi Y. Prevalence and symptom of ossification of posterior longitudinal ligaments in the Japanese general population. J Orthop Sci. 19:405-411,2014. doi: 10.1007/s00776-014-0552-0.
注2)2014年7月28日プレスリリース「後縦靭帯骨化症(OPLL)の発症に関わる6つのゲノム領域を発見」
背景
脊柱靭帯骨化症は、前縦靭帯、後縦靭帯、黄色靭帯など、背骨を支えている靭帯(脊柱靭帯)が骨に変わってしまう難病の総称です。そのなかでも最も頻度が高く、かつ治療が困難なのが、後縦靭帯骨化症(OPLL:ossification of posterior longitudinal ligament of the spine)です。
後縦靭帯は、背骨の後ろ側にあって背骨を縦につないでいる靭帯です。OPLLは、この後縦靭帯が骨に変わる(骨化する)ことで起きる疾患です(図1)。
骨化した後縦靭帯は脊髄や神経を圧迫して、手や足のしびれや痛み、運動障害などさまざまな症状を引き起こします。日本での患者数は潜在的な患者も含めると100万人以上と考えられています。OPLLには、現在のところ根本的な治療法はなく、理学療法や鎮痛薬の投与などの保存的治療と手術で対応しており、厚生労働省の指定難病に指定されています。
過去の疫学研究などから、OPLLは遺伝因子と環境因子の相互作用により発症する多因子遺伝病であることが明らかになっています。これまで日本を中心とした研究グループが連鎖解析や候補遺伝子アプローチによる相関解析など、さまざまな手法を用いてOPLLの原因遺伝子の探索を行ってきました。研究チームはOPLLのゲノムワイド相関解析(GWAS)を行い、OPLLの発症に関連する6つのゲノム領域を2014年に世界に先駆けて発見しています。
これまでさまざまな疾患でGWASが行われ、各疾患の発症に関連する多くのゲノム領域が発見されましたが、その後に続くべき疾患感受性遺伝子の同定に成功した例は少数しかありません。GWASで同定したOPLLの発症に関連するゲノム領域には、複数の遺伝子が存在しました。OPLLの原因や病態を解明するためには、GWASのゲノム領域から疾患感受性遺伝子を見つけ出し、その機能を解明することが重要です。そこで研究チームは、OPLLの疾患感受性遺伝子の同定に挑みました。
研究手法と成果
研究チームは、理研のFANTOM5などのビッグデータを利用して、OPLLの発症に関連する6つのゲノム領域のうちの1つの8q23.1領域から疾患感受性一塩基多型(SNP)の候補を絞り込み、候補SNPを含む配列が発現量に影響を及ぼす遺伝子を推定しました。その結果、RSPO2(R-spondin 2)、EIF3E、EMC2の3つが疾患感受性遺伝子の候補に挙がりました。特に、RSPO2は靭帯、軟骨、骨に特異的に発現しており、OPLLの骨化メカニズムとして考えられている内軟骨性骨化の軟骨初期分化過程において発現が低下していました。一方、他の2つの遺伝子に発現変化はありませんでした。
そこで、試験管内で軟骨細胞の分化を再現できるモデルであるATDC5細胞を用いて、RSPO2にコードされるタンパク質であるRSPO2の軟骨初期分化における機能を調べました。ATDC5細胞が軟骨細胞に分化する環境でRSPO2を加えて培養すると、RSPO2は軟骨細胞への分化を抑制しました。さらに、ATDC5細胞にRSPO2の働きを抑制する中和抗体を加えて培養すると、軟骨細胞への分化が促進されました。これらの結果から、RSPO2は内軟骨性骨化の抑制因子であることが分かりました。次に、RSPO2の軟骨細胞分化の抑制メカニズムを調べました。RSPO2は軟骨細胞の分化に重要な働きをするWnt/β-カテニンシグナルの活性化を介して、間葉系幹細胞から軟骨細胞への分化を抑制しました。
また、OPLLの発症と関連する8q23.1領域の疾患感受性SNPの候補SNPの1つであるrs374810は、RSPO2の遺伝子発現を制御している領域に存在しました。このSNPの周囲にはC/EBPβという転写因子[9]が結合しますが、OPLLに罹りやすいタイプのSNPにはC/EBPβの結合が弱く、RSPO2の発現量が少なくなることが分かりました。さらに、OPLLに罹りやすいタイプのSNPを持つヒト由来の培養繊維芽細胞では、RSPO2の発現量が低下していました(図2)。RSPO2の発現量が低下した結果、RSPO2による軟骨細胞分化の抑制が弱まり、骨化が起こりやすくなることで、OPLLを発症すると考えられます(図3)。
今後の期待
これまでさまざまな疾患のGWASで、各疾患の発症に関連するSNPが報告されてきましたが、実際に疾患感受性SNPおよび疾患感受性遺伝子の同定に成功する例は少数でした。今回は、ビッグデータの有効利用と専門的な実験系による検証により、それを可能としました。今後、同様のアプローチにより、さまざまな疾患の感受性遺伝子が発見されることが期待できます。
今回の結果は、SNPによるRSPO2の発現変動がOPLLの発症、進展に重要な役割を担うことを示しています。今後、RSPO2がOPLLの発症に関わる経路をさらに詳しく調べることで、OPLLの病態の理解が進み、新しいタイプのOPLL治療薬の開発が可能になることが期待できます。
原論文情報
- Masahiro Nakajima, Ikuyo Kou, Hirofumi Ohashi, and Shiro Ikegawa., "Identification and Functional Characterization of RSPO2 as a Susceptibility Gene for Ossification of the Posterior Longitudinal Ligament of the Spine", American Journal of Human Genetics, doi: 10.1016/j.ajhg.2016.05.018
発表者
理化学研究所
統合生命医科学研究センター 骨関節疾患研究チーム
チームリーダー 池川 志郎(いけがわ しろう)
研究員 中島 正宏(なかじま まさひろ)
 池川 志郎
池川 志郎
 中島 正宏
中島 正宏
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.ゲノムワイド相関解析(GWAS)
疾患の感受性遺伝子を見つける方法の1つ。ヒトのゲノム全体をカバーする一塩基多型(Single Nucleotide Polymorphism: SNP)を用いて、疾患を持つ群と疾患を持たない群とでSNPの頻度に差があるかどうかを統計学的に比較する解析方法。GWASは、Genome-Wide Association Studyの略。 - 2.FANTOM5
理化学研究所が中心となり結成した国際研究コンソーシアムFANTOMの第5期プロジェクト。FANTOM5には20カ国、100以上の研究機関が参加し、ヒトの主要な組織、初代培養細胞、細胞株を対象にゲノムワイドな解析を行った。185,000個のプロモーターと44,000個のエンハンサーの遺伝子制御活性を測定し、正常な細胞や細胞株の体系的な定義を得ることができた。
2014年3月27日プレスリリース「 ゲノム上の遺伝子制御部位の活性を測定し正常細胞の状態を定義」 - 3.一塩基多型(SNP)
ヒトのゲノムはおよそ30億の塩基対からなるが、その配列は個人間で0.1%程度異なっている。その配列の違いのうち、集団での頻度が1%以上のものを遺伝子多型と呼ぶ。遺伝子多型の中で、一塩基の違いによるものを一塩基多型という。 - 4.疾患感受性遺伝子
単一遺伝子病の原因遺伝子のように遺伝子に変異があると必ず発症するというものではなく、変異があると発症しやすくなったり、逆に発症しにくくなったりする遺伝子。 - 5.内軟骨性骨化
骨形成過程の一つで、間葉系幹細胞から一旦軟骨が作られ、これが骨に置き換えられる。 - 6.Wnt/β-カテニンシグナル
Wntとは分泌性の糖タンパク質。Wntにより、β-カテニンが核の中に移動して遺伝子の転写を活性化する。 - 7.ゲートキーパー
直訳すると「門番」。幹細胞はいろいろな細胞へと運命付けられ、成熟して最終的に機能する細胞へと分化する。細胞の運命決定因子をゲートキーパーという。 - 8.間葉系幹細胞
軟骨、骨、脂肪細胞への分化能を持つ未分化細胞。 - 9.転写因子
特定のDNA配列に結合して遺伝子の発現を制御するタンパク質。
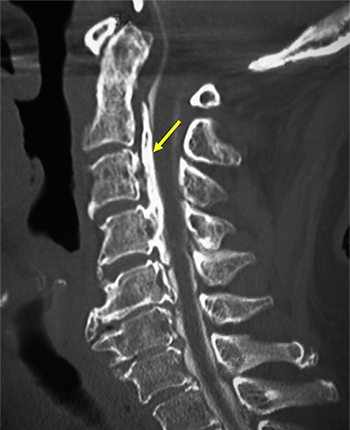
図1 後縦靭帯骨化症(OPLL)患者のCT画像
頸椎(首の部分)の側面から見たCT画像。矢印は骨化した後縦靭帯。
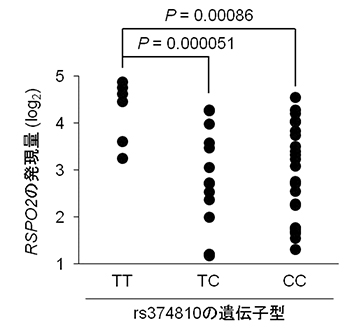
図2 疾患感受性SNP(rs374810)の遺伝子型とRSPO2の発現量との関係
RSPO2の発現量をrs374810の遺伝子型別に比較した。このSNPにおいて、OPLLに罹りやすいタイプであるシトシン(C)を2つ持っているCC型やシトシンの1つがチミン(T)に変わったTC型の人では、TT型の人に比べ、RSPO2の発現量が少ない。P(値)は、偶然にそのようなことが起こる確率を表す。
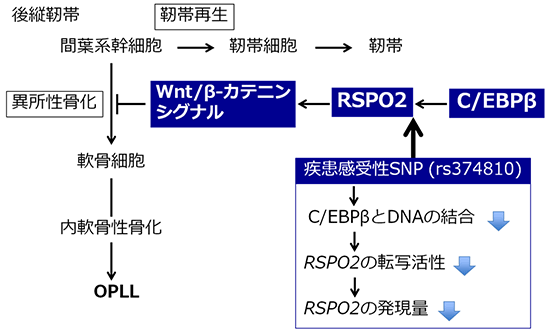
図3 OPLLにおけるRSPO2の役割
靭帯の再生過程において、RSPO2はWnt/β-カテニンシグナルの活性化を介して、間葉系幹細胞から軟骨細胞への分化を阻害する。OPLLに罹りやすいタイプのSNP(rs374810)にはC/EBPβの結合が弱く、結果として、RSPO2の発現量が少ない。
